Білок PDZ
Білки PDZ - це білки, які взаємодіють з різними мембранними та цитозольними білками, модулюють діяльність їх зв'язуючих партнерів, асоціюють партнерів з цитоскелетними білковими комплексами поблизу мембрани та набирають сигнальні білки (Kim & Sheng, 2004).
Пов’язані терміни:
- Фермент
- Білок
- Мутація
- Клітинна мембрана
- Послідовність карбоксильних терміналів
- Домен PDZ
- Ліганд
- Фосфорилювання
Завантажити у форматі PDF
Про цю сторінку
Фармакологія рецепторів, зчеплених з G білками
Гільєрмо Ромеро,. Пітер А. Фрідман, у Досягненнях фармакології, 2011
Анотація
Хлоридні рухи по клітинних мембранах
Пейїнг Фонг, Майкл А. Грей, у Досягненні молекулярної та клітинної біології, 2006
1 Номенклатура
Білки PDZ характеризуються наявністю принаймні одного виразного структурного мотиву, домену PDZ. Області домену PDZ складаються приблизно з 80–90 амінокислот. Структурні дослідження показують, що ці амінокислоти організовані у вигляді шести антипаралельних β-ланцюгів та двох α-спіралей, які утворюють каналку, що зв’язує ліганд. В даний час улюблена номенклатура PDZ випливає з того факту, що спочатку ці мотиви були розпізнані в білках постсинаптичної щільності мозку щурів (PSD-95; Cho et al., 1992), перегородкові з'єднання, що пов'язують епітелій дрозофіли (Discs Large protein, the product гена супресора пухлини dlg) (Woods and Bryant, 1991) та TJs епітелію ссавців (ZO ‐ 1) (Itoh et al., 1993; Willott et al., 1993). Однак домени PDZ також згадувались як домени DHR (для великої гомологічної області дисків) та GLGF (після збереженого мотиву послідовності амінокислот) у ранній літературі.
Чо та співавт. (1992) вперше визнав структурну гомологію, яка існує між PSD-95 та раніше ідентифікованим білком Discs Large. Цікаво, що обидва мають не тільки три домени PDZ на відповідних N-кінцях, але вони також мають схожу загальну доменну структуру: домени PDZ супроводжуються доменом src homology 3 (SH3), а також гуанілат-кіназою (GK) домен. Незабаром після цього з’ясування первинної структури епітеліального білка TJ, ZO ‐ 1, також виявило той самий загальний план тіла. Важливо мати на увазі, що хоча ці три визначальні члени білків домену PDZ також складають клас мембранно-асоційованих гуанілат-кіназ (MAGUK), не всі білки PDZ є MAGUK. Як буде обговорено, різноманітні білки містять домени PDZ. Завдяки своєму зв’язуванню зі специфічними С-кінцевими пептидними послідовностями, внутрішньо локалізованими послідовностями та навіть з PDZ-регіонами всередині лігандів, домени PDZ в кінцевому підсумку забезпечують різноманітний спектр вузькоспеціалізованих функцій.
Том 1
Поляризована експресія білків PDZ в епітеліальних клітинах
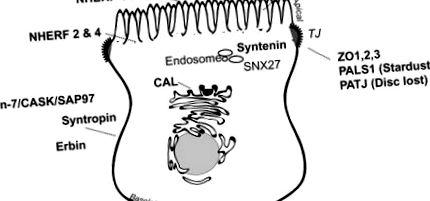
Ряд білків PDZ переважно експресується в поляризованих мембранних доменах або в критичних сортувальних відділеннях (рис. 14.2), де вони виконують операції утримання/сортування та організовують локальні сигнальні комплекси в поляризованих локалізаціях. 34 Приклади PDZ-білків, які переважно мешкають на базолатеральній мембрані певного кишкового та ниркового епітелію, включають синтрофін 35 (див. "Білково-асоційований дистрофіновий комплекс" нижче), Lin-7 36,37 (див., ”Внизу), ErbB взаємодіючий білок, ERBIN, 38 та деякі члени сімейства гуанілаткіназ, пов’язаних з мембраною, білків PDZ, такі як CASK, 39 PSD-93, 40 та SAP97 (він же Дисковий великий гомолог 1 41). Інші білки PDZ, включаючи фактори регулятора водневого обміну натрію (див. “NHERF”, нижче), Shank2E, 42 та PSD-95, 40, в основному експресуються на апікальній мембрані або поблизу неї. Деякі білки PDZ, такі як zonula occludens, PALS1 (Stardust) та PATJ (Disc lost), 43 відіграють важливу роль у генерації та підтримці щільного з'єднання. 44 Інші, такі як CAL, який головним чином знаходиться в Golgi 45 або SNX27, 46 та синтенін, 47,48, що знаходяться в ендосомах, перебувають у біосинтетичних або ендоцитотичних сортувальних відділеннях.
Малюнок 14.2. Основні білки PDZ в епітеліальних клітинах.
PDZ-домен, що містить білки, диференційовано локалізується до меж кисті епітеліальних клітин, субапікальних доменів, ендосом, щільних з’єднань та базолатеральних мембран.
Мотив, що зв’язує PDZ, може служити поляризованим сортуванням 49 або сигналом утримання. 50 Один із перших прикладів з’явився в результаті досліджень з транспортерами ГАМК або ГАТ 51; видалення PDZ-зв'язуючого мотиву з апікальної ізоформи GAT-3 призвело до випадкового локалізації транспортера як на верхівковій, так і на базолатеральній мембранах. 52 Встановлено також, що для експресії базолатеральної мембрани кількох мембранних білків необхідний PDZ-зв'язуючий мотив. Наприклад, рецептори ERBB, які відіграють вирішальну роль у морфогенезі та онкогенезі, взаємодіють з базолатеральним білком PDZ, який називається ERBIN, і вимагають PDZ-зв'язуючого мотиву для експресії базолатеральної мембрани. 38 ERBIN націлений на базолатеральну мембрану завдяки своєму багатому лейцином домену повторення. 53 Ефективна експресія базолатеральної мембрани ряду транспортерів, які взаємодіють з базолатеральним білком PDZ Lin-7, також вимагає інтактного сайту зв'язування PDZ (див. Нижче).
Пресинаптичне регулювання ліпринами
К. Міллер, Д. Ван Вактор, в Енциклопедії неврології, 2009
Ліпрін-α, GRIP та GluR2
GRIP - це білок, що містить мульти-PDZ-домен, який зв’язує ліпрін-α, а також рецептори і ліганди ефріну, а також член сімейства моторних білків кінезин-3 KIF1A. Пропоновано, щоб GRIP були посередниками транспорту глутаматних рецепторів, стабілізації рецепторів у межах постсинаптичної щільності та сортування інтерналізованих рецепторів. GRIP1 міститься в синаптичних препаратах та внутрішньоклітинних компартментах. Сюди входять передбачувані транспортні пухирці для рецепторів глутамату. Генетичний аналіз на мишах показує, що GRIP1 необхідний на ранніх етапах розвитку, оскільки нокаут GRIP1 є ембріональним летальним на 12-й день, і ембріони страждають від дефектів у формі з'єднання між дермою та епідермісом.
З огляду на вагомі докази того, що (1) ліпрін-α взаємодіє з GRIP, (2) DGRIP виявляється в м’язах, і (3) взаємодія між ліпріном-α та GRIP пов’язана з кластеризацією рецепторів глутамату, дивно, що порушення ліпріну-α не призводить до зменшення постсинаптичної чутливості (тобто амплітуди міні-збудливих потенціалів переходу). Тим не менше, оскільки повне врятування синаптичної функції може бути здійснено за допомогою селективної експресії ліпріну-α (SYD-2) у нейронах, можливо, що ліпрін-α може відігравати незначну роль у постсинаптичному функціонуванні у безхребетних, і більш важливу роль у синапсах хребетних.
М’язові дистрофії
Молекулярний патогенез
ZASP (Z-диск, альтернативно зрощений білок, що містить домен PDZ, генний продукт LDB3) є компонентом Z-диска. Відомі взаємодії з α-актиніном (див. Рисунок 16.1) (Selcen and Engel, 2005), з білками ALP і FATZ (Huang et al., 2003; Klaavuniemi et al., 2006), а також були показані з небулайтами та протеїнкіназою C (te Velthuis et al., 2007). ZASP є членом сімейства білків PDZ/LIM, які, серед іншого, беруть участь у динаміці актинів (te Velthuis et al., 2007). Більшість мутацій, що спричиняють дистальну дистрофію, знаходяться в екзоні 6. Ця область білка важлива для специфічних для скелетних м’язів ізоформ і містить збережений домен ZM, необхідний для зв’язування α-актиніну (Klaavuniemi et al., 2006). За допомогою імуногістохімії агрегації міофібрилярних білків у зразках м’язів пацієнтів виявляють більше відхилень від міотиліну, αB-кристаліну та десміну, ніж сам ZASP (Griggs et al., 2007). Таким чином, ZASP може забезпечити функцію лінійки для розташування цих інших компонентів Z-диска, і, можливо, це пов'язано з тим, що нокаутовані миші ZASP виявляють важкий фенотип, тоді як миші-нокаути міотиліну мають більш м'який фенотип (Zhou et al., 2001).
Дистальні міопатії
Молекулярна генетика
Дві мутації в ZASP (Z-диск, альтернативно сплайсирований білок, що містить домен PDZ, який також називають геном LDB3) часто асоціюються з цим видом дистальної міопатії. 42 Причинною мутацією A165V у родині Марксбері-Гріггса було показано, що мутація давнього європейця-засновника базується на відносно короткому загальному гаплотипі навколо мутації у шести випробуваних не пов'язаних родинах. 17 Інша повторювана мутація ZASP, A147T, викликає ідентичний фенотип. Ці мутації знаходяться в актинозв’язуючому домені ZASP і спричиняють порушення актинових ниток скелетних м’язів. 41
Том 2
Білково-білкові взаємодії Na/Pi-ко-транспортерів типу II
Внутрішньоклітинне сортування, гормональна регуляція та стабільність у плазматичній мембрані даного білка можуть контролюватися через його асоціацію з взаємодіючими партнерами. За допомогою гібридного скринінгу дріжджів-двох було виявлено кілька білків, які взаємодіють з NaPi-IIa та NaPi-IIc. На сьогодні не виявлено жодних білків, які можуть взаємодіяти з транспортером PiT-2.
Асоційовані білки NaPi-IIa
NaPi-IIa взаємодіє, серед іншого, з кількома білками, що містять домен PDZ, а саме з чотирма членами сімейства NHERF 76,84,91,101 та Shank2E 26 (рис. 68.3). Важливо, що ці п’ять білків розташовані або в нирковій проксимальній зоні ВВМ (NHERF1, NHERF3 і Shank2E), або в її безпосередній близькості (NHERF2, NHERF4). 84159
Біохімічні дослідження показали, що взаємодія NaPi-IIa з PDZ-білками вимагає присутності останніх трьох амінокислотних залишків (TRL) і залучає конкретні домени PDZ всередині NHERF. 91 NaPi-IIa взаємодіє з першим PDZ-доменом NHERF1, і ця взаємодія регулюється гормонально за допомогою механізму, що передбачає фосфорилювання NHERF1 (див. Нижче). 94,95,113,114 Відсутність NHERF1 або запобігання його асоціації з NaPi-IIa призводить до неправильної локалізації котранспортера. 86,93,171 Таким чином, миші з дефіцитом NHERF1 характеризуються гіперфосфатурією через знижену експресію NaPi-IIa у ВВМ. 86 Оскільки проксимальний ВВМ сильно збагачений актином, молекулярний механізм, за допомогою якого NHERF1 контролює апікальну експресію NaPi-IIa, може покладатися на здатність NHERF1 зв'язуватися з цитоскелетом актину через його ERM-зв'язуючий домен. 159 Незважаючи на те, що миші з дефіцитом NHERF1 є фосфатуричними, миші нормофосфатемічні, 86 що передбачає компенсаторний позанирковий механізм. У мишей NHERF2 -/- спостерігали нормальну фосфатурію та нормальну апікальну експресію NaPi-IIa. 98159
NHERF3, раніше відомий як PDZK1, також колокалізується з NaPi-IIa в BBM проксимальних канальців. 76 На відміну від NHERF1, NHERF3 не має домену, здатного зв'язуватися з цитоскелетом актину. Однак його присутність у проксимальному BBM може пояснюватися його здатністю гетеродимеризуватись NHERF1. 76,91 Тим не менше, фізіологічна роль взаємодії NHERF3 з NaPi-IIa залишається невідомою, оскільки відсутність NHERF3 не впливає ні на експресію, ні на регуляцію NaPi-IIa. 11,99
Асоційовані білки NaPi-IIc
NaPi-IIc взаємодіє з NHERF1 та NHERF3, але не з іншими PDZ-білками, які асоціюються з NaPi-IIa. 135 Однак NaPi-IIc не містить типового C-кінцевого PDZ-зв'язуючого мотиву, а молекулярні домени, що беруть участь у взаємодіях, відрізняються від таких, як NaPi-IIa. На відміну від NaPi-lla, 99 хронічна адаптація NaPi-llc до низької Pi-дієти порушується у мишей з дефіцитом PDZK1. 49
Сигналізація бегемота при проліферації, міграції та ангіогенезі клітин
Зробіть 14-3-3 білки, що впливають на сигналізацію бегемотів?
Для рекапітуляції TAZ є транскрипційним коактиватором, що володіє доменом взаємодії білка PDZ. Після негативного регулювання фосфорилюванням, опосередкованим латами, TAZ та YAP призводять до прояву супресорних ефектів шляху Бегемота на клітинну проліферацію та індукцію апоптозу та інгібування ангіогенезу. TAZ - це 14-3-3-зв'язуючий білок, і тому законно, тому роль 14-3-3 білків вимагає обговорення.
Білки 14-3-3 є повсюдно експресованими білками і пов'язані з сигналізацією проліферації клітин, апоптозом, динамікою цитоскелета і відіграють вирішальну роль у розвитку та поширенні пухлини. Деякі з них є супресорами пухлини, а інші - промоторами. 14-3-3 діють шляхом зв'язування з фосфорильованими сериновими/треоніновими мотивами на цільових білках та модулюють їх функцію. Таким чином вони впливають на кілька сигнальних шляхів і позитивно чи негативно регулюють рухливість та інвазію клітин, а також проліферацію та апоптоз клітин, ЕМТ та метастазування. Важливим аспектом діяльності 14-3-3 є те, що вони зв'язуються з важливими сигнальними білками та регулюють їх внутрішньоклітинну транслокацію та локалізацію та розподіл із серйозними наслідками для передачі сигналу.
Спосіб дії, яким 14-3-3 білки впливають на передачу сигналів Бегемота, є предметом деяких досліджень. Зосереджено увагу на змінах субклітинної локалізації ефекторних молекул, спричинених взаємодією з 14-3-3 білками. Ядерна транслокація гомолога Мерліна FRMD6, який є вищим за течією регулятором бегемота, перешкоджає зв'язуванню 14-3-3 (Meng FB et al., 2015). Оскільки Мерлін регулює активацію MST1 та MST2, активація Lats та інактивація YAP, інгібуючи рух у ядро FRMD6, вимкне супресорну функцію бегемота.
Інший запропонований механізм полягає в тому, що транслокація YAP в ядро може перешкоджати зв'язуванню з 14-3-3 білками, такими як 14-3-3σ, з YAP. Коли таке зв’язування запобігається, інгібуючі ефекти 14-3-3σ на проліферацію клітин блокуються (Sambandam et al., 2015). Раніше Lei QY та співавт. (2008) повідомили, що фосфорилювання Латса створило 14-3-3 місця зв'язування в TAZ, і тоді TAZ, здавалося, був секвестрований на 14-3-3 і утримувався в цитоплазмі, що призвело до ефективної інактивації TAZ. Не було б поза контекстом зазначити тут, що 14-3-3ζ, що сприяє проліферації клітин та агресії пухлини, знижує регулювання 14-3-3σ. Це було запропоновано як механізм, що бере участь у подвійній функції TGF-β як супресорного ефекту на ранніх стадіях туморогенезу та як промотор прогресування на пізніх стадіях розвитку пухлини. Зниження регуляції 14-3-3σ, схоже, пов'язане із зміною сигнальних партнерів Smad та з переходом TGF-β з його супресорної функції пухлини на режим промотору пухлини (Xu J et al., 2015).
Білки 14-3-3 взаємодіють з YAP, і цей комплекс зв’язується з судинним ендотелієм-кадгерином, який виникає в місцях сполучення клітин ендотелію, ефективно запобігаючи субклітинній транслокації YAP (Giampietro et al., 2015). Як зазначалося раніше, вертепорфін інактивує YAP, і це відбувається через регуляцію та зв'язування з 14-3-3σ. Це ефективно секвеструє YAP в цитоплазматичний компартмент і націлене на опосередковану протеасомами деградацію (Wang C et al., 2016).
Білок 14-3-3 міг би впливати на бегемота, впливаючи на функцію кіназ Латса. Фосфорилювання YAP створює сайти зв'язування для 14-3-3 білків. Місце фосфорилювання Латса ізоформи CHO1 кінезину також є сайтом зв'язування для 14-3-3 (Fesquet et al., 2015), і це може бути важливим фактором у функції ізоформ кінезину в процесі цитокінезу. Дефосфорилювання ТАЗ і запобігання його зв'язуванню 14-3-3 сприяють його ядерній локалізації. Показано, що сигналізація Canonical Wnt активує TAZ таким чином (Byun MR et al., 2014). Подібним чином дефосфорилювання YAP2 призводить до його накопичення в ядрі та транскрипційної активності (Wang P et al., 2011).
Хлоридні рухи по клітинних мембранах
Хейлі Дж. Шандро, Джозеф Р. Кейсі, у Досягненні молекулярної та клітинної біології, 2006
C Взаємодія, опосередкована доменом PDZ
Транспортери SLC26 мають домен PDZ типу 1 на своєму крайньому цитоплазматичному С-кінці. Мотивом взаємодії білків PDZ є C-кінцевий T/SXϕ, де ϕ є гідрофобною амінокислотою (Caplan, 1997; Songyang et al., 1997). PDZ-містять білки допомагають підтримувати полярність клітин і їх функціонування (Aroeti et al., 1998; Fanning and Anderson, 1999). Функція PDZ-мотивів у білках SLC26 до кінця не вивчена. У нирках SLC26A6 може взаємодіяти з іншими транспортерами, такими як NHE3, через білки PDZ, що підмощують (Ko et al., 2002b; Gisler et al., 2003; Lohi et al., 2003). Два білки можуть функціонувати спільно в нирках для підтримки гомеостазу NaCl та транспорту HCO 3 (Gisler et al., 2003). NHE3 імпортує Na + в обмін на протони. Потрапляючи в просвіт, протони реагують з HCO 3 -, що призводить до припливу Cl - до клітин нирок за допомогою SLC26A6 (Knauf et al., 2001; Schwartz, 2002; Wang et al., 2002). PDZ будівельні білки можуть дозволити цим транспортерам бути фізично складними. Транспортери сімейства SLC26 також можуть взаємодіяти з CFTR через мотиви PDZ (Ko et al., 2004). Взаємодія між транспортерами SLC26 та CFTR буде обговорено у Розділі V.D .
- Обмежене годування - огляд тем ScienceDirect
- Пролактинома - огляд тем ScienceDirect
- Мононенасичені жири - огляд тем ScienceDirect
- Monocot - огляд тем ScienceDirect
- Нестача харчування - огляд тем ScienceDirect