Низьке споживання фолієвої кислоти та рівень сироватки крові пов’язані з більш високим індексом маси тіла та накопиченням жиру в животі: контрольне дослідження
Анотація
Передумови
Нещодавно було підкреслено зв’язок між метаболізмом фолатів та ожирінням, що свідчить про те, що дефіцит фолатів може призвести до збільшення маси тіла та ожиріння. Таким чином, ми хотіли визначити, чи неефективність метаболізму фолатів спричинена генетичними варіаціями MTHFR і DHFR гени в метаболізмі фолатів, або недостатнє споживання фолатів, пов'язане з ожирінням.
Методи
У Познані, Польща, було проведено дослідження «випадок-контроль», що включало 421 здорового учасника (у віці 20–40 років). Випадками були 213 суб'єктів з ІМТ> 25 кг/м 2, тоді як у контролі були 208 суб'єктів з ІМТ 2. Генотипування rs70991108 (DHFR) та rs1801133 (MTHFR) проводили за допомогою зондів TaqMan. Концентрації фолатів у сироватці крові вимірювали за допомогою імуноферментного аналізу, а гомоцистеїн оцінювали за допомогою високоефективної рідинної хроматографії.
Результати
Суб'єкти з надмірною вагою та ожирінням мали на 12% менше споживання фолієвої кислоти (стор
Вступ
Хоча зв’язок між надмірним споживанням калорій та ожирінням визнаний, вплив стану мікроелементів на визначення маси тіла досі незрозумілий [1]. Попередні дослідження показали, що люди з ожирінням, як правило, мають низький рівень споживання вітамінів і в більшій мірі схильні до дефіциту вітамінів A, B, D, E та K [2,3,4]. Кілька досліджень також припустили, що дефіцит мікроелементів, особливо вітаміну В9 (фолатів), може впливати на ліпіди [5] та енергетичний обмін [6].
Біологічно активною формою фолату є тетрагідрофолат (ТГФ), який діє як кофермент у фолат-залежних реакціях, таких як біосинтез певних амінокислот, пуринових основ та тиміну [7]. Дерегуляція метаболізму фолатів пов’язана з різними метаболічними змінами, включаючи інсулінорезистентність [8], метаболічний синдром [9], жирову хворобу печінки [10] та дисбаланс профілю ліпопротеїнів [11]. Крім того, дефіцит фолатів може призвести до збільшення маси тіла та ожиріння [12]. Кілька досліджень показали зв'язок між низьким споживанням фолієвої кислоти або низькою концентрацією фолатів у сироватці крові та більшою масою тіла, ІМТ, загальним накопиченням жиру та більшою окружністю талії [13,14,15,16]. Проте нещодавній метааналіз 16 досліджень, що вимірюють концентрацію фолатів та ІМТ, не виявив зв'язку між рівнем фолатів та ІМТ [17], залишаючи відкритим питання, чи існує ця асоціація. Хоча зв'язку між ожирінням та статусом фолієвої кислоти приділено велику увагу, роль фолієвої кислоти в ожирінні досі не пояснена. Недавні дослідження показали, що ожиріння може бути іншим фактором, що погіршує метаболізм фолієвої кислоти та впливає на його потреби [18]. Наприклад, Ortega et al. [19] показали, що жінки з ожирінням з подібним споживанням фолієвої кислоти, ніж жінки, які не страждають від нудоти, мали нижчий рівень фолієвої кислоти в сироватці крові.
Беручи до уваги всю цю інформацію, ми шукали тут, щоб перевірити гіпотезу про те, що неефективність метаболізму фолатів, спричинена генетичними варіаціями ключових генів метаболізму фолатів або недостатнє споживання фолатів, пов’язана з більшою масою тіла та надмірним накопиченням жиру в організмі. Ми вибрали лише функціональні поліморфізми SNP, такі як rs70991108 (DHFR) та rs1801133 (MTHFR), які мають відомі механізми дії. Ми одночасно брали до уваги дієтичне споживання фолатів, фолатів та гомоцистеїну (Hcy), а також генотипи MTHFR і DHFR для того, щоб дати нам всебічний погляд на зв'язки між метаболізмом фолатів та ожирінням. Загалом, ми дослідили зв'язок між: 1) споживанням фолієвої кислоти та генотипом та концентраціями фолієвої кислоти та Hcy у сироватці; 2) споживанням фолієвої кислоти, концентрацією фолатів у сироватці крові та генотипом та антропометричними параметрами.
Методи
Дизайн та учасники
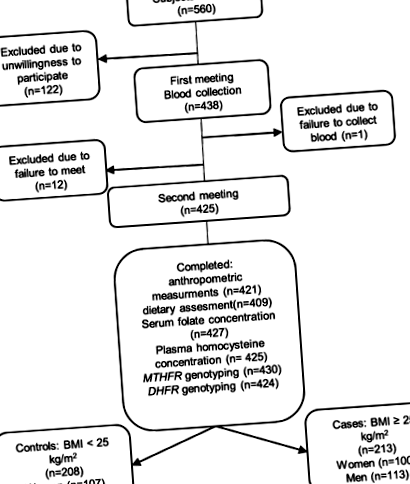
Учасники були зараховані для дослідження «випадок-контроль» [10]. Випадками були 213 суб'єктів з ІМТ> 25 кг/м 2, тоді як контролі - 208 суб'єктів з ІМТ 2. Набір проводився у Познані, Польща, за допомогою Інтернет-реклами, паперових листівок та з використанням техніки відбору проб сніжних куль. Чотириста двадцять одного здорового дорослого суб'єкта було набрано навесні та восени у 2016–2018 рр. Та відповідало критеріям включення, які полягали у тому, що вони були представниками кавказької раси та віком від 20 до 40 років. і перевагу і вживання їжі з високим вмістом жиру, критеріями виключення були вагітність або лактація; хронічні захворювання, такі як рак, діабет та гіпертиреоз; вживання ліків, які, як відомо, впливають на смак, масу тіла, ліпідний профіль або апетит, помірне або важке куріння (більше однієї упаковки на тиждень); недавні дієти; або зміна ваги понад 5 кг за останні 3 місяці. Протокол дослідження був затверджений Місцевим комітетом з етики (номер 966/2015). Хід дослідження представлений на рис. 1.
Хід дослідження
Дієтична оцінка
Споживання їжі оцінювали за допомогою триденних записів про їжу. Учасників попросили повідомити про всі харчові напої та добавки, спожиті протягом 3 днів (що складає 2 тижні та один день вихідних), у харчовому щоденнику після індивідуального навчання. Середнє добове споживання загальної енергії та середнє споживання фолієвої кислоти (дієтичний фолієвий еквівалент; DFE) оцінювали за допомогою комп'ютерного програмного пакету Diet 6.0 (Національний інститут харчування та харчування, Польща). Дієтичну структуру оцінювали з використанням апріорного підходу, який включав показник здорової дієти (ІРЧ) [20]. Для ідентифікації неправильних доповідачів (недоповідачів та надрепортерів) був використаний метод відсічення Гольдберга та Чорного. Ця процедура була детально описана в роботі Маліновська та ін. [20].
Антропометричні вимірювання
Були проведені наступні антропометричні вимірювання: зріст та вага тіла, відсоток жиру в тілі, обхват талії та стегон. Висоту вимірювали з точністю до 0,5 см за допомогою стадіометра WPT 100/200 OW (RadWag, Познань, Польща). Вагу вимірювали з точністю до 0,01 кг після нічного голодування за допомогою каліброваної шкали, включеної в Bod Pod (Cosmed, Рим, Італія). ІМТ обчислювали як масу тіла в кілограмах, поділену на зріст у метрах у квадраті. Жирову масу та худу масу тіла визначали за допомогою плетизмографії з переміщенням повітря у всьому тілі (BodPod). Випробовуваних випробовували, одягаючи лише обтягуючі компресійні шорти або купальник та шапочку для плавання. Окружність стегон і талії вимірювали за допомогою нееластичної стрічки до 0,5 см. Окружність талії вимірювали в середній точці між найнижчим ребром і вершиною гребеня клубової кістки. Всі вимірювання проводив один і той же оцінювач.
Біохімічний аналіз
Зразкам крові для біохімічних вимірювань давали згорнутися при кімнатній температурі протягом 30 хв. Сироватку відокремлювали центрифугуванням і зберігали при - 80 ° C до проведення аналізу. Концентрацію фолієвої кислоти в сироватці крові оцінювали за допомогою методу імуноферментного аналізу (набір фолієвої кислоти/вітаміну В9 ІФА, Elabscience), дотримуючись вказівок виробника. Загальні концентрації Hcy вимірювали у зразках плазми після дериватизації за допомогою високоефективної рідинної хроматографії (ВЕРХ) з УФ-детектуванням [21].
Генотипування
ДНК виділяли зі свіжої крові, зібраної в пробірках з ЕДТА, за допомогою набору крові NucleoSpin (Macherey-Nagel, Німеччина). Генотипування rs70991108 в DHFR ген і rs1801133 в MTHFR гена проводили з використанням зондів TaqMan (аналізи з однією трубкою, Thermo Scientific) на приладі LightCycler 480 (Roche Diagnostics, Швейцарія).
Статистичний аналіз
Грубий аналіз відмінностей між підгрупами ІМТ досліджували за допомогою Стьюдента т-тест. Потім для визначення асоціацій між неперервними змінними ми використовували багаторазову лінійну регресію. Моделі для ІМТ, відсоткового вмісту жиру в тілі, окружності талії та стегон та WHR були скориговані для якості дієти (HDI), фізичної активності, статі, загального споживання енергії, MTHFR і DHFR поліморфізми та неправильне повідомлення. Щоб проаналізувати зв'язок між метаболізмом фолатів та антропометричними параметрами, ми використовували багаторазову лінійну регресію з коригуванням загального споживання енергії, ІРЧП, статі, фізичної активності та неправильних звітів. Логістична регресія була використана для розрахунку коефіцієнта шансів (ОВ) надмірної ваги або ожиріння. Була протестована лише домінуюча модель успадкування. Через набагато нижчу частоту малих алелей та знаючи, що мінорний алель має причинний вплив на фенотип, ми порівняли дві групи генотипів (CC проти CT + TT у MTHFR гена та 19 bp (-/-) проти 19 bp (+/+) + 19 bp (+/−) у DHFR ген). Дані аналізували за допомогою програмного забезпечення Statistica (StatSoft, Tulsa, OK, США).
Результати
Характеристики населення
Характеристики групи представлені в таблиці 1. З 421 учасника 207 були жінками та 214 чоловіками. У загальній популяції середній вік становив 27,6 років, середнє добове споживання енергії - 2152 ккал, середнє споживання фолієвої кислоти - 340 мкг DFE/добу, середня концентрація фолієвої кислоти в сироватці - 36,5 нг/мл, а середня концентрація Hcy у плазмі крові 10,7 мкМ.
Фактори, що впливають на концентрацію фолатів та Hcy
Спочатку ми вивчили фактори, які можуть впливати на концентрацію фолієвої кислоти та концентрації Hcy у сироватці крові. Концентрація фолатів у сироватці крові була пов’язана з ІРЧП та MTHFR поліморфізм (стор Таблиця 2 Визначники концентрації фолієвої кислоти та гомоцистеїну в сироватці крові у людей у віці 20–40 років; n = 421
Метаболізм фолієвої кислоти та ожиріння
Щоб визначити різницю в метаболізмі фолатів між випадками захворювання та контролем, ми стратифікували дані за ІМТ із граничним значенням 25 кг/м 2. Суб'єкти з ІМТ вище 25 кг/м 2 мали на 12% нижче споживання фолієвої кислоти та на 8,5% нижчі концентрації фолієвої сироватки, ніж у осіб з ІМТ нижче 25 кг/м 2 (таблиця 3). Однак, незважаючи на різницю у споживанні фолієвої кислоти та рівні крові, між цими підгрупами не було значущих відмінностей у концентраціях Hcy у плазмі крові (стор = 0,15).
Ми вивчили зв'язки між метаболізмом фолатів та антропометричними вимірами за допомогою регресійних моделей. Як показано в таблиці 4, концентрація фолієвої кислоти в сироватці крові та споживання фолієвої кислоти були обернено пов'язані з відсотком жиру в організмі (стор Таблиця 4 Асоціація між антропометричними параметрами та споживанням фолієвої кислоти, концентрацією фолієвої сироватки та генами, що беруть участь у метаболізмі фолатів у людей у віці 20–40 років; n = 421
Обговорення
Іншим результатом, який заслуговує на увагу, є демонстрація зв'язку між рівнем фолієвої кислоти в крові, споживанням фолієвої кислоти та обхватом талії, при одночасному відсутності цієї асоціації з обхватом стегон. Це свідчить про те, що низький рівень фолієвої кислоти може спричинити лише накопичення жиру в животі. Ці результати відповідають висновкам Bird et al. [28] та Piyathilak et al. [30]. Механізми, що пов'язують дефіцит фолієвої кислоти та накопичення жирової тканини вісцеральної області черевної порожнини, можуть включати системний окислювальний стрес [31], метаболізм глюкози [26] та метилювання ДНК [32]. Наприклад, дослідження Piyathilak et al. [30] показали, що жінки з низькою концентрацією фолатів у плазмі мали менший рівень метилювання P1MB (мононуклеарні клітини периферичної крові) L1, що було пов’язано з більшою окружністю талії, ІМТ та відсотком жиру в організмі. Цей висновок свідчить про те, що фолат впливає на розподіл жиру в організмі за допомогою епігенетичних механізмів.
Згідно з нашими результатами та результатами інших [15], нижчі концентрації фолатів у сироватці крові у осіб з надмірною вагою та ожирінням не пов'язані з концентрацією Hcy. Ми спостерігали відсутність зв'язку між фолатом та рівнем Hcy, відповідно до Fonseca et al. [33], а також між рівнем Hcy та антропометричними вимірами. Наші результати співпадають з результатами Фонсеки та ін. та Terruzzi та ін. [33, 34], де не було виявлено взаємозв'язку між рівнями Hcy та ІМТ. Крім того, ми не знайшли зв'язку між нами MTHFR генотип та рівень Hcy, але метаболізм Hcy залежить від багатьох факторів, включаючи метаболічну здатність, дієту, стать та вік. Деякі попередні дослідження повідомляли про різні висновки. На відміну від нашого дослідження, Перейра та співавт. [16] повідомили, що рівень фолієвої кислоти в сироватці крові позитивно асоційований з фолієвою кислотою в їжі та негативно пов'язаний із вмістом Hcy у сироватці крові. Проте кілька досліджень також показали, що Hcy позитивно корелює з ІМТ, масою жиру та обхватом талії [35, 36], що свідчить про те, що Hcy може не брати безпосередньої участі в механізмах, що ведуть до ожиріння, але в деяких випадках може діяти як показник метаболічних відхилень.
Це дослідження має кілька обмежень. По-перше, ми зосередилися лише на короткотерміновому статусі фолатів і не вимірювали фолат еритроцитів; таким чином, ми не мали всебічного уявлення про статус фолієвої кислоти. По-друге, щоденне споживання дієти фолієвої кислоти було розраховано як середнє значення 3-денного споживання за допомогою триденних записів про їжу, що може бути занадто коротким періодом, щоб відображати добове споживання фолієвої кислоти. Ми вивчали лише людей у віці 20–40 років, тому висновки не можна узагальнити для інших вікових груп.
У сукупності наше дослідження показало, що фолат є одним з дієтичних мікроелементів, пов’язаних із збільшенням розвитку маси тіла, і тому може бути розумним збільшувати щоденні рекомендації щодо споживання фолієвої кислоти для людей із ожирінням, які можуть мати більші вимоги до споживання фолієвої кислоти.
Висновок
Ми продемонстрували, що низьке споживання фолієвої кислоти та рівень сироватки в крові слабо, але незалежно пов'язані з більшою масою тіла та центральним ожирінням у здорових дорослих людей у віці 20–40 років. Більше того, між ними існує значний зв’язок MTHFR генотип та рівень фолатів у сироватці крові. Однак, MTHFR і DHFR поліморфізм, здається, не має значного впливу на масу тіла.
- Високий індекс маси тіла є показником гіпотиреозу матері, гіпотироксинемії та
- Моделювання поздовжніх факторів Індекс маси тіла п’яти дітей у віці в районах Бахір-Дар
- Пізніше циркадні терміни прийому їжі пов'язані зі збільшенням жиру в організмі - Бригам і жінки; s
- Плани харчування для діабетиків Калорійність, підрахунок калорій та глікемічний індекс - ScienceDirect
- Lierac Body Slim Express Контурна гелевая сироватка для тіла 100мл - жінки від Pharmeden UK