Нецільовий метаболомічний аналіз на зразки сечі після прийому α-ліпоєвої кислоти та/або ейкозапентаенової кислоти у здорових жінок із надмірною вагою/ожирінням
Анотація
Передумови
Ейкозапентаенову кислоту (ЕРА) та α-ліпоєву кислоту (α-LA) досліджували щодо їх сприятливого впливу на ожиріння та серцево-судинні фактори ризику. У ході поточного дослідження метою було оцінити метаболічні зміни після дієтичного вживання цих двох ліпідів, як окремо, так і в поєднанні у здорових жінок із надмірною вагою/ожирінням, що сидять, після дієти з обмеженим енергоспоживанням. Для цього на зразках сечі був проведений нецільовий метаболомічний підхід з використанням рідинної хроматографії у поєднанні з часом польової мас-спектрометрії (ВЕРХ-TOF-MS).
Методи
Це короткочасне подвійне сліпе плацебо-контрольоване дослідження з паралельним дизайном харчування, яке тривало 10 тижнів. Учасників було віднесено до однієї з 4 експериментальних груп [Контроль, EPA (1,3 г/д), α-LA (0,3 г/д) та EPA + α-LA (1,3 г/д + 0,3 г/д)]. Усі групи втручання дотримувались дієти з обмеженим енергоспоживанням на 30% менше, ніж загальні витрати енергії. Проаналізовано клінічно значущі біохімічні вимірювання. Зразки сечі (24 год) відбирали на початковому рівні та через 10 тижнів. Проводили нецільовий метаболомічний аналіз зразків сечі, а також аналіз основних компонентів (PCA) та частковий дискримінантний аналіз найменших квадратів (PLS-DA) для розпізнавання картини та ідентифікації характерних метаболітів.
Результати
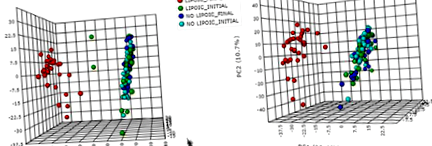
Зразки сечі були розпорошені на графіках результатів PCA у відповідь на додавання α-LA. Всього було виявлено 28 передбачуваних дискримінантних метаболітів у позитивній іонізації та 6 у негативній іонізації серед груп, чітко диференційованих відповідно до введення α-LA. Примітно наявність аскорбатного проміжного метаболіту (одного з ізомерів тригідрокси-діоксогексаноату, або дигідрокси-оксогександіонату) у групах, що поповнюються α-LA. Цей факт може бути пов'язаний з антиоксидантними властивостями як α-LA, так і аскорбінової кислоти. Кореляція між фенотиповими параметрами та передбачуваними метаболітами надала додаткову інформацію про те, чи існує між ними прямий чи зворотний зв'язок. Особливо цікавою є негативна кореляція між проміжним метаболітом аскорбату та асиметричним диметиларгініном (ADMA) та позитивна між супероксиддисмутазою (SOD) та добавкою α-LA.
Висновки
Цей метаболомічний підхід підтверджує, що сприятливі ефекти введення α-LA на зниження маси тіла можуть частково пояснюватися антиоксидантними властивостями цієї сірчанокислої карбонової кислоти, опосередкованої ізомерами тригідрокси-діоксогексаноату або дигідрокси-оксогександіонату.
Судова реєстрація
Передумови
Інші жирні кислоти, такі як ейкозапентаенова кислота (ЕРА), яка є однією з основних поліненасичених жирних кислот омега-3 (n-3 ПНЖК) морського походження, пов’язані з протизапальними властивостями [17]. У цьому контексті випробування з втручанням показало, що EPA модулює гени, пов’язані із запаленням, у жировій тканині [18]; більше того, EPA сприяє змінам у генах ремоделювання позаклітинного матриксу жирової тканини, крім збільшення хемотаксичних факторів та макрофагів, пов'язаних з репарацією рани [19]. Різні метаболомічні дослідження проводили на ЕРА та n-3 ПНЖК [9, 20]. Таким чином, ліпідомічне дослідження сприяло загальним знанням EPA щодо прогресу метаболічного синдрому (MetS), запалення та окисного стресу [20]. Випробування на людях показали непрямі асоціації з молекулярними видами ліпідів та клінічними змінними, що становлять інтерес для оцінки MetS після дієти з високим вмістом PU-n-3 PUFA та поліфенолів [9]. Отже, метою цього дослідження було оцінити вплив дієтичних добавок з α-LA та EPA окремо або в комбінації під час гіпокалорійної дієти на метаболом сечі, щоб оцінити наявність метаболічних змін між різними групами втручання.
Методи
Учасники та дизайн дослідження
На вихідному рівні та в кінцевій точці жінки, приблизно через 10–12 годин голодування, відвідали Метаболічний відділ Університету Наварри, щоб пройти співбесіду з лікарем, дієтологом та медсестрою. Антропометричні вимірювання проводили згідно зі стандартизованими рутинними протоколами, як детально описано в інших місцях [18, 23]. Критерії включення та виключення були описані раніше [21].
Дослідження було схвалено Дослідницьким комітетом Університету Наварри No 007/2009 і зафіксовано на musicaltrials.gov як NCT01138774. Усі трунарі підписали інформовану згоду перед тим, як бути прийнятими на роботу в аналіз. Втручання було проведено відповідно до останніх керівних принципів Гельсінської декларації.
Біохімічне вимірювання в крові та сечі
Зразки крові з суб'єктів, які голодували протягом ночі, зціджували на 0 і 10 тижнях у пробірки з активатором згустків сироватки (4 мл Vacuette®) та в пробірки з трикалійним ЕДТА (4 мл Vacuette®). Зразки плазми витягували з пробірок ЕДТА після центрифугування при 1500 g протягом 15 хв при 4 ° C. Всі зразки адекватно зберігали при - 80 ° C для відповідних аналізів ззаду.
Концентрації глюкози в сироватці крові, загального холестерину, ЛПВЩ-холестерину, тригліцеридів, вільних жирних кислот (FFA) та β-гідроксибутирату регулярно оцінювали за допомогою автоаналізатора Pentra C200 (HORIBA Medical, Мадрид, Іспанія). Значення холестерину ЛПНЩ розраховували за допомогою рівняння Фрідевальда. Також плазмові концентрації асиметричного диметиларгініну (ADMA) та інсуліну вимірювали відповідно до інструкцій виробника щодо наявних комерційних наборів ІФА, наданих DLD Diagnostika GMBH (Гамбург, Німеччина) та Mercodia (Уппсала, Швеція), відповідно [18]. Оцінка моделі гомеостазу (HOMA-IR) визначалася як інсулін у сироватці натще (мО/л) х глюкоза в плазмі натще (ммоль/л)/22,5 [24]. Активність супероксиддисмутази (SOD) вимірювали за допомогою набору згідно з інструкціями виробника (Assay Designs, PA, USA), як описано в інших роботах [21]. ADMA у зразках оцінювали як маркер проявів метаболічного синдрому окисного стану [25], а СОД - як біологічний маркер окисного стресу [26], як позитивний зв’язок з антиоксидантними властивостями α-LA.
Повні 24 год зразки сечі відбирали за день до початку та за день до кінцевої точки дослідження. Зразки сечі збирали у контейнер для сечі та охолоджували при 4 ° C. Як було розроблено, зразки сечі зберігали у флаконах по 1 мл при - 80 ° C до аналізу.
Підготовка зразка та аналіз ВЕРХ-TOF-MS
Всі використовувані розчинники були рідкої хроматографії-мас-спектрометрії (LC-MS) і придбані у Шарлау (Scharlab, Сентменат, Іспанія). Аналітична вода (18,2 МОм) забезпечувалась системою Ultramatic фірми Wasserlab (Барбатайн, Наварра, Іспанія). Інші стандарти були аналітичного або вищого класу, і їх постачала Sigma Aldrich (Sigma-Aldrich Chemie Gmbh, Steinheim, Німеччина).
Для оцінки якості цього метаболомічного підходу було застосовано раніше повідомлену процедуру з деякими незначними змінами [28, 29]. Було впроваджено два види контролю якості зразків (КК): i) стандартний розчин суміші з цитозину, L-карнітину гідрохлориду, бетаїну, лейцину, дезоксиаденозину та дезоксигуанозину в концентрації 1 мг/л. ii) об'єднану сечу готували шляхом змішування рівних обсягів з кожного з 130 зразків. Ці зразки вводили 5 разів на початку циклу для забезпечення рівноваги системи, а потім кожні 5 зразків для подальшого контролю стабільності аналізу. Нарешті, вибірки були рандомізовані для зменшення систематичної похибки, пов’язаної із мінливістю вимірювань. Зразки сечі аналізували послідовно по 15 проб/день.
Обробка даних та ідентифікація метаболітів
Дані LC-MS аналізували за допомогою програмного забезпечення XCMS Online (https://xcmsonline.scripps.edu) для виявлення та лінійки функцій [30,31,32,33,34]. Для вирівнювання застосовували час утримання 0,2 хв і вікно допуску маси 0,002 Да.
Було проведено пілотне дослідження для характеристики метаболітів за допомогою METLIN (https://metlin.scripps.edu/index.php) з точністю до маси нижче 5 мДа, науковою літературою та шляхами метаболізму, описаними в Кіотській енциклопедії генів та База даних геномів (KEGG) (http://www.genome.jp/kegg/), База даних метаболомів людини (HMDB) (http://www.hmdb.ca/) та Lipidmaps (http://www.lipidmaps.org /). У тих випадках, коли пошук METLIN пропонував кілька метаболітів, використання комерційних моделей дозволило нам відкинути деякі отримані варіанти, що дозволило більш точно наблизити до передбачуваного метаболіту.
Статистичний аналіз
Статистичний аналіз проводили за допомогою статистичного програмного забезпечення Stata (Випуск 12. College Station, StataCorp LLC, Техас, США). Для всіх проведених тестів була встановлена статистична значимість (двостороння) стор
Результати
Предмети
Повідомляються про основні характеристики учасників та біохімічні параметри на вихідному рівні та зміни після 10-тижневого втручання щодо 4 експериментальних груп після гіпокалорійної дієти та введення α-LA/EPA (Таблиця 1). Чотири експериментальні групи, очевидно, були однорідними на початковому рівні, де на початку дослідження не було виявлено статистичних відмінностей в жодній з оцінених змінних. ІМТ, жирова маса та зниження рівня HOMA-IR були значно вищими (стор Таблиця 1 Біохімічні та антропометричні характеристики добровольців на початковому рівні та відсоток змін
Метаболічний профіль сечі
Метод ВЕРХ-TOF-MS дозволив виявити 4.752 ознаки в режимі ESI + та 4.713 ознак у режимі ESI (дані не показані). Крім того, проведений одновимірний статистичний аналіз для вибору тих змінних, які демонструють суттєві відмінності (p Рис. 1
Аналіз основних компонентів (PCA) нецільового метаболомічного аналізу зразків сечі, включаючи групи LIPOIC FINAL, LIPOIC INITIAL, NO LIPOIC FINAL та NO LIPOIC INITIAL. a PCA в режимі позитивної іонізації (ESI +). b PCA в режимі негативної іонізації (ESI-)
Для того, щоб ідентифікувати метаболіти, відповідальні за дискримінацію серед метаболічних профілів, за оцінкою VIP було вибрано тих, хто має найбільший внесок у модель PLS-DA. Оцінки VIP - це зважена сума ваг PLS для кожної змінної та вимірює внесок кожної змінної предиктора в модель. Сполуки, що демонструють вищий бал VIP, є найбільш впливовими змінними. У цій роботі VIP-бали> 4 були використані як критерій вибору функцій, якому відповідали 28 функцій у режимі ESI + та 6 функцій у режимі ESI, вибраних таким чином для подальшої ідентифікації.
Ідентифікація передбачуваних метаболітів
Кореляція між фенотиповими параметрами та передбачуваними метаболітами може запропонувати інформацію про те, чи існує між ними прямий чи зворотний зв’язок (табл. 4). Надзвичайно цікавим є негативна кореляція між метаболітом 14 та ADMA, FFA та β-гідроксибутиратом, або позитивна з SOD, які підтримують взаємодію введення α-LA з окислювальним статусом.
Обговорення
Більш високе зниження ІМТ та жирової маси в тих групах, яким було додано α-LA, можна пояснити прямим або опосередкованим впливом цієї сірчаноорганічної сполуки, отриманої з каприлової кислоти, на метаболізм адипоцитів, регуляцію біогенезу мітохондрій, ліпідний обмін (ліполіз/ліпогенез) або запалення [ 18, 23], а також пов'язані з його роллю антиоксиданта [37] та його сприятливим впливом на гіперліпідемію [38] або серцево-судинний ризик [39].
Метаболоміка була застосована для розпізнавання образів та ідентифікації характерних метаболітів [40, 41], а також для дотримання дієти [27] метаболічних відбитків пальців [42], моніторингу захворювань [43] та результатів після лікування [44]. Нецільовий метаболічний аналіз зразків сечі, відібраних на початковому та кінцевому рівнях під час дієтичного втручання, може запропонувати інформацію про наявність дискримінантних метаболітів серед експериментальних груп, оскільки метаболоміка сприяла розшифровці реакцій організму на різні методи лікування у пацієнтів із ожирінням [45], діабет [46], жирова печінка [47] та ХОЗЛ [48]. Деякі з цих дискримінантних метаболітів, включаючи амінокислоти та пептиди, види ліпідів або харчові похідні, можуть бути встановлені як біомаркери для подальших досліджень [49,50,51] і описані в деяких ситуаціях змін ожиріння [52] або запалення. [53]. У цьому контексті оцінка ефектів α-LA (одержуваного із карбонової кислоти з 8C) та ЕРА (20C) для жінок із ожирінням/надмірною вагою під час схуднення [21] може бути корисною від підходів метаболоміки.
Дискримінантні метаболіти серед різних груп свідчать про те, що α-LA має надзвичайно важливе значення в метаболічному профілі сечі, незалежно від ефекту обмеження енергії. Отже, розрізняючі метаболіти серед груп повинні бути головним чином пов’язані з прийомом α-LA. Хоча в меншій мірі дискримінантні метаболіти можуть бути пов'язані із більшим зниженням маси тіла, змінами ліпідного обміну та чутливості до інсуліну, що спостерігаються у групах ЛІП. У будь-якому випадку, залучення незначної, але суттєво більшої втрати ваги, що спостерігається у групах, які отримують α-LA, не можна відкинути [45] або роль самого ожиріння, оскільки можуть бути задіяні амінокислоти, жирні кислоти та інші види [54,55,56].
У цьому випадку дискримінантні метаболіти збільшуються в групі LIP в кінцевій точці відносно інших груп, що свідчить про те, що катаболізм білка/ліпідів збільшується при введенні α-LA. У цьому контексті попередні дослідження пропонували ліполітичну дію α-LA як у культивованих адипоцитах [57], так і після дієтичних добавок [19]. Більше того, повідомлялося, що введення α-LA впливає на метаболізм глюкози, пригнічуючи шляхи гліколізу та Thr-Gly-Ser [58], а також забезпечуючи вуглецеві групи до циклу трикарбонових кислот [59]. Крім того, α-LA (у поєднанні з лляною олією) покращує окислювальний стрес у печінці та накопичення ліпідів [60] або зменшує окислення ЛПНЩ [61] на додаток до визнаних антиоксидантних властивостей [37]. Справді, антиоксиданти можуть модулювати окислювальний стрес та запальні реакції за допомогою взаємопов’язаних механізмів [62]. Отже, дієтичний α-LA може співпрацювати з ендогенними антиоксидантними механізмами щодо профілактики або відновлення захисних систем, де можуть виникати взаємодії та перекриття з іншими екзогенними антиоксидантами [63].
Кореляції між метаболітом 14 та ADMA або SOD можуть бути опосередковані антиоксидантною силою α-LA, описаною раніше в ряді досліджень [68], а також включаючи переваги ожиріння організму [18, 21], коли взаємодії з вітаміном С не можна відкидати [74]. Нарешті, кореляція метаболіту 14 з FFA та гідроксибутиратом [75] може бути пов’язана з меншим ІМТ, який спостерігався у групах добавок α-LA в кінцевій точці.
Висновки
Підводячи підсумок, цей метаболомічний підхід підтверджує гіпотезу про те, що сприятливі ефекти введення α-LA на зниження маси тіла можуть частково пояснити антиоксидантними властивостями цієї сірчанокислої карбонової кислоти, де взаємодія з аскорбіновою кислотою повинна бути врахована опосередкованою тригідрокси- діоксогексаноат або дигідрокси-оксогександіоат.
- Універсальний антиоксидант 5 переваг альфа-ліпоєвої кислоти
- Дубильна кислота як поліфенол рослинного походження надає захист від судин завдяки посиленню експресії KLF2 у
- Неметаболізована реакція фолієвої кислоти на дозу фолієвої кислоти під час вагітності - Флемінг -
- Терапії кислотою; підсилювач; Продукти, що утворюють луги, Едгар Кейсі; s A
- Камені сечової кислоти та плямистий далматин; Доктор Мак; s Ветеринарні казки