Молекулярний механізм запалення жирової тканини, спричиненого ожирінням; роль Мінкеля в жировій
Кафедра молекулярної медицини та обміну речовин, Науково-дослідний інститут екологічної медицини, Університет Нагої, Нагоя, Японія Департамент імунометаболізму, Медичний факультет Університету Нагої, Нагоя, Японія
2020 р. 年 67 巻 2 号 с. 107-111
- Опубліковано: 2020 Отримано: 2019/09/12 Випущено на J-STAGE: 2020/02/28 Прийнято: 2019/11/07 [Попередня публікація] Випущено: 2019/12/19 Переглянуто: -
Жирова тканина - це орган метаболізму, який накопичує тригліцериди як запас енергії; однак нещодавні дослідження показали, що жирова тканина також є ендокринним органом, який виробляє і виділяє різні гормони, що називаються адипоцитокінами. При ожирінні дисфункція жирової тканини спричинена запаленням жирової тканини, що призводить до метаболічного синдрому [1 Suganami T, Tanaka M, Ogawa Y (2012) Запалення жирової тканини та накопичення ектопічних ліпідів. Endocr J 59: 849–857.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 2]. На додаток до адипоцитів жирова тканина містить різні стромальні клітини, такі як преадипоцити, судинні клітини, імунні клітини та фібробласти, а кількість і тип клітин різко змінюються під час прогресування ожиріння Оскільки дві групи незалежно повідомляли про інфільтрацію макрофагів у жировій жировій тканині [3 Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, et al. (2003 ) Ожиріння пов’язане з накопиченням макрофагів у жировій тканині J Clin Invest 112: 1796–1808.
"data-html =" true "data-location =" bottom "data-toggle =" tooltip "> 4], багато інших дослідників виявили вплив макрофагів на тканину. Загальновизнано, що взаємодія між адипоцитами та макрофагами призводить до хронічного запалення жирової тканини, що призводить до порушення ендокринної функції, такої як продукція адипоцитокінів [5 Suganami T, Ogawa Y (2010) Макрофаги жирової тканини: їх роль у реконструкції жирової тканини. J Leukoc Biol 88: 33–39.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 5]. Однак мало що відомо про наслідки запалення жирової тканини на метаболічну функцію жирової тканини. У цій статті ми пропонуємо огляд значення макрофагів-індукованого лектину типу С (Mincle), нового регулятора запалення жирової тканини, з акцентом на його роль у запаленні жирової тканини, фіброзі та накопиченні ектопічних ліпідів.
Метаболічний синдром - це поширений метаболічний розлад, який охоплює кілька органів і пов’язаний із ожирінням та запаленням жирової тканини. Вважається, що запалення жирової тканини в основному посилюється взаємодією між збільшеними адипоцитами та макрофагами, які інфільтруються в жирову жирову тканину. Також повідомлялося, що взаємодія між насиченими жирними кислотами, одержуваними з адипоцитів, і датчиком патогену Toll-подібним рецептором 4 (TLR4), вираженим у інфільтрованих макрофагах, може призвести до хронічного запалення [6 Suganami T, Nishida J, Ogawa Y (2005) A паракринна петля між адипоцитами та макрофагами посилює запальні зміни: роль вільних жирних кислот та фактор некрозу пухлини α. Arterioscler Thromb Vasc Biol 25: 2062–2068.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 12]. Ці макрофаги M1 утворюють коронкоподібну структуру (CLS) в ожиріній жировій тканині, де мертві або відмираючі адипоцити оточені прозапальні макрофаги M1; в рамках цього CLS перехрещення адипоцит – макрофаги може відбуватися в безпосередній близькості [13 Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, et al. (2005) Смерть адипоцитів визначає локалізацію та функцію макрофагів у жирова тканина мишей із ожирінням та людей J Lipid Res 46: 2347–2355.
"data-html =" true "data-location =" bottom "data-toggle =" tooltip "> 15]. Крім того, макрофаги M1 продукують прозапальні цитокіни, такі як фактор некрозу пухлини-α (TNFα); отже, CLS є ознакою запалення жирової тканини, де кількість CLS позитивно корелює із системною резистентністю до інсуліну [16 Alkhouri N, Gornicka A, Berk MP, Thapaliya S, Dixon LJ, et al. (2010) Апоптоз адипоцитів, посилання між ожирінням, інсулінорезистентністю та стеатозом печінки. J Biol Chem 285: 3428–3438.
Для скринінгу на новий регулятор, який бере участь у запаленні жирової тканини, ми провели аналіз мікрочипів та виявили Mincle, експресія якого підвищена в макрофагах через сигналізація про насичені жирні кислоти-TLR4 [21 Ichioka M, Suganami T, Tsuda N, Shirakawa I, Hirata Y, et al. (2011) Підвищена експресія індукованого макрофагами лектину С-типу в жировій тканині мишей із ожирінням та людей. Діабет 60: 819–826.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 22]. Хоча функція Mincle раніше була невідомою, тепер зрозуміло, що Mincle розпізнає трегалозу-6,6'-диміколат (TDM), гліколіпід клітинної стінки мікобактерій та патогенні гриби (Малацетія, Кандида) стимулювати вироблення прозапальних цитокінів та хемокінів [23 Ishikawa E, Ishikawa T, Morita YS, Toyonaga K, Yamada H, et al. (2009) Пряме розпізнавання мікобактеріального гліколіпіду, трегалози диміколату, за допомогою лектину С-типу Mincle. J Exp Med 206: 2879–2888.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 24]. Тому датчики патогенних мікроорганізмів, такі як Mincle і TLR4, відіграють центральну роль у захисті від інфекції. Крім того, останні дослідження продемонстрували, що ці датчики патогенних мікроорганізмів також розпізнають ендогенні ліганди, що вивільняються з пошкоджених і мертвих клітин. Цікаво, що повідомлялося, що Mincle може відчувати смерть клітин [25 Yamasaki S, Ishikawa E, Sakuma M, Hara H, Ogata K, et al. ( 2008) Mincle - це активуючий рецептор, пов'язаний з ITAM, який сприймає пошкоджені клітини. Nat Immunol 9: 1179–1188.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 25], що вказує на роль Мінкла у стерильному запаленні. у жировій жировій тканині у людей та мишей, особливо у вісцеральній жировій тканині. Крім того, Mincle сильно експресується у прозапальних макрофагах M1 у різних імунних клітинах жирової тканини із ожирінням [26 Tanaka M, Ikeda K, Suganami T, Komiya C, Ochi K, et al. (2014) Лектин С-типу, індукований макрофагами, лежить в основі індукованого ожирінням фіброзу жирової тканини. Nat Commun 5: 4982.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 26]. Гістологічний аналіз показав, що експресія Mincle локалізована в макрофагах в CLS. Оскільки CLS асоціюється із запаленням жирової тканини, ці результати дозволяють припустити, що Мінкл бере участь у запаленні жирової тканини.
Жирова тканина складається із зрілих адипоцитів та різних стромальних клітин, клітинні компоненти яких сильно змінюються з урахуванням маси тіла. При хронічному запаленні безперервна взаємодія між паренхіматозними та стромальними клітинами призводить до динамічних морфологічних змін, що називаються «ремоделювання жирової тканини». Гіпертрофічні адипоцити продукують і секретують велику кількість запальних цитокінів, таких як TNFα, інтерлейкін-6 (IL-6) та насичені жирні кислоти, які індукують резистентність до інсуліну. З іншого боку, адипонектин, протизапальний цитокін, міститься в меншій кількості і обернено корелює із ожирінням. Крім того, ожиріння жирової тканини, як повідомляється, стає фіброзним і накопичує менше тригліцеридів [27 Sun K, Tordjman J, Clement K, Scherer PE (2013) Фіброз і дисфункція жирової тканини. Cell Metab 18: 470-477.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 27]. Щоб вивчити роль Мінкле у запаленні жирової тканини, ми проаналізували ожиріння з дефіцитом Мінкеля та дикого Мишей типу Х. Хоча не було суттєвої різниці у масі тіла, маса епідидимального жиру була значно вищою, а маса печінки була значно нижчою у мишей з дефіцитом мінкла порівняно з мишами дикого типу на дієті з високим вмістом жиру [26 Tanaka M, Ikeda K, Suganami T, Komiya C, Ochi K, et al. (2014) Лектин С-типу, індукований макрофагами, лежить в основі фіброзу жирової тканини, спричиненого ожирінням. Nat Commun 5: 4982.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 26]. Гістологічний аналіз показав, що миші дикого типу виявляли значний інтерстиціальний фіброз в жировій тканині, тоді як миші з дефіцитом Мінкле показали помітний Крім того, діаметр адипоцитів у жировій жировій тканині, витягнутій з мишей з дефіцитом Мінкле, був більшим, ніж у мишей дикого типу, і кількість макрофагів жирової тканини не суттєво відрізнялася між генотипами. Однак кількість CLS була Крім того, у мишей з дефіцитом мінкла рівень вільних жирних кислот у сироватці крові нижчий, ніж у мишей дикого типу на дієті з високим вмістом жиру. Ці результати дозволяють припустити, що активація Mincle викликає запалення жирової тканини та фіброз, що обмежує накопичення ліпідів у жировій тканині; надлишки ліпідів виділяються у вигляді вільних від сироватки жирних кислот.
Повідомляється, що кілька молекул беруть участь у фіброзі жирової тканини. Миші, у яких відсутній колаген типу VI, який сильно експресується в жировій тканині, демонстрували гіпертрофію адипоцитів і збільшували масу жирової тканини під час прогресування ожиріння [28 Khan T, Muise ES, Iyengar P, Wang ZV, Chandalia M, et al. (2009) Метаболічна дисрегуляція та фіброз жирової тканини: роль колагену VI. Mol Cell Biol 29: 1575–1591.
Повідомлялося, що в печінці є принаймні три походження ліпідів; de novo ліпогенез, харчові ліпіди та ліпіди з жирової тканини. Також було продемонстровано, що більше половини печінкових ліпідів походить із жирової тканини, що свідчить про те, що здатність ліпідів накопичуватися в жировій тканині відіграє життєво важливу роль у накопиченні печінкових ліпідів. Хоча повідомлялося, що баланс ліпогенезу та ліполізу в жировій тканині жорстко регулюється інсуліном та симпатичною нервовою системою, останні дослідження також свідчать про роль хронічного запалення в цьому балансі. Наприклад, запальні цитокіни можуть індукувати резистентність до інсуліну, а також безпосередньо індукувати ліполіз, і повідомлялося, що фіброз жирової тканини позитивно корелює з ектопічним накопиченням ліпідів [32 Roden M (2006) Механізми захворювання: стеатоз печінки при діабеті 2 типу - патогенез та клінічна значимість. Nat Clin Pract Endocrinol Metab 2: 335–348.
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> 34]. Враховуючи те, що фіброз жирової тканини ослаблювався у мишей з дефіцитом Мінкле, ми дослідили накопичення печінкових ліпідів і виявили, що дефіцитні миші демонстрували менше накопичення печінкових ліпідів і нижчу концентрацію аланінтрасамінази в сироватці порівняно з мишами дикого типу.Конкретно, не було значної різниці у масі тіла між генотипами; отже, цілком можливо, що Mincle може діяти як регулятор ліпідів Крім того, миші з дефіцитом Мінкеля продемонстрували кращий метаболізм глюкози з посиленням сигналізації інсуліну. Ці результати дозволяють припустити, що Мінкл міг регулювати системний метаболізм глюкози, регулюючи метаболічну функцію накопичення ліпідів у жировій тканині.
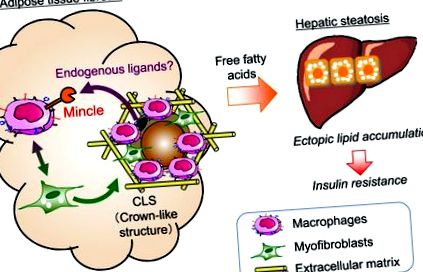
Багато досліджень виявили важливу роль інфільтруючих макрофагів в жировій тканині із ожирінням, а також продемонстрували, що сенсори патогенних мікроорганізмів, такі як TLR4, відіграють важливу роль не тільки у вродженому імунітеті, але і при стерильному запаленні. Ми надали докази того, що Mincle, датчик збудника Мікобактерії туберкульозу, активується в жировій тканині із ожирінням, що призводить до запалення жирової тканини та фіброзу внаслідок активації фібробластів (рис. 1). Потенційна роль Мінкла у спричиненому ожирінням запаленні жирової тканини (від Tanaka та ін. (2014) Nat Commun 5: 4982. [26] змінено)
"data-html =" true "data-position =" bottom "data-toggle =" tooltip "> Рис. 1). Однак ендогенний ліганд, який активує Mincle, досі невідомий. Визначення ендогенних лігандів для датчиків патогенів та уточнення їх сигналу шляхи допоможуть розробити нові розуміння та стратегії лікування запалення жирової тканини та фіброзу.
Автор дякує проф. Такайосі Суганамі з Університету Нагої та Йосіхіро Огава з Вищої школи медичних наук Університету Кюсю за їх постійну підтримку. Дослідницькі зусилля автора, представлені в цьому рукописі, були підтримані грантами на наукові дослідження Міністерства освіти, культури, спорту, науки та технологій Японії (18K08508).
Автор не має заявлених конкуруючих інтересів.
- Дисрегуляція метаболізму та фіброз жирових тканин Роль колагену VI молекулярного та клітинного
- Підвищений рівень інтерлейкіну-32 при ожирінні сприяє запаленню жирової тканини та позаклітинному
- Молекулярний механізм індукованого ожирінням метаболічного ремоделювання тканин
- Молекулярний механізм індукованого ожирінням метаболічного ремоделювання тканин - Tanaka - 2018 - Journal of
- Дисрегуляція метаболізму та фіброз жирової тканини роль колагену VI - PubMed