Молекулярний механізм індукованого ожирінням метаболічного ремоделювання тканин
Міяко Танака
1 Кафедра молекулярної медицини та обміну речовин, Науково-дослідний інститут екологічної медицини, Університет Нагої, Нагоя, Японія,
Мічіко Ітох
2 Кафедра органічної мережі та метаболізму, Вища школа медичних та стоматологічних наук, Токійський медичний та стоматологічний університет, Токіо, Японія,
Йосіхіро Огава
1 Кафедра молекулярної медицини та обміну речовин, Науково-дослідний інститут екологічної медицини, Університет Нагої, Нагоя, Японія,
3 Кафедра молекулярної ендокринології та метаболізму, Вища школа медичних та стоматологічних наук, Токійський медичний та стоматологічний університет, Токіо, Японія,
4 Кафедра молекулярного та клітинного обміну, Вища школа медичних та стоматологічних наук, Токійський медичний та стоматологічний університет, Токіо, Японія,
5 Кафедра медицини та біорегуляторних наук, Вища школа медичних наук, Університет Кюсю, Фукуока, Японія,
6 Японське агентство з медичних досліджень та розробок, CREST, Токіо, Японія,
Такайосі Суганамі
1 Кафедра молекулярної медицини та обміну речовин, Науково-дослідний інститут екологічної медицини, Університет Нагої, Нагоя, Японія,
Анотація
Хронічне запалення - загальна молекулярна основа, що лежить в основі різноманітних хронічних захворювань. Накопичувальні дані також свідчать про те, що хронічне запалення сприяє патогенезу ожиріння та діабету, які розглядалися як метаболічні захворювання. За останні кілька десятиліть відбувся значний прогрес у розумінні основного механізму дисфункції жирової тканини, спричиненої ожирінням. Реконструкція тканин - одна з гістологічних особливостей хронічного запалення, при якому стромальні клітини різко змінюються за кількістю та типом клітин. Дійсно, ремоделювання жирової тканини індукується різними стромальними клітинами, що призводить до порушення функції жирової тканини, наприклад, вироблення адипоцитокінів та зберігання ліпідів, що призводить до системних метаболічних розладів. На додаток до жирової тканини, печінка є ще одним прикладом ремоделювання тканин, спричинених ожирінням. У цьому огляді ми обговорюємо, як ожиріння індукує інтерстиціальний фіброз у жировій тканині та печінці, особливо акцентуючи увагу на ролі макрофагів.
Вступ
Хронічне запалення є загальною молекулярною основою багатьох хронічних захворювань, таких як атеросклеротична хвороба, аутоімунне захворювання, нейродегенеративні захворювання та рак. Накопичувальні дані також свідчать про те, що хронічне запалення відіграє вирішальну роль у ожирінні та патогенезі діабету, які розглядалися як метаболічні захворювання. Існує велика кількість досліджень щодо впливу надмірного споживання енергії та харчового дисбалансу на хронічне запалення та порушення метаболічного гомеостазу. У зв'язку з цим одним з найважливіших органів є жирова тканина, яка сприймає харчові умови в нашому організмі та зберігає надмірну енергію у вигляді тригліцеридів. Жирова тканина також регулює реакції запалення та виділяє різні біоактивні молекули, які називаються `` адипоцитокінами '' або `` адипокінами '' у відповідь на системний харчовий статус, що призводить до механізму зворотного зв'язку метаболічного гомеостазу 1, 2, 3, 4, 5, 6 . При ожирінні ці функції жирової тканини погіршуються, що породжує системні метаболічні порушення (метаболічний синдром).
На відміну від гострого запалення, типові ознаки «запалення», такі як біль, жар, почервоніння та набряк, рідко спостерігаються при хронічному запаленні. На противагу цьому, запальні цитокіни та імунні клітини є загальним механізмом гострого та хронічного запалення. У зв'язку з цим ремоделювання тканин є однією з гістологічних особливостей хронічного запалення, при якому стромальні клітини різко змінюються за кількістю та типом клітин 7. У більшості випадків хронічне запалення нарешті призводить до фіброзу тканин та порушення функції органів. На додаток до жирової тканини, печінка є ще одним прикладом ремоделювання тканин, спричинених ожирінням. Накопичення ліпідів у печінці або неалкогольна жирова хвороба печінки (НАЖХП) є печінковою особливістю метаболічного синдрому. Зокрема, безалкогольний стеатогепатит (НАСГ), що характеризується хронічним запаленням та перицелюлярним фіброзом, збільшує ризик цирозу та гепатоцелюлярної карциноми 8, 9. У цій оглядовій статті ми обговорюємо недавній прогрес у розумінні молекулярного механізму індукованого ожирінням ремоделювання тканин, особливо зосереджуючись на жировій тканині та печінці.
Запалення жирової тканини, спричинене ожирінням
Жирова тканина включає не тільки насичені ліпідами зрілі адипоцити, але також численні стромальні клітини, такі як преадипоцити, фібробласти, ендотеліальні клітини та імунні клітини. Під час розвитку ожиріння жирова тканина виявляє динамічні гістологічні зміни, що характеризуються гіпертрофією адипоцитів, посиленням ангіогенезу, інфільтрацією імунних клітин та надмірним продукуванням позаклітинного матриксу 2, 6, 10, 11. Ці зміни нагадують „ремоделювання судин”, тобто хронічні запальні реакції в атеросклеротичних судинних стінках. Добре розуміємо, що `` ремоделювання судин '' викликане складною взаємодією між різними клітинами, такими як ендотеліальні клітини судин, клітини гладких м'язів судин, лімфоцити та макрофаги, що походять від моноцитів 5, тому динамічні зміни, що спостерігаються в жировій тканині з ожирінням, можна посилатись до "ремоделювання жирової тканини", який повинен брати участь у патогенезі індукованої ожирінням дисфункції жирової тканини. Крім того, є значні докази того, що вироблення адипоцитокінів та зберігання ліпідів регулюються взаємодією зрілих адипоцитів і стромальних клітин у жировій тканині 12, 13 .
Паракринна взаємодія між адипоцитами та макрофагами
Молекулярний механізм ремоделювання жирових тканин
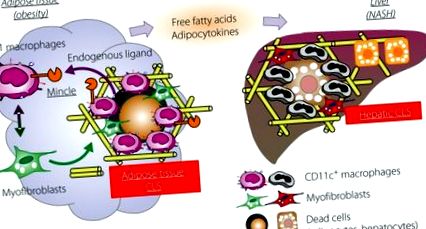
Роль коронкоподібної структури (CLS) в індукованому ожирінням метаболічному ремоделюванні тканин у жировій тканині та печінці. Mincle, новий сенсор клітинної загибелі, експресується виключно в CD 11c-позитивних макрофагах, що складають CLS в ожиріній жировій тканині. Коли активується невідомими в даний час ендогенними лігандами, Mincle потужно індукує утворення міофібробластів та інтерстиціальний фіброз. Існує подібна гістологічна структура, яка називається печінковою CLS у печінці під час прогресування захворювання від простого стеатозу до неалкогольного стеатогепатиту (NASH). Таким чином, CLS відіграє найважливішу роль у стимулюванні „метаболічного” ремоделювання тканин.
Роль фіброзу жирової тканини в ектопічному накопиченні ліпідів. Зберігати надмірну енергію, оскільки тригліцериди є основною функцією жирової тканини, яка жорстко регулюється гормонами, такими як інсулін, і симпатичним нервом. Крім того, останні дані свідчать про те, що в цей процес втягується хронічне запалення. Зокрема, інтерстиціальний фіброз обмежує розширюваність жирової тканини, що, нарешті, призводить до збільшення ектопічного накопичення ліпідів.
Нова тваринна модель NASH
Печінковий CLS-опосередкований фіброз печінки в NASH
Клінічна значущість печінкової CLS у NASH
Висновок
За останні кілька десятиліть було досягнуто значного прогресу у розумінні основного механізму хронічного запалення при захворюваннях, пов’язаних із способом життя, таких як ожиріння, діабет та НАЖХП/НАСГ. У цьому огляді ми обговорили недавній прогрес у цій галузі досліджень, зокрема, зосередившись на тому, як індуковане ожирінням хронічне запалення призводить до інтерстиціального фіброзу в жировій тканині та печінці. CLS є місцем перехресного спілкування між клітинами паренхіми та стромальними клітинами, включаючи макрофаги, індукуючи тим самим стійке запалення та інтерстиціальний фіброз. Іншими словами, CLS може функціонувати для стимулювання метаболічного ремоделювання тканин. Краще розуміння молекулярного механізму, що лежить в основі хронічного запалення, спричиненого ожирінням, відкрило б шлях до розробки нової терапевтичної стратегії для захворювань, пов’язаних із способом життя, таких як ожиріння, діабет та НАЖХП/НАСГ.
Розкриття інформації
Автори не заявляють конфлікту інтересів.
Подяка
Ця робота була підтримана частково грантами для наукових досліджень Міністерства освіти, культури, спорту, науки і технологій Японії (16H05171, 16KT0110, 16K08732, 17K19686 та 17H05500) та Японським агентством з медичних досліджень та розвитку (КРЕСТ). Ця робота також була підтримана науковими грантами від Наукового фонду "Такеда", Фонду медичних досліджень "Такеда" та Спільної програми використання/дослідження Інституту медичних досліджень та Токійського медичного та стоматологічного університету.
Примітки
J Diabetes Investig 2018; 9: 256–261 [Google Scholar]
- Молекулярний механізм індукованого ожирінням метаболічного ремоделювання тканин - Tanaka - 2018 - Journal of
- Безкоштовне повнотекстове позаклітинне матричне ремоделювання жирової тканини при ожирінні та обміні речовин
- Молекулярний механізм вісцерального ожиріння SpringerLink
- Молекулярний механізм запалення жирової тканини, спричиненого ожирінням; роль Мінкеля в жировій
- Метаболічна регуляція функції макрофагів жирової тканини при ожирінні та діабеті Антиоксиданти та