Ліпаза підшлункової залози та пов’язаний з нею білок 2 регулюються харчовими поліненасиченими жирами під час постнатального розвитку щурів
Анотація
Експресія генів розвитку панкреатичної ліпази (PL) та пов’язаних з нею білків (PLRP1 та PLRP2) є антикоординатом. Невідомо, чи регулює харчовий жир експресію цих білків на стадії попереднього відлучення. Для визначення регуляції розвитку та дієти на PL, PLRP1 та PLRP2 ще в період вигодовування, вагітні (Sprague-Dawley) щури споживали з 15 (d15) дня вагітності через d9 лактації очищений низький (11% енергії) ) дієта з сафлоровою олією [нежирна (LF)]. Починаючи з d9 періоду лактації, дамби та їхні щенята годували жирним жиром сафлорової олії до d56 середньожирним (MF; 40% енергії) або високожирним (HF; 67% енергії). Вміст жирних кислот у молоці мав у 15-100 разів менше С: 10 та в 2,6- - 3,3 рази більше С18: 2 у групах MF та HF. Дієта (LF d21> d28). Вперше повідомляється про значне зниження рівня мРНК PLRP2 високим вмістом поліненасичених жирів у щурів-сисунів (d15). На закінчення, експресія гена PL та PLRP2 регулюється антикоординативно кількістю харчових поліненасичених жирів, починаючи ще на фазі передпутніння.
Дієтичний жир забезпечує основну енергію (∼ 50% калорій) під час дитинства в грудному молоці та сумішах (1). Протягом останнього десятиліття особлива увага приділялася типу жиру, необхідного для нормального розвитку немовлят, особливо довголанцюговим поліненасиченим жирним кислотам (ПНЖК). PUFA, отриманий з незамінних жирних кислот (C18: 2, лінолевої кислоти та C18: 3α-ліноленової кислоти), відіграє ключову роль у розвитку мозку та нормального розвитку сітківки (2).
Перетравлювання та всмоктування жиру у немовляти та недоношених новонароджених залежать від особливостей розвитку ліпаз (3). Травна система продовжує розвиватися після народження у немовлят, і особливо у недоношених новонароджених, впливаючи на їх здатність засвоювати жир. Шлункова ліпаза, яка починає перетравлювати харчовий жир і на неї припадає 10–30% перетравлення жиру (4), залежна від ліпази підшлункової залози коліпаза та стимульована ліпазою солі молочної жовчі - всі вони мають потенційну роль у перетравленні молочного жиру у новонародженого ( 3). Білок 2, пов’язаний з ліпазою підшлункової залози (PLRP2), також може відігравати роль у перетравленні жиру новонароджених (5). Хоча рівень ліпази підшлункової залози у новонародженого і тим більше у недоношених новонароджених є низьким, перетравлювання молочного жиру залежить від цих чотирьох ліпаз з унікальними і лише частково перекриваються функціями (5–7).
Екзокринна підшлункова залоза синтезує та виділяє панкреатичну ліпазу та два пов’язані з білками панкреатичної ліпази; PLRP1 та PLRP2. PL та пов'язані з ним білки були виявлені у людей та щурів. PLRP1 є дуже гомологічним PL з збереженими залишками серину та гістидину в активному центрі (8,9); однак цей білок не виявляє колипазозалежної ліполітичної активності, коли його повна довжина кДНК експресується в клітинах COS або Sf9 (8,9). Хоча PLRP1 секретується екзокринною підшлунковою залозою у кількох видів (10), функція PLRP1 залишається невідомою. Три звіти (11–13) припускають, що дві мутації залишків 179 та 181 (аланіну та проліну до валіну та аланіну відповідно) роблять PLRP1 неактивним. Другий споріднений білок (PLRP2) має інші ліполітичні властивості, ніж PL. Незважаючи на те, що PLRP2 має обмежену активацію коліпазою у присутності солей жовчі, PLRP2 має значну ліполітичну активність за відсутності коліпази і має як фосфоліпазну, так і галактоліпазну активність (14).
Структура розвитку PL та споріднених з ним білків у постнатальному періоді є антикоординатом у людини та щурів (9,15). Рівні мРНК PLRP1 і PLRP2 високі у фазі лише вигодовування (0–14 дні), зниження у фазі вигодовування та відкушування (14–21 день) і низькі протягом усього відлучення та дорослого віку (21 день і пізніше). На противагу цьому, PL не експресується на виявлених рівнях до постнатального 14-го дня (d14), і його експресія зростає протягом фаз смоктання-відкушування та відлучення до максимальних рівнів у зрілому віці. Було запропоновано, що антикоординатна експресія PL та пов'язаних з ним білків може відображати різну роль у перетравленні ліпідів під час постнатального розвитку (9). Підтримуючи їх пропозицію, Лоу та ін. (5) виявили зниження всмоктування та травлення жиру у новонароджених у мишей-нокаутів PLRP2.
PL є головним ферментом, відповідальним за перетравлення тригліцеридів з раціоном у період відлучення та дорослого віку (4). У присутності коліпази та солей жовчі PL гідролізує дієтичні тригліцериди в тонкому кишечнику до двох - моногліцеридів та вільних жирних кислот (FFA), які потім всмоктуються. І люди, і щури адаптують синтез ліпази підшлункової залози у відповідь на дієтичні зміни і тим самим максимізують використання харчового жиру (16). Показано фізіологічне значення цього режиму харчування. Підвищення регуляції ФЛ посилює реакцію холецистокініну на підвищений вміст жиру за рахунок збільшення швидкості перетравлення тригліцеридів та вивільнення жирних кислот у проксимальній частині тонкої кишки (17). У тварин, що відлучають від грудей, PL та PLRP1 пристосовуються до підвищеного жиру (41–75% загальної енергії) протягом 24 годин. Через 5 днів PL і PLRP1 досягають вищих стаціонарних рівнів активності та синтезу PL, а мРНК PL та PLRP1 (16–22).
Регулювання PL та PLRP1 за типом жиру (довжина ланцюга та ступінь насиченості) є суперечливим. Раніше ми показали, що PL регулюється аналогічно різними типами жиру, що перевищує поріг 49% енергії, як жир (21), і що високополіненасичені жири та жири, багаті тригліцеридами середньої ланцюга, стимулюють регуляцію генів PL нижче цього порогу (20) . Невідомо, чи модифікована експресія генів PL, PLRP1 та PLRP2 харчовим жиром у фазі вигодовування, коли цуценята споживають лише материнське молоко, або у фазі розвитку вигодовування, коли цуценята споживають і материнське молоко, і материнська дієта.
Склад жирних кислот материнського молока можна змінити, змінивши кількість поліненасичених жирів у раціоні годуючої дамби (23–25). Метою цього дослідження було визначити, чи може кількість поліненасичених харчових жирів регулювати PL, PLRP1 та PLRP2 під час розвитку, включаючи лише фази вигодовування, відкушування, відлучення та дорослих, та визначити, чи існує взаємодія цієї дієти регуляція з регуляцією розвитку PL і пов'язаних з ним білків, коли PUFA вводяться вже у віці перед відлученням.
МЕТОДИ
Експериментальний протокол.
Споживання їжі вимірювали щодня. Вагу тіла щенят вимірювали в d9, d15, d21, d28 і d56 експерименту, коли вибраних самців цуценят вбивали вдиханням СО2. Обсяг вибірки варіювався від 6 до 12 на групу на d15–56 через різницю в кількості самців щенят на дамбу, що обмежувало вибірку в деякі дні. Мінімальний обсяг вибірки 5 щурів був оцінений за допомогою аналізу потужності, щоб виявити 50% зміну рівнів мРНК PL і PLRP1 з дисперсією популяції 30% для PL і PLRP1. Через невеликий розмір підшлункової залози на d9, у щенят відбирали проби для активності мРНК PL або активності PL. Таким чином, обсяг вибірки для маси тіла та ваги підшлункової залози більший (n = 20), ніж для мРНК PL або активності PL. Для d15 та пізніших розмірів підшлункової залози було досить великим, щоб частину кожної підшлункової залози негайно заморожували на сухому льоду та зберігали при -80 ° C для ферментного аналізу. Залишок підшлункової залози негайно використовували для виділення РНК, як описано нижче.
Аналіз жирних кислот.
До 50 л збірних зразків молока для кожної обробки додавали 30 г С: 17 FFA, 500 л бензолу та 3 л ацетилхлориду: MeOH (1:15) (27). (Через невеликі обсяги молока збір зразків був необхідним для достатнього обсягу для аналізу.) Зразки інкубували на водяній бані при 65 ° C протягом 2 годин. Після охолодження додавали 10 г метилового ефіру жирної кислоти C: 15, внутрішній стандарт, 500 мкл гексану і 1 л H2O, і зразки центрифугували для відокремлення. Гексановий шар брали і вводили в газовий хроматограф для аналізу жирних кислот (27).
Аналіз ферментів підшлункової залози.
Фрагменти підшлункової залози гомогенізували в 9 об. PBS (0,15 М NaCl, 5 мМ PO4, рН 7,4) за допомогою гомогенізатора Polytron. Гомогенати центрифугували при 14000 мкг при 4 ° С протягом 30 хв. Надосадову рідину видаляли і додавали інгібітор трипсину сої (кінцева концентрація, 0,01%). Супернатант використовували для визначення активності ферментів та вмісту білка. Активність ліпази оцінювали титримерним методом (21) з 20 мМ NaOH з використанням стабілізованої гуміарабічної емульсії нейтралізованого триолеїну з надлишком сирої коліпази. Білок визначали методом Лоурі та ін. (28), використовуючи бичачий альбумін як стандарт. Активність ферментів виражалася у вигляді гнид (мікромолей жирної кислоти, що виділяються за хвилину) на міліграм білка.
Дослідження екстракції та гібридизації РНК.
Аналіз даних.
Всі дані, виражені як середнє значення ± SE, були проаналізовані двостороннім аналізом ANOVA (34) щодо незалежних ефектів 1) дієта, 2) розвиток, і 3) ефекти взаємодії дієти × розвитку. Дані для d9 не були включені в двосторонній ANOVA, оскільки на цей час відбиралась лише група НЧ. Середнє значення для d9 LF представлено для порівняння. Результати вважалися суттєво різними, якщо P
РЕЗУЛЬТАТИ
Жирнокислий склад молока.
Склад молочної жирної кислоти на d15 в період лактації від щурів, які споживали дієти сафлорової олії LF (11%), MF (40%) і HF (67%), представлений у таблиці 2. Кількість дієтичної сафлорової олії змінила жирність молока вміст кислоти з 15 до 100 разів C10: 00 та від 2,6 до 3,3 рази C18: 2 у молоці годуючих щурів, які споживали дієти сафлорової олії MF та HF відповідно, порівняно з щурами, що годували, що споживали дієту LF сафлорової олії. Ця зміна призвела до збільшення як співвідношення довголанцюгових/середньоланцюгових з 2,8 для НЧ до 72,5 для ВЧ, так і співвідношення поліненасичених/насичених (Р/С) з 0,38 для НЧ до 5,6 для ВЧ.
Кінцева вага тіла.
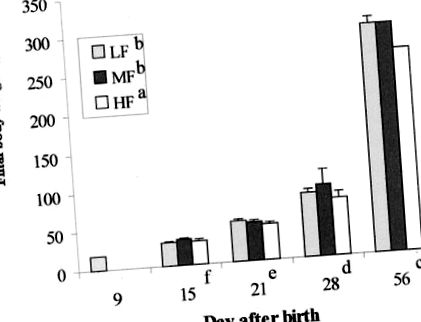
Спостерігався значний незалежний ефект дієти (НЧ = МФ> СН); P Фігура 1
Кінцева маса тіла щурів, які споживали ЛФ (11% як енергію; □), МФ (40% як енергію; ▪) та HF (67% як енергію; □), використовуючи сафлорову олію. Результати виражаються як середнє значення ± SE. Будь-які стовпчики без видимого SE мали SE менше ніж найменша одиниця на графіку. Був незалежний ефект дієти (НЧ = МФ> СН); P a, b дієта без використання верхнього індексу суттєво різнилася) та розвитку (d15 c – f днів, коли не ділилися індексом, суттєво відрізнялись). Не було значної взаємодії дієти × розвитку. Кількість самців щенят на зразок становила 9 днів (20 на групу), 15 днів (9–10 на групу), 21 днів (7–11 на групу), 28 днів (6–9 на групу) та 56 днів ( 8–12 на групу).
Споживання їжі.
Середнє споживання їжі на день вимірювали у щурів 28 та 56 років після відлучення. Спостерігався значний незалежний ефект дієти (LF Таблиця 3 Вживання їжі щурами, які споживали дієти з сафлоровою олією LF, MF або HF
Активність ліпази підшлункової залози.
Спостерігався значний незалежний ефект дієти (НЧ, рис. 2
Активність ліпази підшлункової залози (од./Мг білка) щурів, які споживали LF (11% як енергію; □), MF (40% як енергію; ▪) та HF (67% як енергію; □). Результати виражаються як середнє значення ± SE. Будь-які стовпці без видимого SE мали SE менше ніж найменша одиниця на графіку. Був незалежний ефект від дієти (ЛФ a, b дієта, що не використовує верхній індекс, суттєво відрізнялася) та від розвитку (d15 c – e днів, коли не ділили індексом, істотно відрізнялися). Була значна взаємодія дієти × розробка (P Значення f – k, що не мають верхнього індексу, суттєво відрізнялись). Кількість самців щенят на зразок становила 9 днів (9 на групу), 15 днів (7–10 на групу), 21 днів (7–10 на групу), 28 днів (6–9 на групу) та 56 днів ( 6–12 на групу).
Рівні мРНК PL.
Були значні незалежні ефекти дієти (LF 56d> 21d> 15d; P Малюнок 3
Співвідношення мРНК/лімфатичної залози підшлункової залози щурів, які споживали LF (11% як енергію; □), MF (40% як енергію; ▪) та HF (67% як енергію; □), сафлорову олію. Результати виражаються як середнє значення ± SE. Будь-які стовпці без видимого SE мали SE менше ніж найменша одиниця на графіку. Був незалежний ефект від дієти (ЛФ a, b дієта, яка не використовує верхній індекс, суттєво відрізнялася) та від розвитку (d15 c – f днів, коли не ділили верхній індекс, суттєво відрізнялися). Кількість цуценят-самців на зразок становила 9 днів (12 на групу), 15 днів (7–10 на групу), 21 днів (6 на групу), 28 днів (6–9 на групу) та 56 днів (8– 12 на групу). мРНК PLRP навколо народження свідчать про те, що вони можуть відігравати важливу роль у фазі вигодовування та вигодовування, коли щур споживає материнське молоко та дієту матері.
Рівні мРНК PLRP1.
Був значний незалежний ефект розвитку (15d = 21d> 28d> 56d; P Малюнок 4
Співвідношення мРНК PLRP1/S28 щурів, які споживали LF (11% як енергію; □), MF (40% як енергію; ▪) та HF (67% як енергію; □) дієти з сафлорової олії. Результати виражаються як середнє значення ± SE. Будь-які стовпці без видимого SE мали SE менше ніж найменша одиниця на графіку. Був незалежний ефект від розвитку (d56 a – c днів, коли не використовувався верхній індекс, суттєво відрізнялися). Не було значного впливу дієти та взаємодії дієти × розвитку. Кількість самців щенят на зразок становила 9 днів (15 на групу), 15 днів (7–10 на групу), 21 днів (6 на групу), 28 днів (6–8 на групу) та 56 днів (6– 11 на групу).
Рівні мРНК PLRP2.
Ми вперше повідомляємо про значний незалежний вплив дієти на регуляцію PLRP2 (P 21г; P Малюнок 5
Співвідношення мРНК PLRP2/S28 щурів, які споживали LF (11% як енергію; □), MF (40% як енергію; ▪) та HF (67% як енергію; □), використовуючи сафлорову олію. Результати виражаються як середнє значення ± SE. Будь-які стовпці без видимого SE мали SE менше ніж найменша одиниця на графіку. Спостерігався незалежний ефект дієти (НЧ = МФ> СН); P a, b дієта без використання верхнього індексу суттєво різнилася) та розвитку (d21 c – d дні, коли не ділили індексом, істотно відрізнялися). Була значна взаємодія дієти × розробка (P Значення e – g, що не мають верхнього індексу, суттєво відрізнялись). Кількість цуценят-самців на зразок становила 9 днів (10 на групу), 15 днів (8–10 на групу) та 21 днів (9 на групу).
ОБГОВОРЕННЯ
PL, PLRP1 та PLRP2 належать до одного генетичного сімейства, що продемонстровано їх гомологією генів та структурною подібністю (8,35,36). Експресія генів PLRP1 та PLRP2 має інший характер розвитку, ніж мРНК PL (9). Це антикоординатне регулювання PLRP та PL припускає, що під час розвитку щурів гени PLRP знаходяться під іншим регуляторним контролем, ніж ген PL. Відносно високі рівні
Зміна вмісту жиру в харчуванні матері змінила вміст жирних кислот у молоці в дамбах, які споживали сафлорову олію з низьким, помірним та високим вмістом. Кількість ПНЖК (переважно 18: 2) у молоці підвищувалось із збільшенням поліненасичених жирів у харчуванні матері. Це явище узгоджується з попередніми дослідженнями (23–25).
Рівень мРНК PLRP1 суттєво впливав на розвиток за згодою з попередніми звітами Payne та ін. (9). Рівень мРНК PLRP1 був високим протягом раннього постнатального періоду (d9 і d15) і різко знижувався після відлучення (d21) до низьких рівнів у зрілому віці. Різна кількість поліненасичених жирів у молоці та дієта не впливали на експресію PLRP1. Відсутність впливу кількості жиру в раціоні на експресію PLRP1 у щурів-відлучень у цій роботі дивує і відрізняється від інших досліджень (16, 20, 22, 37), в яких PLRP1, як було показано, регулюється транскрипційно харчовим жиром. Однак введення різних кількостей ПНЖК, розпочате раніше під час третинної фази розвитку підшлункової залози, може змінити довгострокове регулювання PLRP1. Таке “метаболічне відбиття” було запропоновано для інших дієтичних ліпідів, таких як холестерин, але залишається суперечливим.
Експресія мРНК PLRP2 у розвитку була високою протягом раннього постнатального періоду і різко знижувалась до фази відлучення (21 день після пологів) до невизначуваних рівнів у зрілому віці (d56). Це узгоджується із схемою розвитку, про яку спочатку повідомляв Пейн та ін. (9). Вже через 15 днів під час фази смоктання та відкушування спостерігався суттєвий ефект від дієти (LF = MF> HF; P
- Саркопенія Акцент на тренуванні прикусу та дієтичному білку
- Протеїнкіназа А, залежна і незалежна стимуляція екзоцитозу цАМФ у підшлунковій залозі миші
- Вивчення ефекту проти ожиріння через пригнічення активності ліпази підшлункової залози Diospyros kaki
- Патофізіологія та еволюційні аспекти харчових жирів та довголанцюгових поліненасичених жирних кислот
- Нові дані свідчать, що жир, а не цукор або білок, викликає ожиріння у мишей - Сіньхуа