Лікування посттромботичного синдрому
Каріна Шлеймер
1 Університетська лікарня Аахена
Мохаммад Есмаїл Барбаті
1 Університетська лікарня Аахена
Олександр Гомберт
1 Університетська лікарня Аахена
Фолькер Вінерт
1 Університетська лікарня Аахена
Йохен Громмес
1 Університетська лікарня Аахена
Хоуман Джалаї
1 Університетська лікарня Аахена
Анотація
Передумови
Посттромботичний синдром (ПТС) виникає у 20-50% пацієнтів, які перенесли тромбоз глибоких вен і помітно погіршують якість свого життя.
Методи
Цей огляд базується на відповідних публікаціях, отриманих шляхом вибіркового пошуку літератури в PubMed та Кокранівській бібліотеці, а також на рекомендаціях Німецьких товариств флебології та судинної хірургії (Deutsche Gesellschaft für Phlebologie, Deutsche Gesellschaft für Gefässchirurgie).
Результати
Варіанти лікування - консервативне лікування компресією та фізичними вправами для пацієнта, ендоваскулярна реканалізація з ангіопластикою стента та відкрита байпасна хірургія клубових перешкод. Ендоваскулярні методи дають показники прохідності від 73 до 100%, а оклюзія тромботичного стента та гематома - потенційні ускладнення. Відкриті операції були задокументовані лише в дослідженнях з невеликою кількістю випадків (від 3 до 85 випадків на дослідження, рівень прохідності від 58 до 100%). Ускладнення цих інвазивних процедур можуть включати оклюзію тромботичного шунтування, гематому та інфекцію рани. Були рандомізовані дослідження консервативного лікування, але не хірургічного. Американська асоціація серця у своїх керівних принципах дає однакову слабку рекомендацію щодо всіх хірургічних методів (IIb).
Висновок
Усі консервативні варіанти повинні бути вичерпані як перша лінія лікування. Якщо симптоми ПТС зберігаються і помітно погіршують якість життя пацієнта, слід розглянути можливі показання до операції. Оскільки ПТС навряд чи коли-небудь призводить до смерті або втрати кінцівок, його лікування повинно бути якомога неінвазивнішим. Ендоваскулярна реканалізація є привабливим варіантом у цьому відношенні. Остаточна оцінка ролі ендоваскулярних процедур у ПТС повинна чекати рандомізованих досліджень цієї форми лікування та оптимальної конфігурації стента.
Приблизно у 20% - 50% пацієнтів, у яких діагностовано тромбоз глибоких вен, слідує посттромботичний синдром. Це залишається так, навіть коли було проведено відповідне антикоагулянтне лікування (1, 2).
У патогенезі посттромботичного синдрому венозна гіпертензія відіграє центральну роль. Неповна спонтанна реканалізація призводить до хронічної венозної обструкції. Фіброз венозної стінки та пошкоджені венозні клапани викликають рефлюкс. Все це призводить до венозної гіпертензії. Венозна гіпертонія, в свою чергу, спричиняє розширення капілярів та збільшення проникності ендотелію для плазми, білків та еритроцитів. Наслідки включають набряк, запалення, гіперпігментацію шкіри та екзему або навіть розвиток венозної виразки. На додаток до всього, венозна гіпертензія спричинює розтягнення глибоких вен із збільшенням некомпетентності клапана, яке потім передається в поверхневу венозну систему через перфоративні вени (вторинний варикоз) (3, e1– e3).
Типовими симптомами є: важкість і напруга, свербіж, судоми та біль. Венозна кульгавість виникає у вигляді різкого болю під час ходьби, який полегшується під час стояння або коли піднята уражена нога (e1).
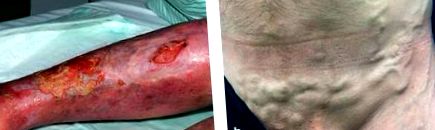
Клінічні ознаки включають флебедему, венозну ектазію, колатералізацію, стазний дерматит, гіперпігментацію, атрофічний бланш, дерматоліпофасціосклероз та виразку вен. Дерматоліпофасціосклероз призводить до обмеження рухів у щиколотці (синдром артрогенного стазу). Через це насос литкових м’язів перестає бути достатньо активованим, тим самим ще більше посилюючи замкнене коло венозної гіпертензії (4, е1) (рис. 1).
Клінічні ознаки посттромботичного синдрому
венозна виразка ніг
Посттромботичний синдром значно погіршує якість життя пацієнтів і має значні соціально-економічні наслідки. У США середньорічні витрати на цих пацієнтів оцінюються приблизно в 20 500 доларів США на одного пацієнта (1,5).
Посттромботичний синдром діагностується на підставі вищезазначених симптомів та ознак. Були розроблені спеціальні бальні системи (наприклад, бали Віллалта, Гінсберга та Бранджеса), які призначають бальні оцінки симптомам та ознакам відповідно до їх тяжкості (6–8, e3). Основним методом діагностичної візуалізації, що використовується, є дуплексна УЗД. Якщо є підозра на непрохідність клубової кістки/кавалу, комп’ютерна томографічна (КТ) або магнітно-резонансна (МР) венографія допомагає додатково з’ясувати. МР-венографія з посиленням гадолінію особливо підходить для надійного виявлення внутрішньосвітлових трабекул та потовщення судинної стінки (9).
Місце та ступінь початкового тромбозу глибоких вен є найважливішими предикторами виникнення посттромботичного синдрому (2, e4– e7). Наприклад, тромбоз глибоких вен клубових вен або загальної стегнової вени (CFV) несе значно вищий ризик посттромботичного синдрому, ніж тромбоз глибоких вен підколінної або грудної кісток (відношення ризику 2,3; 95% довірчий інтервал [95% ДІ]: [1.0; 5.6] (10). Там, де тромбоз глибоких вен відбувається в клубових венах, через 2 роки залишкові тромби є в 33% випадків, тоді як тромби в дистальних венозних сегментах вирішуються більш повно (3% залишкових тромбів через 2 роки ) (10). В одному дослідженні Kahn et al. Показали, що клубове розташування тромбозу глибоких вен є найсильнішим фактором ризику розвитку важкого посттромботичного синдрому (11). Інші фактори ризику включають:
Субтерапевтичні значення INR під час лікування тромбозу глибоких вен (1, 2, 12, e4).
Метою цієї статті є надати сучасний огляд лікування посттромботичного синдрому, з особливим акцентом на ролі ендоваскулярної реканалізації. Профілактика посттромботичного синдрому не висвітлена в цій статті.
Методи
Цей огляд базується на вибірковому пошуку літератури в базі даних PubMed, бібліотеці Кокрана та рекомендаціях Німецького товариства флебологів (Deutsche Gesellschaft für Phlebologie) та Німецького товариства судинної хірургії (Deutsche Gesellschaft für Gefässchirurgie). Використовуваними термінами пошуку були „посттромботичний синдром”, „посттромботичний синдром” та „посттромботичний синдром”. З результатів пошуку ми відібрали ті публікації, що стосуються лікування посттромботичного синдрому. Звіти про випадки, експерименти на тваринах та статті про посттромботичний синдром верхніх кінцівок або у дітей були виключені.
Консервативне лікування посттромботичного синдрому
Метою лікування посттромботичного синдрому є полегшення симптомів, оскільки сам стан не виліковний. Застосовується компресійна терапія, наслідки якої включають наступне:
Зменшення діаметра вени і, отже, поліпшення функції венозного клапана,
Прискорення венозного зворотного потоку і
Профілактика та зменшення набряків ніг (6, 13, 14).
Опубліковано лише два невеликих рандомізованих дослідження щодо лікування посттромботичного синдрому медичними компресійними панчохами (n = 115 пацієнтів). Ці дослідження не показали жодної переваги від носіння компресійних трикотажів (7, 15) - проте, виявлення, що не відповідає клінічному досвіду.
Хоча Кокрановський огляд 2003 року, який включав дослідження Гінзберга та ін., Не рекомендує компресійні панчохи для лікування посттромботичного синдрому (7, 16), Американська кардіологічна асоціація (AHA) підтримує слабкі рекомендації через їх низькі побічні ефекти ( шкірна алергічна реакція) та можлива корисність (особливо зменшення набряку), доки виключені будь-які протипоказання (наприклад, запущена оклюзійна хвороба периферичних артерій, декомпенсована серцева недостатність) (клас рекомендацій IIb, рівень доказовості С (17). Сучасні рекомендації Німецького товариства флебологів (DGP), компресійні панчохи покращують суб’єктивні венозні симптоми; особливо зменшується набряк ніг (рівень доказовості A) (13). У своїй останній публікації про лікування посттромботичного синдрому Kahn et al., чиє дослідження SOX не показало переваг компресійних панчіх у профілактиці посттромботичного синдрому, рекомендують носити компресійні панчохи до колін (від 20 до 30 мм рт.ст.), і що при необхідності тиск стиснення можна збільшити до 40-50 мм рт.ст. (1, 18).
Літературні докази використання компресійних трикотажів для лікування венозної виразки є чіткішими. Сім досліджень показали, що хронічні венозні виразки швидше заживають при компресії, ніж при догляді за раною без компресії. Тому компресійні панчохи рекомендуються як у рекомендаціях DGP, так і в рекомендаціях AHA (клас рекомендацій I, рівень доказовості A) (13, 17, 19).
Згідно з рекомендаціями DGP, переривчаста пневматична компресія покращує симптоми важкого посттромботичного синдрому (рівень доказовості В) (14). У своєму недавньому дослідженні Kahn et al. також рекомендують періодичну пневматичну компресію у пацієнтів з помірним та важким посттромботичним синдромом (1).
Через відсутність доказів позитивного ефекту, а також можливість довгострокових побічних ефектів, медикаментозна терапія веноактивними препаратами (наприклад, рутозидом) не рекомендується (1, 20).
Фізичне тренування та фізіотерапія спрямовані на поліпшення симптомів, головним чином, шляхом поліпшення функції насоса литкового м’яза. Два дослідження досліджували ефективність цього лікування порівняно з контрольною групою, яка не здійснювала фізичних вправ. Група вправ показала поліпшення симптомів та якості життя, сили ніг та рухливості (21, e8). З цієї причини AHA рекомендує контрольовану програму вправ (клас рекомендацій IIa, рівень доказовості B) (17).
Хірургічне лікування посттромботичного синдрому
Не існує рандомізованих контрольованих досліджень хірургічного лікування, як у формі порівняння оперативного та консервативного лікування, так і рандомізованого порівняння між різними хірургічними методами лікування. Що стосується відкритих та гібридних операцій, були проведені лише невеликі нерандомізовані дослідження з низьким числом пацієнтів та змінним спостереженням (рівень доказовості С). Що стосується ендоваскулярних операцій, існують принаймні дослідження з більшим числом пацієнтів (Neglén et al., N = 982), що означає досягнення рівня доказовості B (22).
У пацієнтів з важким посттромботичним синдромом спочатку слід лікувати клубові непрохідності. Втручання для корекції рефлюксу може бути успішним лише за умови відновлення відтоку іліокавалу (17, 23, e9).
Відкрите хірургічне лікування обструкції/закупорки
У пацієнтів з односторонньою обструкцією клубової вени Пальма та Есперон описали стегново-стегновий перехресний шунтування з використанням контралатеральної великої підшкірної вени, довгий сегмент якої мобілізований, підшкірно тунельований до контралатеральної сторони та анастомозований впритул до спільної стегнової вени. на ураженій стороні (24) (малюнок 2). Якщо підходящої великої підшкірної вени не виявлено, можна застосовувати армовані кільцем протези з політетрафторетилену. Для запобігання оклюзії байпасу цю процедуру часто поєднують із розміщенням артеріовенозного анастомозу. У літературі повідомляється, що рівень прохідності становить від 70% до 85% (спостереження: від 6 до 216 місяців) (25, e10– e14).
Шунтування стегна стегна, як описано Пальмою та Еспероном
У пацієнтів з більш широкими венозними обструкціями (двостороння обструкція клубової вени, ураження порожнистої інфраренальної порожнистої вени) проводиться феморокальний або клубово-протезний шунтування (25, e15– e18).
У таблиці перелічені всі існуючі дослідження з відкритого хірургічного лікування посттромботичного синдрому. На основі існуючих невеликих досліджень AHA може дати лише слабку рекомендацію щодо використання цих байпасів (клас рекомендацій IIb, рівень доказовості C) (17).
Ендоваскулярне лікування обструкції/оклюзії
У 2000 р. Neglén et al. опублікував перше дослідження техніки черезшкірної трансфеморальної реканалізації клубового відділу венозного відтоку за допомогою стент-ангіопластики (26). З тих пір цей варіант лікування набув широкого застосування. У 2007 році Neglén et al. опублікував найбільше на сьогодні дослідження з 982 пацієнтами (n = 464 з них із посттромботичним синдромом), у яких їм проводили стент-ангіопластику вихідного тракту клубової кістки. Смертність у загальній групі становила 0%; серед пацієнтів з посттромботичним синдромом рівень первинної прохідності через 72 місяці становив 57%, а вторинної - 86%. Загоєння виразки було досягнуто у 58% пацієнтів. Неглен та ін. змогли продемонструвати значне покращення якості життя (22). В інших дослідженнях лікування посттромботичного синдрому з використанням ангіопластики стентів було досягнуто первинної прохідності від 38% до 100% та вторинної прохідності від 73% до 100% (спостереження: від 9 до 68 місяців) (27, e19– e27) . Ускладнення (головним чином, тромботична оклюзія реканалізованого сегмента та гематоми в місці пункції катетера) були нижче 6% (22). Там, де реканалізація не вдалася, прогресування клінічних ознак не відбулося (22, 28). AHA дає слабкі рекомендації щодо ендоваскулярного лікування (клас рекомендацій IIb, рівень доказовості B) (17).
Технічні деталі
Після венографії та проходження посттромботично зміненого сегмента вени дротами та опорними катетерами непрохідність розширюється. Проводиться ангіопластика стента з подальшим розширенням. Ангіопластика стента проводиться уздовж усіх посттромботично змінених клубових і кавальних сегментів (фіг.3).
перед реканалізацією (оклюзія лівого тазового венозного відтоку з демонстрацією множинних колатералей)
після реканалізації (хороший відтік через стентований лівий тракт відтоку тазу, колатералі не демонструються)
Гібридна процедура
Коли приплив перешкоджають посттромботичним трабекулам в області загальної стегнової вени, на додаток до ангіопластики стента, необхідно проводити хірургічну дезоблітерацію (ендовенотомію) загальної стегнової вени та устя її приток, особливо глибокої вени стегна. Це забезпечує належний приплив до реканалізованого сегмента вени та дозволяє уникнути ранньої тромботичної оклюзії: після поздовжньої венотомії загальної стегнової вени посттромботичні трабекули видаляються, а венотомія закривається пластиркою пластиру. Ця техніка була вперше опублікована Comerota та співавт. (n = 16 кінцівок з непрохідністю клубових вен і загальної стегнової вени). Середній час спостереження становив 26 місяців. Якість життя та показник Віллалта значно покращились (29, e28, e29). Gloviczki та ін. також досяг гарних результатів (e30). Для поліпшення припливу додатково може бути створена артеріовенозна фістула між стегновою веною і поверхневою стегновою веною; Потім фістула закривається від 6 тижнів до 3 місяців після операції, щоб уникнути перевантаження правого серця (e31– e33). На підставі існуючих досліджень, згідно з AHA, гібридна процедура може розглядатися у пацієнтів з важким посттромботичним синдромом (клас рекомендацій IIb, рівень доказовості С) (17) (діаграма 4).
Гібридна хірургічна процедура
Схематична ілюстрація гібридної процедури (ангіопластика клубового стенту, ендовенектомія загальної стегнової вени з пластиркою пластиру плюс розміщення петлеподібної артеріовенозної нориці (політетрафторетиленовий протез)
Інтраопераційне місце під час ендовенектомії лівої спільної стегнової вени (статус після поздовжньої венотомії, провідний провід in situ для подальшої ангіопластики клубового стента, свідчення посттромботичних трабекул, позначені чорними стрілками)
ФВ, стегнова вена; CFV, загальна стегнова вена; DFV, глибока стегнова вена;
GSV, велика підшкірна вена
Протипоказання
У випадках, коли недостатньо припливу з периферії внаслідок довгих сегментів посттромботичних обструкцій стегнової та глибокої вен стегнової кістки, реканалізація іліокавалу навряд чи вдасться і тому протипоказана. Крім того, пацієнти, яким терапевтична антикоагуляція протипоказана, не повинні проходити реканалізацію (30).
Пери- та післяопераційне супутнє лікування
Після реканалізації тромботична оклюзія реканалізованого сегмента є найбільш частим післяопераційним ускладненням (1,5% протягом раннього післяопераційного періоду [Kahn SR, Galanaud JP, Vedantham S, Ginsberg JS. Керівництво з профілактики та лікування посттромботичного синдрому. J Тромболіз тромбів. 2016; 41: 144–153. [Безкоштовна стаття про ПМК] [PubMed] [Google Scholar]
- Яке найкраще лікування профілактики посттромботичного синдрому Американський коледж кардіологів
- Яке найкраще лікування синдрому активації тучних клітин MDedge Internal Medicine
- Роль дієтотерапії у лікуванні пацієнтів з гіперурикемією та метаболічним синдромом
- Тип і кількість дієтичного білка при лікуванні метаболічного синдрому рандомізований контрольований
- Дієта з низьким вмістом FODMAP для лікування синдрому подразненого кишечника та інших шлунково-кишкових розладів