Меню списку журналів
Інструменти
Слідкуйте за журналом
Зростання, реакція на пухлину та довгостроковий контроль
Департамент неврології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Відділення неврології, Дитячий національний медичний центр, 111 Мічиган-авеню, Вашингтон, округ Колумбія, 20010 === Шукати інші статті цього автора
Департамент неврології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Кафедра онкології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Департамент нейрорадіології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Онкологічне відділення, дитяча лікарня Райлі, Індіанаполіс, штат Індіана
Онкологічне відділення, Дитяча лікарня та медичний центр, Сіетл, штат Вашингтон
Онкологічне відділення, Дитяча лікарня та медичний центр, Сіетл, штат Вашингтон
Онкологічне відділення дитячої лікарні Пенсільванії, Філадельфія, Пенсільванія
Онкологічне відділення дитячої лікарні Пенсільванії, Філадельфія, Пенсільванія
Відділення дитячої гематологічної онкології, авіабаза Райта Паттерсона, штат Огайо
Кафедра онкології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Кафедра педіатрії, Меморіальний центр раку Слоуна-Кеттерінга, Нью-Йорк, Нью-Йорк
Департамент неврології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Відділення неврології, Дитячий національний медичний центр, 111 Мічиган-авеню, Вашингтон, округ Колумбія, 20010 === Шукати інші статті цього автора
Департамент неврології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Кафедра онкології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Департамент нейрорадіології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Онкологічне відділення, дитяча лікарня Райлі, Індіанаполіс, штат Індіана
Онкологічне відділення, Дитяча лікарня та медичний центр, Сіетл, штат Вашингтон
Онкологічне відділення, Дитяча лікарня та медичний центр, Сіетл, штат Вашингтон
Онкологічне відділення дитячої лікарні Пенсільванії, Філадельфія, Пенсільванія
Онкологічне відділення дитячої лікарні Пенсільванії, Філадельфія, Пенсільванія
Відділення дитячої гематологічної онкології, авіабаза Райта Паттерсона, штат Огайо
Кафедра онкології, Дитячий національний медичний центр та Університет Джорджа Вашингтона, Вашингтон, округ Колумбія.
Кафедра педіатрії, Меморіальний центр раку Слоуна-Кеттерінга, Нью-Йорк, Нью-Йорк
Представлено частково на 25-му щорічному засіданні Товариства дитячої неврології, Міннеаполіс, Міннесота, 23-25 вересня 1996 р.
Анотація
ПІДСУМОК
Діенцефалічний синдром (ДС), який проявляється прогресуючим виснаженням і відсутністю процвітання у, здавалося б, бадьорого, немовляти, як правило, зумовлений низькою ступенем гліоми гіпоталамуса. Лікування за допомогою агресивної хірургічної операції та/або променевої терапії з успіхом контролює захворювання і може призвести до тяжких неврологічних наслідків. Хіміотерапія нещодавно показала свою ефективність у пацієнтів із гліомами низького ступеня дитинства, але нечасто застосовується у пацієнтів із ДС.
МЕТОДИ
Автори оцінили ефективність режиму карбоплатину та вінкристину щодо поліпшення ваги, спричинення усадки пухлини та відкладання потреби в альтернативній терапії у семи дітей (віком 9-20 місяців; середній вік 11 місяців) з ДС. На початку дослідження п’ять пацієнтів важили менше 5-го процентилю для свого віку, один - 10-го процентиля, а другий - 25-го процентиля.
РЕЗУЛЬТАТИ
Під час спостереження (діапазон 6-54 місяці; медіана 28 місяців) вага пацієнтів збільшився на 66-95% (медіана 80%). За допомогою магнітно-резонансної томографії у чотирьох пацієнтів зниження маси пухлини було> 50%, у одного - 25-50%, а у двох - стабільне захворювання. У пацієнтів з рентгенологічною реакцією на лікування збільшення ваги досягали за допомогою перорального годування у чотирьох з п’яти пацієнтів, тоді як пацієнти зі стабільним захворюванням потребували добавок назогастрального, назоеюнального або гастростомічного зондів для підтримки ваги. Прогресування захворювання відбувалось із середнім значенням 24 місяці після початку хіміотерапії, і двоє пацієнтів залишалися вільними від прогресуючого захворювання на останнє спостереження. П'ять пацієнтів були живими, медіана 59 місяців з моменту встановлення діагнозу. Потреба в опроміненні чи інших терапіях була відкладена у шести із семи дітей. Терапія переносилась без значної токсичності.
ВИСНОВОК
Діенцефалічний синдром - це рідкісне порушення дитячого віку, що характеризується глибоким виснаженням та неможливістю процвітання, незважаючи на нормальне споживання калорій. Це може включати стійку втрату ваги або неможливість набору ваги в періоди зростання. Вперше описаний у 1930-х роках, а пізніше визнаний і переосмислений Расселом в 1951, 1, 2, більшість випадків діенцефалічного синдрому обумовлені низьким ступенем гліом переднього гіпоталамуса або зорового нерва. Повідомлялося про астроцитоми мозочка та четвертого шлуночка у зв’язку з цим синдромом. 3, 4 асоційовані клінічні особливості включають блідість без анемії, ністагм, тремор та життєрадісну, навіть ейфоричну вдачу. Початкова презентація - це виснаження, і діагностика може бути відкладена за відсутності будь-яких неврологічних результатів.
ПАЦІЄНТИ ТА МЕТОДИ
Всім пацієнтам проводили МРТ з гадолінієм та без нього до початку дослідження, після індукційної хіміотерапії та через кожні два цикли підтримуючої хіміотерапії. Усі пацієнти повинні були мати рентгенологічно вимірюване захворювання до початку лікування. Патологічний діагноз та відповідь на терапію визначали лікуючим закладом. Не було центральної процедури огляду гістопатології та візуалізації. Клінічні характеристики або наші пацієнти наведені в таблиці 1.
Протокол лікування
Хіміотерапію розпочали протягом 4 тижнів після визначення прогресування пухлини та/або біопсії. Пацієнтам з резекцією менше 50% було дозволено розпочати лікування після одужання після операції. У тих, у кого резекція становить 50% і більше, після операції необхідно продемонструвати рентгенологічне прогресування пухлини; перед ініціацією вони мали право на хіміотерапію. Терапію розпочинали з режиму індукції карбоплатину та вінкристину. Карбоплатин вводили 1-годинною інфузією у дозі 175 мг/м 2 щотижня протягом 4 тижнів поспіль, після чого проводився 2-тижневий період відпочинку, а потім відновлювали ще протягом 4 тижнів. Вінкристин у дозі 1,5 мг/м 2 (максимум 2 мг) вводили внутрішньовенно щотижня щотижня протягом 10 тижнів. Пацієнтам з об'єктивною рентгенографічною реакцією або стабільним захворюванням (що визначається або клінічно, або нейровізуалізацією) розпочато підтримуючу хіміотерапію з чотирьох тижневих внутрішньовенних доз карбоплатину 175 мг/м 2 та вінкристину по 1,5 мг/м 2 щотижня протягом перших 3 тижнів кожного 4 тижневий цикл. Між кожним циклом підтримання був 3-тижневий відпочинок, і для дітей зі стабільним або поліпшеним захворюванням режим продовжувався до 12 циклів.
До початку кожного циклу хіміотерапії необхідні гематологічні параметри включали абсолютну кількість нейтрофілів вище 1500/мкл і тромбоцитів вище 100000/мкл. Для пацієнтів із затримкою лікування більше ніж на 2 тижні, сепсисом з нейтропенією або кількістю тромбоцитів менше 20 000/мкл наступну дозу карбоплатину зменшили на 50%. Лікування було перервано через лихоманку, нейтропенію та/або сепсис.
Жоден із семи пацієнтів не пройшов попередню променеву терапію. Шість із семи пацієнтів, у яких виявлена диенцефалічна гліома, раніше не отримували хіміотерапії. Пацієнт 3 був попередньо оброблений двома циклами 6-тіогуаніну, прокарбазину, N- (2-хлоретил) -N'-циклогексил-N-нітрозосечовини (CCNU) та вінкристину до початку цього протоколу.
Оцінка реакції пухлини
Відповіді були задокументовані індивідуальною лікувальною установою на основі висновків про нейровізуалізацію, посилену МР, і були визначені наступним чином: повна відповідь (CR); повне зникнення пухлини зникнення пухлини при візуалізаційних дослідженнях; часткова відповідь (PR); зменшення розміру пухлини понад 50%; незначна відповідь (MR); більше 25%, але менше 50% зменшення розміру пухлини; стабільне захворювання (СД); або відсутність змін, або розмір пухлини менше 25%; і прогресуюче захворювання (БП); більше, ніж збільшення розміру на 25%. Розмір ураження оцінювали, визначаючи добуток найбільших двох вимірів, який спостерігався під час досліджень у будь-якій площині.
РЕЗУЛЬТАТИ
Вивчення населення та демографії
У нашій серії з семи пацієнтів було п'ять чоловіків та дві жінки. Вік на момент постановки діагнозу коливався від 9 місяців до 20 місяців, медіана - 12 місяців. У всіх пацієнтів не було можливості процвітати як їхній присутній симптом: у двох пацієнтів спостерігався ністагм, а у двох пацієнтів спостерігалося блювота. У чотирьох пацієнтів були біопсії (жодна з яких не перевищувала 50% резекції), а пухлини були пілоцитарними астроцитомами у всіх чотирьох. Первинною ділянкою пухлини вважали гіпоталамус у п’яти пацієнтів, хіазму у одного пацієнта та таламус у одного пацієнта; хоча як хіазматичні, так і таламічні ураження мали участь гіпоталамусу. Час подальшого спостереження становив від 6 місяців до 54 місяців із медіаною 26 місяців (таблиця 1).
Реакція та контроль на захворювання
За результатами останнього спостереження у лікувальному закладі спостерігали за пацієнтами, що пережили дослідження, середній показник 59 місяців з моменту встановлення діагнозу. Відповідь на лікування наведено в таблиці 1. МРТ виявила усадку пухлини після хіміотерапії у п’яти з семи пацієнтів (чотири PR, один МР) та стабільне захворювання у двох пацієнтів (рис. 1 (30 тис), 2 (41 тис)). З п’яти дітей, які відреагували на хіміотерапію, максимальну відповідь спостерігали під час підтримуючого хіміотерапевтичного циклу у двох з трьох пацієнтів та під час підтримуючого циклу восьми у інших двох пацієнтів.
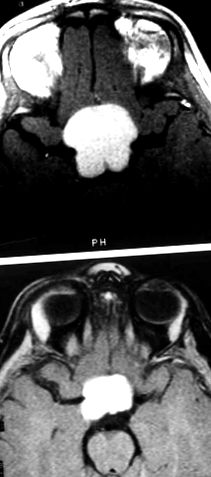
(A) T1-зважене магнітно-резонансне зображення, що демонструє супраселярну пухлину у пацієнта з діенцефальним синдромом (DS). До хіміотерапії розмір пухлини становив 3,3 х 3,3 см. (B) Після лікування вінкристином та карбоплатином розмір пухлини становить 2,0 x 2,5 см.
(А) Другий пацієнт, який демонструє ускладнену діенцефальну пухлину (стрілки). До початку прийому карбоплатини та вінкристину розмір пухлини становив 3,0 х 3,5 см. (Б) Різке зменшення діенцефальної пухлини (стрілки) після лікування хіміотерапією, з кінцевими розмірами 0,8 х 0,8 см, що становить більше 50% усадки за розміром.
Прогресування хвороби, що визначається рентгенологічним збільшенням пухлини, відбувалось із середнім значенням 24 місяці (діапазон, 6-28 місяців) після початку хіміотерапії у п’яти пацієнтів. Усі пацієнти рецидивували лише у місцевій локалізації пухлини, і жоден з них не розвивав дисемінованого захворювання на момент рецидиву. Прогресування захворювання не спостерігалося під час режиму індукційної хіміотерапії у жодного пацієнта. Пацієнт 1 продемонстрував прогресування протягом другого циклу підтримуючої хіміотерапії, тоді як інші пацієнти, які прогресували, зробили це після завершення підтримуючої хіміотерапії. Двоє пацієнтів померли від своєї хвороби; п’ятеро живих медіана 59 місяців з моменту встановлення діагнозу (діапазон, 21-59 місяців).
У пацієнтів з пухлинами, які нейроадіографічно реагували на хіміотерапію, а потім прогресували, спостерігався дещо довший період виживання без прогресування, ніж у пацієнтів із СД, які прогресували (24, 24 та 28 місяців проти 6 та 13 місяців). Два пацієнти все ще не прогресували через 21 місяць та 54 місяці з моменту встановлення діагнозу. З тих, хто перехворів, двоє отримували альтернативну хіміотерапію під час першого прогресування, але обидва прогресували приблизно через рік і продовжували отримувати місцеву променеву терапію. Один стабільний, а другий помер від прогресуючої хвороби. Двоє дітей продовжили негайну місцеву променеву терапію і залишаються вільними від подальшого прогресуючого захворювання. На момент прогресування хіміотерапії карбоплатином та вінкристином одна дитина не отримувала лікування і померла.
Параметри зростання
Репрезентативна крива росту для пацієнта, що демонструє реакцію пухлини на хіміотерапію. При діагностиці (позначена стрілкою) вага менше 5-го процентиля. При подальшому лікуванні (маркована стрілка) відбувається швидке збільшення ваги до 95-го процентиля. Зміни в лінійному зростанні відносно незначні.
Репрезентативна крива зростання для пацієнта, який демонструє стабільне захворювання. Вага менше 5-го процентиля під час діагностики (позначена стрілкою). Однак, на відміну від рисунка 4, збільшення ваги відбувається повільно. Пацієнт також отримував додаткові калорії у вигляді загального парентерального харчування (TPN). Коли TPN вилучається (позначена стрілкою), відбувається зниження ваги.
Токсичність
Хіміотерапія добре переносилась, і жоден пацієнт не був відсторонений від дослідження через гематологічну, неврологічну або ниркову токсичність. Зокрема, жоден з пацієнтів не відчував нейротоксичності з боку вінкристину. Затримки хіміотерапії спостерігались через тривалу тромбоцитопенію у одного пацієнта, але лікування не обмежувало. Жодному з пацієнтів не потрібно зменшення дози хіміотерапії через нейротоксичність. Було сім госпіталізацій з приводу лихоманки, ознобу та нейтропенії, причому негативні культури спостерігались у двох дітей.
ОБГОВОРЕННЯ
Оптимальне лікування ДС залишається незрозумілим. Якщо після діагностики лікування не проводиться, середнє виживання зазвичай менше 12 місяців. Агресивна хірургія може продовжити виживання та покращити збільшення ваги, але повна хірургічна резекція рідко можлива через анатомічне розташування пухлини. 5 В одній серії, в якій робилися спроби агресивних резекцій, 70% дітей, особливо тих, хто не досягнув 12-місячного віку, погано справлялися лише з операцією. 20 Коли радикальної резекції неможливо досягти, додавання променевої терапії може збільшити виживання протягом різного періоду часу. 3, 6, 21 Часткова резекція, що супроводжується лише променевою терапією або променевою терапією, може призвести до виживання без прогресування та стабілізації ваги, проте шкідливі наслідки випромінювання нейроосі у вразливій центральній нервовій системі, що розвивається, добре відомі та описані. 11-14 Поганий прогноз у цих випадках та необхідність лікування дуже маленьких дітей, які вразливі до наслідків променевої терапії, підтверджує необхідність альтернативних методів лікування.
Враховуючи результати цієї серії, особливо стійкий приріст ваги у тих дітей, які реагують на лікування, та відносну відсутність токсичності, необхідні подальші дослідження з хіміотерапією для пацієнтів із ДС. Підходи до лікування повинні оцінювати не тільки короткочасну ефективність лікування, але й здатність терапії уникати довготривалих неврологічних наслідків.
Подяки
Доктор Олсон - член Емілі Дорфман з Американської асоціації пухлин головного мозку.
- Яка найкраща дієта під час лікування раку яєчників SurvivorNet
- Симптоми, лікування та прогноз раку мигдаликів
- Біологія проліферації білих адипоцитів - Хаусман - 2001 - Відгуки про ожиріння - Wiley Online
- Вітамінні та мінеральні добавки під час лікування раку
- Як виглядає лікування папілярного раку щитовидної залози