Короткочасне обмеження їжі з подальшим контрольованим годуванням сприяє підвищенню поведінки, посилює відкладення жиру та зменшує чутливість до інсуліну у мишей.
Кара Л. Клівер
кафедра гуманітарних наук, Коледж освіти та екології людини, Університет штату Огайо, Коламбус, Огайо, США
Цзя-Ю Ке
кафедра гуманітарних наук, Коледж освіти та екології людини, Університет штату Огайо, Коламбус, Огайо, США
Майкл Б. Стаут
кафедра гуманітарних наук, Коледж освіти та екології людини, Університет штату Огайо, Коламбус, Огайо, США
Рейчел Коул
кафедра гуманітарних наук, Коледж освіти та екології людини, Університет штату Огайо, Коламбус, Огайо, США
Варман Т. Самуель
b Кафедра внутрішньої медицини, Медичний факультет Єльського університету, Нью-Хейвен, штат Коннектикут, США
Джеральд І. Шульман
b Кафедра внутрішньої медицини, Медичний факультет Єльського університету, Нью-Хейвен, штат Коннектикут, США
c Кафедра клітинної та молекулярної фізіології Медичного факультету Єльського університету, Нью-Хейвен, Коннектикут, США
d Медичний інститут Говарда Хьюза, Медичний факультет Єльського університету, Нью-Хейвен, Коннектикут, США
Марта А. Белурі
кафедра гуманітарних наук, Коледж освіти та екології людини, Університет штату Огайо, Коламбус, Огайо, США
Анотація
1. Вступ
Більшість людей, які втрачають вагу, не в змозі зберегти втрату ваги з часом [1]. Запаси ліпідів жирової тканини ефективно заповнюються відновленням ваги [2], і у жінок в постменопаузі [3] та людей похилого віку спостерігається непропорційне відновлення жирової маси щодо нежирної тканини. Подібним чином переважне накопичення жиру спостерігалося під час зростання наздоганянь у немовлят із низькою вагою [5] та після голодування [6].
Моделі гризунів зазвичай використовуються для з’ясування біологічних механізмів, що сприяють відновленню жирової тканини після втрати ваги та прискореного відкладення жиру після зупинки росту [7–17]. У цих дослідженнях щодо «підгодівлі» гризуни обмежують кількість калорій/їжі, щоб викликати втрату ваги або зупинку росту, а згодом переробляють на рівні, еквівалентні споживанню відповідних засобів контролю або забезпечують доступ до їжі за необхідності. Потім вивчається використання енергії або експресія та активність генів і білків, що беруть участь у метаболізмі ліпідів, для характеристики механізмів, що сприяють накопиченню жиру після припинення обмеження їжі.
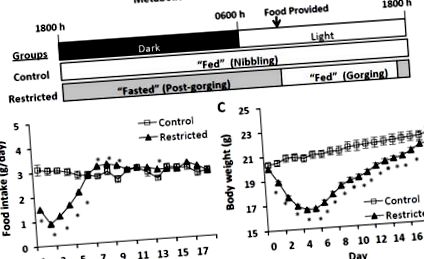
Потенційним незрозумілим фактором у дослідженнях гризунів на гризунах є вплив поведінки годування на експресію генів та білків, метаболізм у всьому тілі та запаси ліпідів. Коли добові норми їжі обмежуються нижче рівня споживання (наприклад, обмеження їжі) або нормуються до рівнів, споживаних відповідним контролем (наприклад, годування їжею), гризуни можуть виявляти різкий характер споживання їжі, коли вся відведена їжа потрапляє незабаром після неї представлено [18–20]. Така поведінка годування контрастує із зразком гризли споживання їжі у гризунів, які харчуються у вільному режимі, де їжа споживається з перервами, переважно протягом темних годин і короткочасно у світлі години [18]. В результаті цих режимів харчування щоденні метаболічні стани виїдаючих гризунів на дієтичному харчуванні включають короткочасний стан годування та тривалий стан голодування до наступного розподілу їжі [18], що контрастує з гризунами гризунів, які фактично залишаються в постійному харчуванні. держава. Отже, рівні експресії генів і білків, пов’язані з метаболізмом, метаболічні реакції та запаси ліпідів у гризунів, що ростуть, можуть суттєво відрізнятися протягом щоденного циклу годування і бути екстремальними безпосередньо перед і після годування.
Наскільки нам відомо, жодне дослідження не вивчало змін, пов’язаних з обміном речовин протягом доби, що спричинені індукованим обмеженнями викидами під час відновлення ваги. Відповідно, у поточних дослідженнях мишей піддавали короткочасному обмеженню їжі, що спричиняло виїдання та згодом уточнені раціони, подібні до щоденного прийому контрольних мишей, які годувались лібітом. Потім запаси ліпідів, метаболіти та гормони, а також експресія генів, що беруть участь у метаболізмі та запаленні жирової тканини, вимірювали у мишей, що живляться, під час їх щоденного періоду годування (горгінга) та наприкінці періоду щоденного голодування. Крім того, за допомогою гіперинсулінемічно-еуглікемічних затискачів досліджували чутливість до інсуліну у мишей, що харчувались, які зазнавали подібних обмежень/раціонів їжі. Наші цілі полягали в тому, щоб зафіксувати коливання внутрішньоденних коливань у запасах ліпідів та експресію гена жирової тканини у мишей, що харчуються, та виявити метаболічні наслідки утворення горла, що осідає обмеженням їжі під час відновлення ваги.
2. Матеріали та методи
2.1 Тварини та дизайн досліджень
Для досягнення цілей цієї статті було використано два дослідження, майже однакові за дизайном. Основними відмінностями між дослідженнями були місце розташування житла та зібрані дані (див. Наступні параграфи). Дослідження 1 було проведено в Університеті штату Огайо (OSU), а дослідження 2 - в Єльському університеті. Усі процедури дослідження були затверджені інституційними комітетами з догляду та використання тварин у відповідних установах.
У дослідженні 1 п'ять тижнів мишей-самців CD2F1 (BALB/cx DBA/2, Charles River Laboratories, Wilmington, MA, USA) рандомізували за вагою на дві групи: контрольна (n = 10) та обмежена (n = 20 ). Мишей індивідуально утримували при температурі 22 ± 0,5 ° C у 12: 12-годинному циклі світло-темряви та забезпечували вільний доступ до води. Контрольних мишей годували в необмеженому стані напівочищеною гранульованою дієтою AIN-93G (Research Diets, Нью-Брансвік, Нью-Джерсі, США). Обмежені миші отримували дієтичну дієту AIN-93G на початку легкого циклу (0830 - 1000). Харчові раціони були обмежені 30 - 75% (в середньому
50%) відносно контрольних мишей протягом перших 5 днів дослідження та наближеного споживання контрольної групи протягом 13 днів. Цей режим годівлі базувався на графіку парного вигодовування, який нагадує продовольчі норми в дослідженнях повторного вигодовування і, як відомо, спричиняє появу у мишей (неопубліковане спостереження). Всіх мишей забивали через 18 днів у той самий час доби (0900 - 1200). Контрольних мишей годували довільно до забиття. Миші з обмеженим обмеженням поглинають всю їжу незабаром після подачі, і тому проходять короткий період годування та тривалий період голодування кожні 24 год. Циклу годування (рис. 1А). У день жертвоприношення одну половину обмежених мишей годували о 07:30, а потім жертвували
3–4 год після забезпечення їжею (під час горгінгу). Іншу половину обмежених мишей не годували і приносили в жертву в кінці свого звичайного щоденного тривалого голодування. Ці групи отримали позначення «Обмежений» («Горгінг») та «Обмежений» («Поглинання») відповідно. Мишей знеболювали ізофлураном, а кров збирали шляхом серцевої пункції в пробірки, оброблені ЕДТА. Пробірки центрифугували при 1500 x g протягом 20 хв при 4 C, плазму збирали і заморожували при -80 C до аналізу. Тканини вирізали, зважили, заморозили в рідкому азоті і зберігали при -80 ° C до аналізу, за винятком зрізів білої жирової тканини епідидимуму (eWAT), які були закріплені в 4% параформальдегіді для вкладання парафіну.
Метаболічний стан, споживання їжі та різниця у масі тіла між обмеженими мишами та органами контролю, що харчуються за умови лібітуму (A) Метаболічні стани контрольних та обмежених мишей за 24 год. Цикл годування. Обмежені миші поглинають всі харчові раціони незабаром після презентації, тому переживають короткий період «годування» та тривалий період «голодування», поки їжа не буде надана наступного дня. Контрольні миші гризуть протягом темних годин і короткочасними приступами протягом світлих годин, а отже, фактично залишаються в постійному «годуваному» стані. (B) Прийом їжі та (C) Вага тіла під час обмеження їжі (перші 5 днів) та повторного годування. Значення представляють середнє значення ± s.e.m. (Контроль, n = 10; Обмежений, n = 20). Прийом їжі оцінювали за тестом Манна-Уітні, а вагу тіла за t-критерієм Стьюдента. Зірочки вказують на статистично значущі відмінності p −ΔΔCT щодо контрольної групи [21].
2.4 Гістологія
Зрізи eWAT (5 мкм) від кожної миші в дослідженні 1 були встановлені на предметне скло і забарвлені гематоксиліном та еозином (H&E) лабораторією гістології Core, Державний коледж ветеринарної медицини штату Огайо. Зображення були зроблені за допомогою світлового мікроскопа (Olympus, Center Valley, PA, США), оснащеного цифровою камерою Pixera Pro 150ES (Pixera, Лос-Гатос, Каліфорнія, США). Три-п’ять полів на слайд були випадково обрані одним засліпленим оцінювачем для візуалізації. Зображення аналізували за допомогою програмного забезпечення ImageJ (NIH, Bethesda, MD, USA) для вимірювання площі перерізу 150 випадково обраних адипоцитів на мишу [22].
2.5 Ліпіди печінки
Загальну кількість ліпідів витягували з
Зрізи печінки по 50 мг від кожної миші в дослідженні 1 із використанням методу Фолча [23]. Екстракцію ліпідів проводили, використовуючи 2: 1 об'ємний/об'ємний розчин хлороформу та метанолу та 0,88% розчин KCl для промивання. Для полегшення поділу фаз зразки центрифугували при 1000 x g. Нижню фазу (органічну) переносили в попередньо зважену пробірку і згодом сушили під азотом. Після висихання пробірки знову зважували для розрахунку загальної маси ліпідів на зразок.
2.6 Вимірювання плазми
Лептин у плазмі та адипонектин вимірювали методом ІФА (Millipore, Billerica, MA, США) відповідно до інструкцій виробника. Кількісно визначали β-гідроксибутират плазми за допомогою колориметричного аналізу (Sigma Aldrich, Сент-Луїс, Міссурі, США).
2.7 Гіперінсулінеміко-еуглікемічний затискач
У дослідженні 2 постійні катетери поміщали у внутрішню яремну вену мишей за 7–8 днів до експериментів із затискачем. Мишей голодували протягом ночі (їжу видаляли через 1 год після вимкнення світла) - стандартна процедура оцінки використання глюкози під час експериментів із затискачами [24]. Однак обмежені миші споживали всі добові раціони перед вилученням їжі натощак. Таким чином, режим харчування та тривалий піст обмежених мишей були порушені експериментами із затискачами. Базальний оборот глюкози у всьому тілі вимірювали шляхом вливання [3- 3 H] -глюкози зі швидкістю 0,05 мкКі/хв протягом 120 хв. Після базових вимірювань гіперінсулінемічно-евглікемічний затискач проводили протягом 140 хв з 4-хвилинною інфузією (20 мО/кг) з подальшою безперервною інфузією (3 мО/кг/хв) людського інсуліну (Novolin R, Novo Nordisk, Princeton, Нью-Джерсі, США). [3- 3 H] глюкозу безперервно вводили при 0,1 мкКі/хв, а для підтримки еуглікемії використовували змінну інфузію 20% декстрози (
120 мг/дл). Зразки плазми отримували з хвоста у встановлені моменти часу. 2-дезокси-d- [1- 14 С] глюкозу вводили у вигляді болюсу (10 мкКі) через 85 хв для вимірювання тканиноспецифічного поглинання глюкози. По закінченню дослідження мишам знеболювали ін'єкцією пентобарбіталу натрію (150 мг/кг), а тканини вирізали, швидко заморожували в рідкому азоті і зберігали при -80 ° C до аналізу.
2.8 Затиск біохімічного аналізу та розрахунків
Глюкозу в плазмі крові вимірювали за допомогою аналізатора глюкози YSI 2700D (YSI Life Sciences, Yellow Springs, OH, США). Інсулін у плазмі крові визначали методом радіоімунологічного аналізу (Millipore). Для вимірювання плазми 3 H-глюкози та 2-дезокси-d- [1- 14 C] -глюкози плазму депротеїнізували ZnSO4 та Ba (OH) 2, сушили для видалення 3 H2O, ресуспендували у воді та підраховували у сцинтиляційній рідині за допомогою сцинтиляційного лічильника Бекмана Коултера (Бреа, Каліфорнія, США). Швидкість обороту глюкози розраховували як відношення швидкості інфузії [3- 3 H] -глюкози до питомої активності глюкози в плазмі в кінці базального періоду та протягом останніх (в середньому) 30 хв стійкого стану затискача . Ендогенне вироблення глюкози визначали шляхом віднімання швидкості інфузії глюкози з утилізації глюкози, стимульованої інсуліном у всьому тілі. Базальний індекс інсулінорезистентності печінки розраховували як базальну ендогенну продукцію глюкози × інсулін у плазмі натще [25]. Для вимірювання специфічного для тканин утилізації глюкози зразки тканин гомогенізували, а супернатанти піддавали іонообмінній колонці (Bio-Rad, Hercules, CA, USA) для відокремлення тканинної 2-дезокси-d- [1- 14 С] -глюкози- 6-фосфат з 2-дезокси-d- [1- 14 С] -глюкози. Поглинання тканини глюкозою розраховували за площею під кривою вмісту 2-дезокси-d- [1- 14 C] -глюкози та тканин 2-дезокси-d- [1- 14 C] -глюкози-6-фосфату [26].
2.9 Статистика
3.2 Маса жирової тканини та розмір адипоцитів
Щоб визначити, в якій мірі на зберігання жирових ліпідів впливає тимчасове обмеження їжі та внутрішньоденні зміни в метаболічному стані, що виникають внаслідок виснаження під час годування, ми порівняли жирові депо з обмеженими мишами під час горгінгу та наприкінці їх тривалого швидкого проходження. Маса eWAT мишей з обмеженим («горгінг») та «обмеженим» (після «горгінга») була значно вищою, відповідно на 21 та 31%, ніж у контрольних мишей і не відрізнялася одна від одної (рис. 2А). Діаграма маси eWAT за масою тіла для окремих мишей представлена на малюнку 2B. Відповідно до ваги eWAT, площа поперечного перерізу адипоцитів епідидиму мишей Restricted (Gorging) та Restricted (Post-Gorging) також була значно вищою, на 31 та 27%, ніж у контрольних мишей і не відрізнялася одна від одної (рис. 2C, D). Вага пахової жирової прокладки суттєво не відрізнявся серед груп (рис. 2А).
- Додаток OMG "Мистецтво справжньої їжі" знаходиться тут англійською мовою
- Харчовий ланцюжок лосося
- У строк: швидка зйомка їжі з обмеженою передачею на локаторах
- Рецепт гамбургерських пиріжків з яловичим фаршем - смачно - Їжа та напої
- Рецепт успіху 7 Порад щодо продажу продуктів харчування в Інтернеті