Індукована сепсисом міопатія
Анотація
Основними клінічними висновками при ослабленій реанімації є слабкість м’язів кінцівок та слабкість дихальних м’язів. Довгострокові наслідки слабкості периферичних м’язів включають функціональні порушення, обмеження фізичних навантажень та якість життя, нижчу за нормальну, пов’язану зі здоров’ям, іноді зберігаючись роками після виписки з реанімації (8–10). Важливо, що наявність слабкості дихальних м’язів призводить до тривалої тривалості штучної вентиляції легенів, утруднення відлучення пацієнтів від вентилятора та рецидиву дихальної недостатності після екстубації (11, 12). Хоча успішне відлучення залежить від ряду факторів, врешті-решт, це баланс між навантаженням, що накладається на дихальні м’язи, спричиненим змінами в механіці легеневої та грудної стінок (наприклад, підвищений опір дихальних шляхів, зниження відповідності) та здатністю вентиляційного насоса підтримують це навантаження, що дозволяє відновити спонтанну вентиляцію (13, 14). Тому успішне відлучення критично залежить від сили та витривалості дихальних м’язів. Дослідження показують, що втома діафрагми не сприяє відсутності відлучення (15). Однак, коли дихальні м’язи слабкі, як це часто буває, успішне відлучення може відбутися лише тоді, коли сила та витривалість дихальних м’язів покращуються.
Клінічна оцінка сили скелетних м'язів у хворих на критично важке захворювання
Раннє клінічне виявлення слабкості периферичних та/або дихальних м’язів важко. Складність проведення електрофізіологічних досліджень включає вимогу до нервово-м’язових спеціалістів, що володіють знанням техніки, мінливість інтерпретації результатів та технічні обмеження, обумовлені методами лікування, які можуть заважати точному розміщенню електродів, таких як перев’язувальні матеріали для рани, артеріальні катетери або периферійні набряки (4). Крім того, для максимальної надійності тестування вимагає співпраці пацієнта. Ці фактори сприяють відсутності рутинного використання цих методів, особливо тому, що доступність неврологів з такою експертизою обмежена. Як результат, електродіагностичне тестування зазвичай вимагається після клінічного розпізнавання слабкості, яка, як правило, виникає в кінці еволюції захворювання.
Діафрагма силових частотних зв'язків у тварин, які отримували ендотоксини. Діафрагмові криві сили-частоти для контрольних (◯) та низьких (●), середніх (▴) та високих (┎) груп ендотоксинів. Як було показано, ендотоксин викликав дозозалежне зменшення генерування сили, специфічної для дихальних м’язів. * Контрольна група суттєво відрізнялася від трьох груп ендотоксинів. Модифіковано та відтворено з дозволу Супінського та ін. (55).
Подібні дані свідчать про те, що сепсис також змінює генерування сили, специфічної для периферичних м’язів. Супінський та співавтори досліджували вплив різних доз ендотоксину та спостерігали> 50% зменшення здатності генерувати силу як діафрагми, так і м'язів кінцівок (55) (рис. 2). Нещодавно Ейкерманн та співавт. Досліджували генерування сили та втомлюваність у м’язі привідного м’яза важких хворих на септичну хворобу, порівнюючи ці функціональні параметри у пацієнтів із нормальними особами до та після іммобілізації гіпсу (56). Важливо, що 2 тижні іммобілізації гомілки не мали впливу на формування сили у контрольних групах, але генерація сили була сильно знижена у септичних хворих (рис. 3).
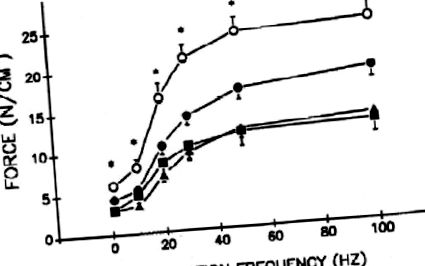
Взаємозв’язок сили та частоти м’язів кінцівок у тварин, які отримували ендотоксини. Співвідношення сили та частоти м’язів кінцівок (згинач hallucis longus) для контрольних (◯) та низьких (●), середніх (▴) та високих (■) груп ендотоксинів. Ендотоксин зменшує утворення специфічної сили м’язів кінцівок залежно від дози. * Контрольна група суттєво відрізняється від трьох груп ендотоксинів; # контрольна група суттєво відрізняється від групи з низькими та високими дозами ендотоксину; ** контрольна група суттєво відрізнялася від групи з низькою дозою ендотоксину. Модифіковано та відтворено з дозволу Супінського та ін. (55).
Сепсис викликає сарколеммальну травму скелетних м’язів. Репрезентативні мікрофотографії, що ілюструють вплив сепсису на сарколеммальну цілісність діафрагми. а, Контрольна група. Встановлено дуже мало поглинання барвників в окремих міоволокнах, хоча інтенсивне фарбування позаклітинної сполучної тканини свідчить про хорошу дифузію барвника по всій тканині. б, група ліпополісахаридів. Зверніть увагу на наявність численних міоволокна із сарколеммальними пошкодженнями, на що вказує їх нездатність запобігти потраплянню низькомолекулярного інгредієнтного барвника. c, група перфорації перев’язки слізої кишки. Міоволокна з пошкодженням сарколеми характеризуються змінним ступенем внутрішньоклітинного флуоресцентного фарбування, подібним до знахідок у групі ліпополісахаридів. Відтворено з дозволу Ліна та інших (83).
Хоча невідомо, чи виникає у пацієнтів пошкодження сарколемми, спричинене сепсисом, все ж це важливе питання для розгляду. Наприклад, добре описаний сприятливий вплив фізичних вправ на скелетні м’язи; однак вправи збільшують цитокіни та вироблення вільних радикалів у м'язах (86). Крім того, Дюмон та співавт. Нещодавно показали, що перенавантаження м’язів індукує запальну інфільтрацію клітин та погіршує сарколеммальну травму (87). Як результат, можна подумати, що заняття пацієнтами з пошкодженими м’язами можуть потенційно поширити м’язові запалення та травми або затримати відновлення. Такі питання слід ретельно вивчати в контексті ранньої мобілізації та втручання, особливо у пацієнтів із набутою слабкістю, спричиненою сепсисом.
Саркоплазматичний ретикулум
Ендотоксин змінює скорочення скорочувальної сили білка в діафрагмі. Одиничні діафрагмові волокна виділяли у контрольних та оброблених ендотоксинами тварин з подальшою пермеабілізацією Triton × 100 для видалення сарколемми, саркоплазматичного ретикулума та мітохондрій. Волокна були встановлені на перетворювачі сили і піддані дії ряду розчинів, що містять зростаючу концентрацію кальцію. Силу на площу перерізу визначали і виражали в кПа. PCa є негативним log концентрації кальцію (тобто, коли pCa зменшується, концентрація Ca2 + збільшується). Середні дані, що представляють усереднену абсолютну (Abs) силу відношення pCa для діафрагмальних волокон від контрольних (◯) та ендотоксичних (●) тварин. Смужки помилок представляють стандартну помилку середнього значення. Як показано, ендотоксин суттєво зменшив утворення скорочувальної сили в одиночних діафрагмових волокнах. Відтворено з дозволу Супінського та ін. (93).
Ендотоксин змінює скорочення скорочувальної сили білка в м’язах кінцівок. Поодинокі волокна з підошви та екстензора пальця довгі були виділені від тварин, які отримували ендотоксин, проникли в них та визначили взаємозв'язок сили проти pCa. A) Середні дані, що представляють усереднене відношення абсолютної сили проти pCa для волокон підошви контрольних (◻) та тварин, оброблених ендотоксинами (■). Б) Середні дані, що представляють усереднене відношення абсолютної сили проти pCa для волокон екстензора пальця довгих волокон контрольних (Δ) та тварин, оброблених ендотоксином (▴). Ендотоксин змінює функцію міофіламентів у скелетних м’язах кінцівок. Відтворено з дозволу Супінського та ін. (93).
У сукупності ці спостереження дають вагомі докази того, що сепсис індукує скорочувальну дисфункцію на рівні міофіламентів і що вільні радикали модулюють ці зміни. Важливо те, що ці скорочення в одиничному формуванні сили волокна тісно корелюють із спостережуваним зменшенням генерування сили, специфічної для м’язів, у непошкоджених м’язах (наприклад, генерування сили одиночного волокна та утворення інтактної м’язової сили зменшуються до однакової міри), і тому можуть пояснити скорочувальна дисфункція при сепсисі. Отже, зміни функції міофіламентів є основним місцем участі в септичній міопатії.
Мітохондрії
Ендотоксин регулює рівень білків цитокінів та хемокінів у скелетних м’язах. Кількісне визначення рівня білків цитокінів/хемокінів у діафрагмі та м’язах кінцівок після введення ліпополісахаридів in vivo. Рівні білка у вибраних прозапальних медіаторів (фактор некрозу пухлини [TNF] -α, інтерлейкін [IL] -6 та максимальний інспіраторний тиск [MIP] -2) вимірювали в діафрагмі (заповнені бруски) та передній гомілці (відкриті бруски) на 6 годин після підробленої (S) або ліпополісахаридної (L) обробки. Всі дані є середнім для групи ± стандартна помилка середнього значення (n = 6 мишей/група). * p † p Рис. 10). Крім того, генерування сили, специфічної для діафрагми, з часом поступово падало у відповідь на ендотоксин із зниженням сили на 50% через 24 години. Введення інгібітора каспази широкого спектру дії, Z-Val-Ala-Asp (OCH3) -фторметилкетон (zVAD-fmk), або селективного інгібітора каспази 3, N-ацетил-Asp-Glu-Val-Asp-al (DEVD- CHO), покращили ефекти індукованої ендотоксинами слабкості діафрагми (рис. 11). Важливо, що активація каспази 3 передувала зниженню генерації сили, специфічної для діафрагми, і зменшення генерування сили діафрагми відбулося без зменшення маси діафрагми або вмісту білка, що вказує на те, що скорочувальна дисфункція передує втраті м’язів при сепсисі. У подальших дослідженнях ми виявили, що активація зовнішнього шляху через каспазу 8 є основним шляхом, що відповідає за декременти при індукованій сепсисом скоротливої дисфункції діафрагми (152). Ці дані показують, що активація каспази 3 через зовнішній шлях суттєво сприяє ранній дисфункції скорочувального білка при сепсисі (54, 152).
Інгібування кальпаїну покращує генерацію сили, специфічної для діафрагми, при індукованому ендотоксином сепсисі. Середні криві частоти зусиль діафрагми, що порівнюють контрольних тварин, тварин, які отримували ендотоксин (24 години), тварин, яким давали як ендотоксин, так і інгібітор кальпаїну III, та тварин, яким давали лише інгібітор кальпаїну III. Формування сили було значно нижчим при частотах стимуляції від 10 до 150 Гц для діафрагм від тварин, оброблених ліпополісахаридом (LPS) (заповнені кола), ніж для контрольних тварин (відкриті квадрати). Діафрагми тварин, яким давали як інгібітор кальпаїну III, так і ліпополісахарид, генерували сили, значно вищі, ніж діафрагми тварин, яким давали лише ендотоксин, для частот від 50 до 150 Гц. Формування сили для м’язів, відібраних у тварин, які отримували лише інгібітор кальпаїну III, було подібним до рівнів для контрольних тварин. * Значна статистична різниця між контролем та ендотоксином; # статистичне значення між ендотоксином та ендотоксином плюс інгібітор кальпаїну III груп. Відтворено з дозволу Супінського та Каллахана (135).
Сепсис зменшує синтез білка скелетних м’язів
Наслідки та майбутні вказівки
Сепсис (включаючи септичний шок, синдром системної запальної реакції інфекційної та неінфекційної етіології, поліорганну недостатність) є основною причиною смертності та тривалої захворюваності у пацієнтів реанімації. Сепсис викликає міопатію, що залучає як дихальні, так і м’язи кінцівок. Постійність цих міопатичних змін, спричинених сепсисом, ймовірно, суттєво сприяє набутій ВІТ слабкості. У минулому наш клінічний підхід до слабкості та марнотратства полягав у підтримці цих пацієнтів адекватним харчуванням та лікувальною фізкультурою, сподіваючись, що це призведе до функціонального відновлення, але очевидно, що такий підхід не впливав на поширеність та результати пацієнтів розвинути слабкість, набуту в реанімації. Можливо, це тому, що ми не розглядали роль багатьох інших важливих факторів.
Подальші фундаментальні наукові дослідження необхідні для з’ясування патологічних послідовностей, що беруть участь на клітинному рівні, а також їх взаємодії та значення на різних етапах еволюції індукованої сепсисом скоротливої дисфункції, втрати м’язів та біоенергетичної недостатності. Потрібні також дослідження механізмів відновлення функції м’язів після травми. Це повинно надати ключову інформацію для розробки специфічних орієнтованих на м’язи та/або органел фармакологічних методів лікування, щоб запобігти інсулін-інтенсивній дисфункції м’язів та пришвидшити одужання. Крім того, клінічні випробування повинні систематично включати найкращі наукові дані та використовувати найкращі діагностичні засоби для критичного вирішення цих проблем у наших пацієнтів. Нарешті, час терапевтичних втручань буде вирішальним. Застосовуючи такі підходи, ми будемо готові розробити раціональну терапію для профілактики та лікування інфікуючих міопатій.
Подяка
Автори отримали фінансування від Національних інститутів охорони здоров’я (HL 080609 та HL 069821 до LAC; HL 080429, HL 081525 та HL 063698 до GSS).
- Рецепти салатів від медичних експертів Ну добре
- Омега-3 Божевілля Риб'ячий жир або зміїна олія Центр науки в інтересах суспільства
- Омега-3 - VegPlate
- У космосі немає місця для жінок, стверджують росіяни; Новини в галузі науки (ABC Science)
- Калорії олії салату (111Cal12г) та факти харчування - калорійність