Хімічний профіль та антиоксидантна активність олії з насіння півонії (Paeonia suffruticosa Andr.)
Сінь Ян
1 Школа хімії та хімічної інженерії, Університет Яньтай, Яньтай 264005, Китай
Ді Чжан
2 Школа фармації, Університет Яньтай, Яньтай 264005, Китай
Лі-мін пісня
1 Школа хімії та хімічної інженерії, Університет Яньтай, Яньтай 264005, Китай
Цянь Сю
2 Школа фармації, Університет Яньтай, Яньтай 264005, Китай
Хонг Лі
2 Школа фармації, Університет Яньтай, Яньтай 264005, Китай
Хуей Сюй
2 Школа фармації, Університет Яньтай, Яньтай 264005, Китай
3 Ключова лабораторія молекулярної фармакології та оцінки лікарських засобів, Університет Янтай, Яньтай 264005, Китай
4 Спільний інноваційний центр удосконаленої системи доставки ліків та біотехнологічних препаратів в університетах Шаньдуна, Міністерство освіти, Яньтай 264005, Китай
Анотація
1. Вступ
Трав'яниста півонія (Paeonia suffruticosa Andr.) - різновид традиційної китайської декоративної рослини, що широко культивується в Китаї, Америці, Європі та інших азіатських районах. На додаток до декоративного використання для своїх привабливих квітів, більшість видів півонії також використовувались як лікарські рослини, і дослідження в основному були зосереджені на пеонолі, пеоніфлорині та інших біоактивних компонентах віночка, листя та кори коренів протягом тривалого часу [ 1–3]. Суха кора кореня півонії, названа по-китайськи муданпі, офіційно зареєстрована у всіх виданнях китайської фармакопеї (ЧП) і широко застосовується у складі препаратів традиційної китайської медицини для сприяння кровообігу та усунення застою крові. Насіння півонії є основним побічним продуктом муданпі із середньорічною врожайністю до 3750 кг з гектара. Однак майже всі насіння півонії були просто взяті як промислові відходи. Протягом останнього десятиліття цей рослинний ресурс привертає великі інтереси для подальшого розвитку, оскільки насіння півонії, особливо олія насіння, виявляються багатими ненасиченими жирними кислотами, амінокислотами, стильбеноїдами та іншими поживними речовинами [4, 5].
2. Матеріали та методи
2.1. Матеріали та хімікати
Випробувальний зразок PSO був продуктом корпорації розвитку технологій півоній Heze Ruipu (Шаньдун, Китай), приготованим традиційним методом холодного пресування. Оливкова олія екстра вірджин (EVOO, Olivoila®, Італія), що використовується як контроль, була придбана в місцевому супермаркеті. Для обох зразків олії були виявлені основні хімічні показники, включаючи кислотну, йодну, пероксидну та омилення, щоб відповідати вимогам національних китайських стандартів до їстівної рослинної олії. Галлова кислота, α-токоферол, 1,1-дифеніл-2-пікрилгідразил (DPPH), реагент Фолін-Ціокальтеу, натрій карбоксиметилцелюлоза (CMC) та бичачий сироватковий альбумін (BSA) були отримані від Sigma-Aldrich Co. (St. Louis, Міссурі, США). Сальвіанолова кислота A (SAA), різновид природної поліфенольної сполуки з потужним антиоксидантним властивістю [16], була люб’язно надана Shandong Target Drug Co. Ltd. (Яньтай, Китай), а капсула Xuezhikang була продуктом Пекінського Пекінського Університету. ТОВ "Біологічні технології", Китай. Всі інші хімічні речовини були найвищого рівня.
2.2. Аналіз жирних кислот та немилених речовин
PSO (5 г) гідролізували 20 мл 2 М КОН у метанолі при 60 ° С протягом 30 хв. Омилену фракцію витягували методом Wang et al. [17]; тим часом омилену фракцію перетворювали в метилові ефіри жирних кислот (FAMEs) і екстрагували в гексан згідно з методом Zhou et al. [9]. Для обох фракцій залишки сушили під вакуумом і зважували після видалення розчинників. Відсоткову масу немилених речовин (рому) та жирних кислот (Rfa) у PSO розраховували як Wuf/Woil × 100% та (1 - Wuf/Woil) × 100%, відповідно, де Wuf означав масу немиленої фракції та Woil вага PSO. Потім обидва залишки були повторно розчинені в гексані та піддані аналізу за допомогою газової хроматографії-мас-спектрометрії (GC-MS) з використанням системи GC-MS Shimadzu QP2010 Plus (Кіото, Японія) згідно з попередньо повідомленими умовами [9, 17]. Якісний аналіз проводився шляхом зіставлення моделей пикової масової фрагментації з тими, що знаходяться в бібліотеках масового спектру NIST05, а кількісний аналіз проводився шляхом нормалізації площ піків для отримання процентного вмісту кожного компонента, Pep, з якого можна було б визначити його швидкість у PSO (R) обчислюється множенням на Rum або Rfa.
2.3. Аналіз загальної кількості токоферолів та загальної кількості фенольних речовин
Після екстракції методом Li et al. [18], загальні токофероли в PSO аналізували, використовуючи флуоресцентний спектрофотометр Hitachi F7000 (Токіо, Японія) з α-токоферолом в якості еталону. Довжина хвилі 280 нм використовувалась для збудження, а 324 нм - для випромінювання. Загальні фенольні речовини в PSO екстрагували метанолом, а потім визначали за допомогою реагенту Фолін-Ціокальтеу за методикою Xie та співавт. [19]. Галову кислоту використовували як еталонний стандарт, і результати виражали як еквіваленти галової кислоти (GAE) в PSO.
2.4. Визначення антиоксидантної активності in vitro
2.4.1. Аналіз очищення DPPH
DPPH - це свого роду стабільний вільний радикал з сильною смугою поглинання з центром приблизно 520 нм, що призводить до насиченого фіолетового кольору радикала DPPH у розчині. При нейтралізації він стає безбарвним або блідо-жовтим, що дозволяє контролювати концентрацію радикалів для оцінки активності, що поглинає радикали, від зміни оптичного поглинання [20]. Активність вилучення по відношенню до вільних радикалів DPPH визначали методом, описаним Wang et al. [21] з невеликими змінами. Коротше кажучи, 4,6 мл аликвоти досліджуваних зразків, розчинених у ДМСО у концентраціях 0–50 мг · мл -1, змішували з 0,4 мл свіжого етанольного розчину DPPH (1 мМ), а потім витримували при кімнатній температурі протягом 30 хв. Одночасно суміш без досліджуваного зразка готували як контрольний заготовку. Потім поглинання вимірювали при 517 нм за допомогою спектрофотометра Shimadzu UV2550 (Кіото, Японія). Відсоток активності очищення DPPH, виражений як% очищення, розраховували за рівнянням (1 - AA/AB) × 100%, де AA та AB були значеннями поглинання досліджуваного зразка та заготовки відповідно.
2.4.2. Аналіз гідроксильного радикального очищення
В обох моделях EVOO та α-токоферол використовувались як позитивні контролі, і для кількісного порівняння було розраховано концентрацію для 50% максимального ефекту очищення, EC50.
2.5. Визначення антиоксидантної активності In Vivo
2.5.1. Експерименти на тваринах
Антиоксидантну активність in vivo досліджували, використовуючи мишачу модель гострого пошкодження печінки, спричиненого CCl4 та щурів гіперліпідемії, індукованих дієтою з високим вмістом жиру, згідно з методами, про які раніше повідомляли із деякими модифікаціями [15, 23]. Тварин, включаючи здорових дорослих самців мишей куньмінських та щурів Спраг-Доулі (SD), постачав Експериментальний центр тварин Шаньдун Лує Фармасьютикал Ко. Лтд. (Яньтай, Китай), розміщений під 12-годинним циклом світло/темрява в затверджений будинок для тварин, що підтримується при температурі 22 ± 2 ° C та відносній вологості від 40% до 60%, забезпечується вільний доступ до їжі та води та надається можливість клімату протягом тижня до експериментів. Усі протоколи та експерименти на тваринах були схвалені Комітетом з етики експериментів на тваринах університету Яньтай та відповідали керівництву Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин.
Вісімдесят мишей вагою 20 ± 2 г були випадковим чином розподілені в шість груп для послідовного 4-тижневого експерименту, включаючи нормальну контрольну групу (NC, n = 8), модельну контрольну групу (MC, n = 8), позитивну контрольну групу (MC + P, n = 16), а також низькі, середні та високі дози груп, які отримували PSO (MC + L, MC + M та MC + H; n = 16 для кожної групи). Мишам у групах MC + P, MC + L, MC + M та MC + H вводили один раз на день пероральним введенням з SAA (7,5 г · кг -1 д -1) та PSO (1,3, 4,0 або 12,0 g · kg −1 d −1), суспендованих у 1% Na-CMC, та тих, хто в NC та MC групах з еквівалентним об’ємом суспендуючого агента, відповідно. Через добу після останнього введення всім мишам, крім мишей групи NC, інтраперитонеально вводили CCl4 (0,125% в арахісовій олії, об./Об.) У дозі 10 мл · кг -1 для отримання гострої травми печінки, тоді як Група NC отримала еквівалентний обсяг арахісової олії.
Самців щурів Sprague-Dawley вагою 200 ± 20 г випадковим чином розподіляли до шести груп (n = 6) для послідовного 30-денного експерименту, включаючи групу нормальної дієти (ND), групу модельної дієти з високим вмістом жиру (HFD), позитивний контроль групи (HFD + P), а також низькі, середні та високі дози груп, оброблених PSO (HFD + H, HFD + M та HFD + L). Тварин групи ND щодня годували нормальним стандартним лабораторним раціоном, складеним відповідно до GB14924.3-2010 (Shanghai Keaoxieli Feed Co. Ltd., Китай), тоді як інші п’ять груп годували комерційним гризуном AIN-76 дієта (Seebio Biotech (Shanghai) Co. Ltd., Китай) для моделі гіперліпідемії. Тим часом щурам у групах HFD + P, HFD + L, HFD + M та HFD + H вводили внутрішньошлунково один раз на день із Xuezhikang (120 мг · кг -1 д − 1) і PSO (1,0, 2,5 або 6,0 г · Кг −1 d −1), суспендованих у 1% Na-CMC, та таких, що належать до груп ND та HFD з еквівалентним об’ємом суспендуючого агента, відповідно. Дозування базувались на раніше повідомлених методах та рекомендованому споживанні людиною ПСО [12, 23].
Для обох моделей масу тіла реєстрували кожні 2 дні, а тварин голодували протягом ночі та жертвували в кінці експериментального періоду. Печінку швидко видалили, ретельно промили крижаним сольовим розчином, промокли і зважили. Сироватку отримували центрифугуванням (4 ° C, 3000 об/хв × 10 хв). Всі зразки сироватки та печінки зберігали при -80 ° C до аналізу.
2.5.2. Біохімічний аналіз
Гомогенати печінки готували з холодним сольовим розчином (10%, мас./Об.) Для біохімічного аналізу. Індекси окисного стресу, включаючи вміст малонового диальдегіду (MDA) та активність супероксиддисмутази (SOD), глутатіонпероксидази (GPX), аспартатамінотрансферази (AST) та аланінамінотрансферази (ALT) у сироватці крові або печінці, були виявлені для оцінки антиоксидантної активності за допомогою комерційних набори (Нанкінський інститут біоінженерії Цзяньчен, Китай). Для оцінки гіперліпідемічної активності щурів за допомогою комерційних наборів були виявлені рівні ліпідів, включаючи загальний холестерин у сироватці крові (ТС), тригліцериди (ТГ), холестерин ліпопротеїдів низької щільності (ЛПНЩ-С) і холестерин ліпопротеїдів високої щільності (ЛПВЩ-ЛП) Shanghai Zhicheng Biological Technology Co. Ltd., Китай) відповідно до інструкцій виробника. Вміст білка в сироватці крові або печінці визначали методом Бредфорда, використовуючи BSA як стандарт.
2.5.3. Аналіз складових жирної кислоти в печінці миші
2.6. Статистичний аналіз
Всі значення були виражені як середнє значення ± стандартне відхилення (SD). Для аналізу даних використовували односторонній дисперсійний аналіз (ANOVA) та багаторазове порівняльне тестування Тукі. Відмінності менше 0,05 (P Таблиця 1. Жирні кислоти становили 98,46% від загальної маси ПСО і складалися в основному з ненасичених жирних кислот (УЖК) із ваговим відсотком до 89,34%. Хоча вміст і склад УФА в насінні рослин олії можуть варіюватися залежно від методів екстракції, PSO характеризується домінуючим вмістом UFAs згідно зіставлення даних для даного тестового зразка PSO, приготовленого традиційним методом холодного віджиму, та даних за допомогою надкритичної екстракції вуглекислого газу або екстракції розчинником [10] Більше того, переважаючі UFA у PSO визначали як поліненасичені жирні кислоти (PUFA), включаючи n-3 ALA (38,86%), n-6 лінолеву кислоту (LA, 26,74%) та олеїнову кислоту (23,74%), що свідчить про велика частка n-3 ПНЖК (ALA, більше 38%) і низьке співвідношення n-6/n-3 (0,69) в PSO. Це також збігалося з повідомленням про жирні кислоти в шістдесяти сортах півонії дерев, що вказувало на те, що співвідношення n-6/n-3 становило від 0,4 до 1,6 і щура io n-3 до загальної кількості FA був більше 38% [24].
Таблиця 1
Вміст основних жирних кислот, немилених речовин, загальних токоферолів та фенольних речовин у PSO.
| (A) Основні жирні кислоти (%) | |
| Пальмітинова кислота | 7,5 ± 2,8 |
| Стеаринова кислота | 1,8 ± 0,2 |
| Олеїнова кислота | 24,1 ± 3,7 |
| LA | 27,2 ± 1,7 |
| ALA | 39,5 ± 5,1 |
| (B) Немилені речовини (мг/100 г) | |
| γ-токоферол | 63,4 ± 2,6 |
| Стигмастерол | 30,8 ± 1,2 |
| γ-ситостерин | 955 ± 33 |
| Фукостерол | 248 ± 17 |
| (C) Загальний вміст токоферолів (мг/100 г) | 76,0 ± 3,1 |
| (D) Загальна кількість фенольних речовин (мг/100 г) | 3,34 ± 0,15 |
a Дані виражаються як середнє значення ± SD трьох повторень (n = 3).
3.2. Антиоксидантна активність in vitro
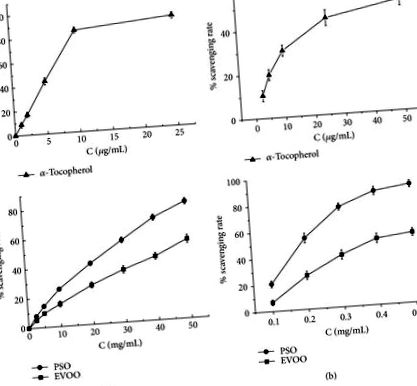
Поглинання активності PSO in vitro проти радикалів DPPH (a) та гідроксильних (b). В якості контролю використовували EVOO та α-токоферол, і дані представляли середнє значення ± SD триразових визначень відсотка вилучення вільних радикалів.
3.3. Захисні ефекти проти окислювальних збитків, спричинених CCl4, на мишах
Багато доказів свідчать про те, що споживання антиоксидантних поживних речовин з харчових джерел має переваги для здоров’я. Однак існує велика різниця між антирадикальною та антиоксидантною активністю, і вони не обов'язково збігаються. На думку Тірзітіса та Бартоша, антирадикальна активність може характеризувати здатність сполук реагувати із вільними радикалами в рамках однієї вільнорадикальної реакції, тоді як антиоксидантна активність представляє здатність інгібувати процес окислення, який зазвичай включає сукупність різних реакцій [40]. . Отже, всі тестові системи, що використовують стабільний вільний радикал, дають інформацію про знищення радикалів чи антирадикальну активність, і в багатьох випадках вона не відповідає антиоксидантній активності. Тому в даному дослідженні проводились подальші дослідження in vivo, щоб зрозуміти справжню антиоксидантну властивість PSO.
Жирні кислоти, присутні в печінці мишей. Значення виражаються як середнє значення ± SD (n = 6). a P b P Малюнок 5 (a), не було значущих відмінностей у прирості маси тіла серед шести груп. Незважаючи на те, що тварини в групі HFD + H виявляли найменший приріст ваги, знижуюча вагу функція PSO не була пов'язана з придушенням апетиту, оскільки спостерігались незначні відмінності у щоденному споживанні їжі. Однак група HFD продемонструвала значно вищу масу печінки, а також рівні ТС, ТГ та ЛПНЩ у сироватці крові (P Рисунок 5 (b)). Таким чином, такі відмінності між двома групами свідчать про успішну модель гіперліпідемії, спричиненої дієтою, що супроводжує пошкодження печінки у щурів. На відміну від групи HFD, у цих груп, які одночасно годувались PSO, спостерігалися дозозалежні зміни цих параметрів, що відповідало позитивним результатам PSO, про які повідомлялося раніше [12], а також вказувало на його гіполіпідемічний потенціал як дієтичної добавки завдяки ефективному поліпшення атерогенного профілю ліпопротеїнів.
- Хімічний склад та антиоксидантна активність Borago officinalis L
- Дієта, фізична активність та поведінкові втручання для лікування надмірної ваги або ожиріння
- Дієта, фізична активність, ожиріння та грудне вигодовування як сприймають фактори французи
- Дієта, фізична активність та поведінкові втручання для лікування надмірної ваги або ожиріння
- Дієтальна загальна антиоксидантна здатність у молодшому шкільному віці та наступні алергічні захворювання - PubMed