Дієтичні добавки з рисовими висівками, ферментованими Еденси Лентинапідвищує активність інтерферону-γ, не викликаючи побічних ефектів: рандомізоване, подвійне сліпе, плацебо-контрольоване дослідження паралельної групи
Анотація
Передумови
Метою цього дослідження було дослідити гіпотезу, згідно з якою дієтичні добавки з рисними висівками, ферментованими Еденси Лентина (екзобіополімер рисових висівок, RBEP), речовина, яка, як відомо, містить арабіноксилан, підсилює активність клітин природних кілерів (NK) і модулює вироблення цитокінів у здорових дорослих.
Методи
Це дослідження було розроблене у рандомізованому, подвійному сліпому, плацебо-контрольованому та паралельно-груповому форматі. Вісімдесят здорових учасників з рівнем лейкоцитів 4000-8000 клітин/мкл було випадковим чином призначено приймати шість капсул на день або 3 г RBEP, або 3 г плацебо протягом 8 тижнів. Троє учасників групи плацебо були виключені після ініціювання протоколу; серйозних побічних ефектів від добавок RBEP не повідомлялося. Активність NK-клітин одноядерних клітин периферичної крові вимірювали за допомогою наборів для аналізу нерадіоактивної цитотоксичності, а концентрації цитокінів у сироватці крові включали інтерферон (IFN) -γ, фактор некрозу пухлини (TNF) -α, інтерлейкін (IL) -2, IL-4, IL-10, а IL-12 вимірювали за допомогою набору для аналізу цитокінів Bio-Plex. Це дослідження було зареєстровано в Службі інформації про клінічні дослідження (KCT0000536).
Результати
Добавки RBEP значно збільшили вироблення IFN-γ порівняно з групою плацебо (P = 0,012). Однак добавки RBEP не впливали ні на активність NK-клітин, ні на рівень цитокінів, включаючи IL-2, IL-4, IL-10, IL-12 та TNF-α, порівняно з групою плацебо.
Висновки
Дані, отримані в цьому дослідженні, вказують на те, що добавки RBEP збільшують секрецію IFN-γ, не викликаючи значних несприятливих наслідків, і, отже, можуть бути корисними для здорових людей. Тому цей новий продукт, отриманий з рисових висівок, може бути потенційно корисним для включення у рецептуру твердої та рідкої їжі, призначеної для лікування та профілактики патологічних станів, пов'язаних з дефектом імунної відповіді.
Передумови
Рисові висівки, головний побічний продукт переробки рису, в даний час є недостатньо використаним ресурсом, хоча вони є прекрасним джерелом цінних біоактивних сполук, таких як харчові волокна, вітаміни та антиоксиданти [1]. Серед харчових волокон, що містяться у рисових висівках, арабіноксилан, пектин та β-глюкан є функціональними полісахаридами з властивостями модифікатора біологічної відповіді (BRM) [2]. Наприклад, було показано, що полісахариди з рисових висівок активують імунологічні клітини, які складають частину передньої лінії захисту організму від раку [3, 4]. Однак функціональність імунозміцнюючих BRM у рисових висівках обмежена, оскільки BRM розташовані в клітинній стінці, де вони комплексуються з геміцелюлозою [5].
Розроблено ферментативні процеси, що відокремлюють біологічно активні полісахариди від решти рисових висівок, завдяки чому ці полісахариди можуть бути використані як нові BRM [6, 7]. Рисові висівки, ферментовані Еденси Лентина (екзобіополімер рисових висівок, RBEP) - це харчова добавка, яку отримують взаємодією рисових висівок із вуглеводами, отриманими з грибів Шиітаке [8]. Крім того, було показано, що RBEP пригнічує ріст клітин меланоми шляхом посилення активності клітин природних кілерів (NK) у мишей [2] та активуючи клітини макрофагів як в природних умовах і в пробірці [5, 8]. Також повідомлялося, що різні продукти, отримані з рисових висівок та грибних культур, підвищують активність NK-клітин у пацієнтів з множинною мієломою [9], ракових мишей [10] та лімфоцитів [11, 12]. Зокрема, було показано, що харчові добавки з арабіноксиланом, полісахаридом, отриманим із рисових висівок, підвищують активність NK-клітин у пацієнтів з різними видами раку [13].
Клітини NK відіграють вирішальну роль у протираковій захисті господаря, і, отже, жорстко регулюються за допомогою різноманітних механізмів. Активація NK-клітин для знищення клітин-мішеней може безпосередньо і опосередковано модулюватися цитокінами, включаючи інтерферон (IFN), інтерлейкіни (ILs) та фактор некрозу пухлини (TNF) [14]. Попередні дослідження з продуктами, отриманими з рисових висівок та грибних культур, також продемонстрували підвищену концентрацію IFN-γ та TNF-α у пацієнтів з розсіяною мієломою [9], на додаток до мишей, що несуть карциному Ерліха [10]. Однак клінічних досліджень здорових людей досі не проводилось для вивчення впливу добавок RBEP на активність NK-клітин та концентрацію цитокінів. Отже, це рандомізоване, подвійне сліпе, контрольоване плацебо дослідження паралельних груп було покликане перевірити гіпотезу про те, що добавки RBEP посилюють активацію NK-клітин і модулюють вироблення цитокінів у здорових корейських людей.
Методи
Навчальні матеріали
RBEP та плацебо були приготовані корпорацією Erom (Sungnam, Корея) згідно з методом, про який повідомляли Yu et al. [8]. Коротко, Еденси Лентина був культивований у відповідному середовищі для росту з рисовими висівками, поки не спостерігався значний ріст міцелію. Далі, Еденди Лентина міцелії та нерозчинні компоненти рисових висівок видаляли центрифугуванням. За допомогою екстракції лугу та осадження етанолом полісахариди збирали з отриманих супернатантів, а потім ліофілізували. Уронову кислоту використовували як маркерну сполуку для RBEP. У таблиці 1 наведено хімічний склад RBEP. Плацебо містило 430,69 мг кукурудзяного крохмалю, 69,29 мг харчового барвника та 2,51 мг стеаринової кислоти. Щодня надавали шість капсул або 3 г RBEP, або плацебо.
Вивчати дизайн
Це дослідження було 8-тижневим рандомізованим, подвійним сліпим, плацебо-контрольованим та паралельним груповим клінічним дослідженням. Усі описані тут роботи були схвалені Радою з перегляду установ Університетської лікарні Ханьян (HYUH 2012-05-008). Це дослідження було проведено відповідно до Гельсінської декларації, і письмова інформована згода була отримана від усіх учасників. Це дослідження було зареєстровано в Службі інформації про клінічні дослідження (KCT0000536).
Всього в цьому дослідженні кожен пацієнт пройшов 1 скринінг та 3 візити. На початковому скринінгу учасники опитувались для збору даних соціодемографії, а історію хвороби отримували під час співбесіди та вимірювали кількість його лейкоцитів (WBC). Зріст вимірювали без взуття за допомогою стадіометра, а вага вимірювали, поки учасники носили легкий одяг без взуття, використовуючи Inbody 720 (Biospace Corporation, Сеул, Корея). Візити відбувались у такий час після первинного скринінгу: відвідування 1 (тиждень 0), 7–10 днів після скринінгу; відвідати 2, 4 тижні післякринінга; та відвідайте 3, 8 тижні післякринінг. Під час усіх відвідувань проводили вимірювання результатів та проводили оцінку безпеки. Зразки крові та сечі натще збирали і зберігали при -20 ° C до аналізу. На 4 та 8 тижнях відповідність контролювали шляхом підрахунку кількості капсул, що залишились.
Учасників попросили не приймати жодних оздоровчих продуктів, що містять ферментовані рисові висівки, і не змінювати звичний спосіб життя та харчування під час дослідження. Триденні дієтичні записи використовувались для моніторингу змін у дієтах на 0, 4 та 8 тижнях; ці записи були проаналізовані за допомогою CAN-pro 4.0 (Програма автоматизованого аналізу 4.0 для професіоналів, Корейське товариство харчування, Сеул, Корея).
Учасники
Учасники були набрані за допомогою рекламних плакатів та газет протягом вересня 2012 року. Відкрито сто шістдесят три добровольці, і 80 учасників мали право взяти участь у цьому дослідженні. Учасники були включені, якщо їм було 25–70 років, вони не були вагітними та не годували грудьми та мали показник лейкоцитів від 4000 до 8000 клітин/мкл. Учасників виключали, якщо вони мали якусь інфекційну хворобу; хронічне захворювання, таке як серцево-судинні захворювання, цукровий діабет, захворювання нирок, захворювання щитовидної залози або психічні розлади; або регулярно приймав будь-які ліки або добавки протягом попередніх 3 місяців. Інші критерії виключення включали рівень креатиніну, що перевищує верхню межу в 2 рази вище норми, а рівень аспартатамінотрансферази (AST) або аланінамінотрансферази (ALT) ≥ 3 рази вище норми верхньої межі.
Вимірювання результатів
Активність NK-клітин та концентрації цитокінів включали IFN-γ, TNF-α, IL-2, IL-4, IL-10 та IL-12 вимірювали на тижнях 0, 4 та 8. Для вимірювання активності NK-клітин периферична кров одноядерні клітини (РВМС) отримували шляхом розділення градієнта щільності. Гранульовані клітини ресуспендували у забуференному фосфатом сольовому розчині, і їх життєздатність визначали за допомогою розчину трипанового синього. Для вимірювання активності NK-клітин використовували набори для аналізу нерадіоактивної цитотоксичності (Promega Inc., Madison, WI, USA). Ефекторні клітини (РВМС) висівали в 96-лункові планшети, клітини К562 (Korean Cell Line Bank, Сеул, Корея) використовували як клітини-мішені. Співвідношення ефектор: клітини-мішені становило 10: 1, і кожен аналіз проводили у трьох примірниках. Аналізи проводили відповідно до інструкцій виробника. Коротко кажучи, планшети інкубували при температурі 37 ° C з 5% CO2 протягом 4 годин. Потім поглинання при 490 нм зчитували за допомогою зчитувача мікропланшетів iMark TM (Bio-Rad Laboratories, Inc., Геркулес, Каліфорнія, США). Цитотоксичність розраховували за такою формулою:% цитотоксичності = [(експериментальний - ефектор спонтанний - цільовий спонтанний)/(цільовий максимум - цільовий спонтанний)] × 100.
Концентрацію цитокінів у сироватці крові вимірювали за допомогою набору для аналізу цитокінів Bio-Plex (Bio-Rad Laboratories, Inc., Геркулес, Каліфорнія, США) відповідно до протоколу виробника. Аналіз даних проводили за допомогою програмного забезпечення Bio-Plex Manager 6.1 (Bio-Rad Laboratories, Inc.).
Оцінка безпеки
Побічні явища, вживання наркотиків та терапевтичне лікування були зафіксовані під час дослідження. Гематологічні лабораторні тести, аналізи хімії крові та аналіз сечі проводили за допомогою гемоцитометра Coulter STKS (Beckman Coulter Inc., Фуллертон, Каліфорнія, США), автоматизованого аналізатора Hitachi 7150 (Hitachi Ltd., Токіо, Японія) та автоматизованого Clinitek Atlas аналізатор хімії сечі (Siemens Healthcare Diagnostics, NY, США) відповідно. Всі аналізи були проведені в Корейській біомедичній лабораторії. Артеріальний тиск та частоту пульсу вимірювали за допомогою приладу Omron HEM-7051 (Omron Healthcare, Кіото, Японія); температуру тіла вимірювали інфрачервоним термометром (Thermoscan IRT-4020, Braun Corporation, Kronberg, Німеччина).
Рандомізація
Незалежний, засліплений дослідженнями статистик підготував створену комп'ютером схему рандомізації, що дозволяє проводити рандомізацію в блоки. Послідовно пронумеровані контейнери з RBEP або плацебо були отримані від виробника і були випадковим чином призначені учасникам під час першого візиту. Ідентифікаційні коди були приховані в послідовно пронумерованих непрозорих конвертах, якими керували слідчі дослідження та контролювали співробітники клінічних досліджень (Neonutra Corporation, Сеул, Корея). Весь персонал та учасники дослідження залишалися незрячими щодо ідентифікаційних кодів протягом усього дослідження.
Статистичний аналіз
Це дослідження було спрямоване на вибірку 32 у кожній групі, щоб досягти статистичної потужності 80% (P
Результати
Характеристика учасника
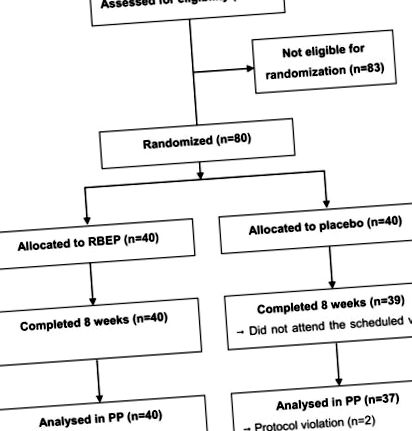
Принципова схема робочого процесу дослідження наведена на рисунку 1. У групі плацебо 1 учасник не з’явився під час другого відвідування, а 2 учасники були вилучені з дослідження через порушення протоколу. Відповідність не суттєво відрізнялася між групами RBEP та плацебо (89,1 ± 10,8% проти 91,7 ± 8,2%; P = 0,240). Під час дослідження не спостерігалось значних змін у споживанні поживних речовин між двома групами (дані не наведені). Ці дві групи також не мали суттєвих відмінностей щодо віку, кількості лейкоцитів, рівня тиреотропного гормону, статі, ІМТ, наявності сімейного анамнезу, пов'язаного з імунними розладами, кількості одружених або безробітних учасників або кількості нині курців або поточний напій (табл. 2). Тринадцять учасників у групі RBEP та одинадцять у групі плацебо регулярно здійснювали вправи, більше 3 разів на тиждень по 30 хв і більше. Крім того, у двох учасників був розлад опорно-рухового апарату, у одного - розлади репродуктивної системи, а у двох - розлади дихання протягом 6 місяців до дослідження. Однак жодне з розладів не було важким і ніхто не мав поточних проблем зі здоров’ям.
Принципова схема профілю навчання. RBEP, рисові висівки, ферментовані Еденди Лентина.
Первинні та вторинні результати
На початковому рівні, первинність, активність NK-клітин та вторинні результати, рівні цитокінів суттєво не відрізнялися між двома групами (табл. 3). Добавки RBEP значно збільшили рівень IFN-γ порівняно з групою плацебо на 8 тижні (P = 0,012). Однак добавки RBEP не мали істотного впливу на рівні IL-2, IL-4, IL-10, IL-12 або TNF-α порівняно з лікуванням плацебо. Добавки RBEP посилювали активність NK у групі RBEP, але не посилювали активність NK-клітин, коли групу RBEP порівнювали з групою плацебо.
Оцінка безпеки
Незначні побічні явища були зареєстровані у 11 учасників (26,19%, 15 випадків) у групі RBEP та 18 учасників (42,86%, 23 випадки) у групі плацебо; ця різниця не була суттєвою (P = 0,108; Таблиця 4). Кількість побічних явищ, які, як вважають, можуть бути пов'язаними з втручаннями, імовірно, не пов'язаними з втручаннями, і, безумовно, не пов'язаними з втручаннями, становили 3, 2 та 3 в групі RBEP та 1, 10 та 19 у групі плацебо, відповідно.
Середня кількість тромбоцитів була значно нижчою для групи RBEP, ніж для групи плацебо лише на початковому рівні, а середня кількість лейкоцитів була значно знижена у групі RBEP (P = 0,016, таблиця 5). Однак суттєвих відмінностей в інших гематологічних параметрах, показниках хімічного складу крові, вазі, артеріальному тиску, частоті пульсу або температурі тіла між двома групами не спостерігалося. Аналіз сечі також не виявив суттєвих відмінностей між двома групами (дані не наведені). Усі гематологічні параметри, показники хімічного складу крові та результати аналізу сечі залишались у межах норми.
Обговорення
Це було перше рандомізоване подвійне сліпе плацебо-контрольоване дослідження паралельних груп, що вивчало імуномодулюючі ефекти RBEP у здорових дорослих. Це групове дослідження показало, що добавки RBEP значно підвищують рівень IFN-γ порівняно з групою плацебо, проте добавки RBEP, здається, не посилюють активність NK-клітин порівняно з групою плацебо. Важливо, що добавки RBEP не викликали жодних значних побічних ефектів у цьому дослідженні.
Погоджуючись з результатами, отриманими в цьому дослідженні, попередні дослідження повідомляли, що арабіноксилан, виділений з рисових висівок, значно підвищував рівень IFN-γ у пацієнтів з множинною мієломою [9], у мишей, що переносять асцит Ерліха [10], та у в пробірці дослідження [11, 12, 20]. Крім того, полісахариди з Angelica sinensis і від кореня Sanguisorba officinalis було показано, що збільшує продукцію IFN-γ у клітинах селезінки [21] та мишах, що несуть пухлину [22], відповідно. Вважається, що ця посилююча імунітет дія арабіноксилану пов'язана з посиленою секрецією IFN-γ, що супроводжується активацією NK-клітин [11]. Однак IFN-γ продукується не тільки NK-клітинами, але також Т-і В-клітинами [23].
Попередні дослідження також повідомляли, що добавки RBEP активують як макрофаги в природних умовах і в пробірці [5, 8]. Арабіноксилан, отриманий з рисових висівок, зеленого листя Litsea glutinosa, Показано, що пшеничні висівки також підвищують активність макрофагів в пробірці [24, 25] або у мишей, що несуть пухлину [26]. Крім того, арабіноксилан, виділений із рисових висівок, підвищував функцію CD4 + Т-клітин у дендритних клітинах, отриманих моноцитами людини [20], і збільшував проліферацію Т і В-клітин як у людей, так і без раку [13, 27]. Попередні дослідження постійно повідомляли, що полісахариди з вечірньої примули, Curcuma xanthorrhiza, і Angelica sinensis збільшити активність макрофагів та/або проліферацію Т-клітин в природних умовах або в пробірці [21, 28, 29]. Ці дані в поєднанні з даними, представленими в цьому дослідженні, дозволяють припустити, що збільшення продукування IFN-γ, що виникає внаслідок добавки RBEP, може бути опосередкованим або макрофагами, В-клітинами, або Т-клітинами, і, ймовірно, не опосередковується NK-клітинами.
Кім та ін. показали, що добавки RBEP не виявляли гемопоетичної токсичності на мишачих моделях солідних пухлин, тим самим надаючи важливі докази того, що RBEP є безпечним і потенційно може бути використаний як для профілактики, так і для лікування раку [2]. Збільшення кількості лейкоцитів спостерігалося у пацієнтів із запаленням [30], і було показано, що це пов’язано з високою смертністю від раку [31]. У цьому дослідженні добавки REBP призвели до незначного зменшення кількості лейкоцитів; однак кількість лейкоцитів у учасників залишалася в межах норми, і, отже, цей результат клінічно незначущий.
Висновки
Це було перше рандомізоване подвійне сліпе плацебо-контрольоване дослідження паралельних груп, що вивчало імуномодулюючі ефекти RBEP у здорових дорослих. Представлені тут дані дозволяють припустити, що добавки RBEP значно збільшують продукцію IFN-γ, але не посилюють активність NK-клітин; крім того, добавки RBEP не пов’язані зі значними побічними ефектами.
- Вплив харчових добавок піколінату хрому на сироваткову глюкозу, холестерин та мінерали
- Вплив нерозчинних харчових волокон пшеничних висівок з різним розміром частинок на текстуру
- Рисові висівки знижують рівень холестерину здоровим харчуванням SF ворота
- Дієтичні добавки екстракту грибів посилюють ріст та рівень антиоксидантів Вавилонії
- Дієтичний шипшина надає антиатеросклеротичну дію та посилює розширення, зумовлене оксидом азоту