Випадок діабету молодих людей у зрілому віці (MODY3) у сім’ї з новою мутацією гена HNF1A у п’яти поколіннях
А. К. Овсяннікова
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
2 Новосибірський державний університет, Новосибірськ, Росія
О. Д. Римар
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
Д. Є. Іванощук
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
2 Новосибірський державний університет, Новосибірськ, Росія
3 Федеральний науково-дослідний центр Інститут цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
Світлана Василівна Михайлова
3 Федеральний науково-дослідний центр Інститут цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
Є. В. Шахтшнайдер
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
2 Новосибірський державний університет, Новосибірськ, Росія
П. С. Орлов
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
2 Новосибірський державний університет, Новосибірськ, Росія
3 Федеральний науково-дослідний центр Інститут цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
Є. С. Малахіна
2 Новосибірський державний університет, Новосибірськ, Росія
4 Інститут молекулярної та клітинної біології Сибірського відділення Російської академії наук, Новосибірськ, Росія
М. І. Воєвода
1 Інститут внутрішньої та профілактичної медицини - філія Інституту цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
2 Новосибірський державний університет, Новосибірськ, Росія
3 Федеральний науково-дослідний центр Інститут цитології та генетики Сибірського відділення Російської академії наук, Новосибірськ, Росія
Пов’язані дані
Набори даних під час та/або проаналізовані під час поточного дослідження доступні у відповідного автора за обґрунтованим запитом.
Анотація
Цукровий діабет з аутосомно-домінантним успадкуванням, тобто діабет молодих людей (MODY), є генетичною формою цукрового діабету. Фенотип MODY пов'язаний з генними мутаціями, що ведуть до дисфункції β-клітин підшлункової залози. Тут ми представляємо клінічний випадок 50-річного пробанда із сімейним цукровим діабетом у п’яти поколіннях (пробанд, її мати, бабуся, прадід та син). Ця хвороба, швидше за все, пов’язана з новою мутацією Ser6Arg у гені HNF1A, яку виявили у чотирьох членів сім’ї. Мутації не виявлено у пацієнтів MODY (126 суб'єктів), пацієнтів із цукровим діабетом 2 типу (188 суб'єктів) та у загальній вибірці (564 суб'єкти).
Електронний додатковий матеріал
Інтернет-версія цієї статті (10.1007/s13300-017-0350-8) містить додаткові матеріали, доступні для авторизованих користувачів.
Вступ
Цукровий діабет (ЦД) з аутосомно-домінантним успадкуванням, тобто СД у молодих (MODY), є гетерогенною групою захворювань, спричинених генними мутаціями, що призводять до дисфункції β-клітин підшлункової залози [1 - 4]. Верифікація MODY дозволяє успішно вести пацієнтку, забезпечуючи здорову вагітність та забезпечуючи генетичне консультування сімей [5 - 7]. Обстеження родичів пробандів MODY дозволяє діагностувати гіперглікемію на доклінічній фазі.
На сьогоднішній день визначено 14 генів, пов’язаних із MODY. Мутації в кожному з цих генів призводять до розвитку різних підтипів MODY, що відрізняються розподілом популяцій, клінічними ознаками та стратегіями управління [1, 8 - 10]. Незважаючи на значну різницю в поширеності окремих форм захворювання в різних популяціях, мутації генів, що кодують гепатоцитарний ядерний фактор 1α (HNF1A) та глюкокіназу (GCK), є домінуючими типами мутацій, пов'язаних з MODY, а саме, підтипами MODY3 (MODY -HNF1A) та MODY2 (MODY-GCK) відповідно [11]. На ці підтипи припадає до 90% усіх випадків MODY [12]. У Великобританії, Нідерландах та Данії найпоширенішою формою моногенного діабету є MODY-HNF1A, тоді як в Іспанії, Італії, Франції, Німеччині та Чехії переважає MODY-GCK [13]. У Росії захворюваність MODY-GCK та MODY-HNF1A приблизно однакова [14].
У цьому звіті ми описуємо клінічний випадок у сім'ї з MODY-HNF1A, пов'язаний з новою мутацією HNF1A.
Опис справи
50-річна жінка із СД регулярно відвідувала наш відділ, і за її станом ретельно стежили. Під час первинного огляду у вересні 2015 року вона скаржилася на відчуття печіння в ногах протягом дня, періодичні головні болі та втому.
Через сімейний анамнез ДМ, син пробанда обмежив споживання легкозасвоюваних вуглеводів у дитинстві та підлітковому віці і регулярно контролювався на предмет глікемії; гіперглікемія на сьогодні не виявлена. У ті ж періоди проблем з масою тіла не було. У віці 21 року у нього з’явилися пов’язані зі стресом симптоми головного болю, втоми та розладу сну. Під час обстеження виявлено гіперглікемію натще (8–10 ммоль/л) та постпрандіальну (12,8 ммоль/л), що призвело до діагностики СД. Рекомендувалось лікування препаратами сульфонілсечовини (SU), але пацієнт вибрав базально-болюсний режим інсулінотерапії. В даний час він використовує інсулін деглюдек при 6 ОД/день та інсулін Аспарт при 1 ОД/МО (у середньому 15 ОД/день). Антитіла до β-клітин та GAD відсутні. Базальний рівень С-пептиду низький: 260 пмоль/л (референтний діапазон 298–2350); HbA1c становить 7,1%. Біохімічний аналіз крові виявив підвищення рівня холестерину ЛПНЩ (3,2 ммоль/л; контрольні значення 2 .
Зараз матері пробанда зараз 72 роки. Діагноз СД у її доньки сприяв регулярному контролю рівня глюкози. Гіперглікемія була діагностована у віці 45 років під час планового обстеження; скарг не зареєстровано, і вона не мала проблем із вагою. Зазвичай спостерігали гіперглікемію після їжі. Пацієнт досягав і підтримував нормоглікемію за допомогою дієтотерапії протягом 2 років, потім шляхом прийому гліклазиду протягом 5 років. У віці 52 років (1997) декомпенсація вуглеводного обміну представлена, здебільшого, як постпрандіальна гіперглікемія; інсулін актрапід був призначений (замість гліклазиду) при 0,5 ОД/КО, який пацієнт зараз приймає. У матері пробанда діагностовано діабетичну периферичну полінейропатію з дисліпідемією. Серед супутніх захворювань є артеріальна гіпертензія з 40 років (без постійної гіпотензивної терапії) та дивертикул стравоходу.
Пробанд, її мати та її син отримали вищу освіту, не палять і дотримуються дієтичного та фізичного навантажень, рекомендованих при СД.
У сімейній історії пробанда ДМ також була присутня у її бабусі та прадіда по матері, тобто у п'яти поколіннях (рис. 1, а). Хвороба у обох родичів проявилася у віці 65–66 років на тлі тривалих стресових станів. Прадід приймав ліки SU (карбутамід) і помер у віці 74 років після повторних гострих цереброваскулярних захворювань. Бабуся також приймала препарати SU (гліклазид) у дозах, менших за середні терапевтичні, з хорошим глікемічним контролем, і померла у віці 91 року; її історія хвороби включала артеріальну гіпертензію та повторне гостре захворювання судин головного мозку.
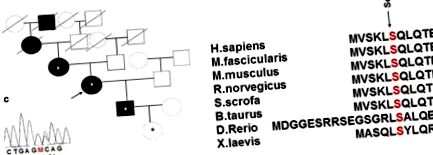
a Сімейна історія та новий варіант гена, що кодує гепатоцитарний ядерний фактор 1α (HNF1a) у сім'ї із спадковим цукровим діабетом (ЦД). Зірочка позначає носіїв мутації HNF1a Ser6Arg, які обстежувались медиками. b Збережена амінокислотна послідовність гена HNF1a серед різних видів. c Послідовність із заміщенням амінокислот
У пробанда, її сина та матері в молодому віці спостерігалася дисліпідемія, а також у інших родичів, які мали СД, у старшому віці розвинулися макросудинні ускладнення. Майже всі ці пацієнти досягали і підтримували нормоглікемію протягом певного часу завдяки рекомендованій дієті; цей результат свідчить про неагресивний початок цього типу СД. У пробанда, її сина та матері, які всі використовували фармакотерапію для лікування СД, з часом розвинулася декомпенсація вуглеводного обміну, спричинена стресом, що призвело до збільшення дози.
Через характерні особливості захворювання (сімейна агрегація СД, дисліпідемія та макросудинні ускладнення, підвищення рівня глюкози в крові при нормальній масі тіла, використання малих доз інсуліну, стабільний рівень С-пептиду та відсутність анти-острівцевих антитіл ), Підозрювали MODY-HNF1A.
Протокол дослідження був затверджений місцевим Комітетом з етики Інституту внутрішньої та профілактичної медицини (філія Інституту цитології та генетики Сибірського відділення Російської академії наук, м. Новосибірськ, Росія). Письмова інформована згода на обстеження та участь у дослідженні була отримана від кожного пацієнта. Для осіб молодше 18 років інформована згода була підписана батьком або законним опікуном. Геномна ДНК для секвенування була виділена з лейкоцитів венозної крові шляхом фенол-хлороформної екстракції [15].
Прямий та зворотний праймери для екзонів та меж екзонів були розроблені в програмному забезпеченні Primer-Blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/). Олігонуклеотиди показані в таблиці електронних додаткових матеріалів. ПЛР встановлювали за допомогою BioMaster LR HS-PCR (2 ×) (BiolabMix, Новосибірськ, Росія). Програма ПЛР складалася з початкової денатурації при 94 ° С протягом 3 хв, після чого 35 циклів при 94 ° С протягом 30 с, 68 ° С протягом 30 с і 72 ° С протягом 50 с. Продукти ПЛР оцінювали електрофорезом у 5% поліакриламідному гелі після візуалізації розчином бромістого етидію. Драбину ДНК на 100 п.н. (SibEnzyme, Новосибірськ, Росія) запускали на кожному гелі як маркери молекулярного розміру. Амплікони очищали за допомогою бісеру Agencourt AMPure Xp (Beckman Coulter, Palo Alto, CA). Реакції секвенування проводили на автоматизованому секвенсорі ДНК ABI 3500 (Thermo-Fisher Scientific, Уолтем, Массачусетс) з набором секвенування циклу BigDye Terminator v3.1 (Thermo Fisher Scientific). Послідовності аналізували за допомогою програмного забезпечення Vector NTI® Advance (Thermo Fisher Scientific). Версія людського геному hg19 служила еталонною послідовністю для вирівнювання.
Метод прямого автоматизованого секвенування Сангера був застосований до ДНК пробанда і до ДНК доступних членів її сім'ї, тобто матері, сина і нормоглікемічної онуки пробанда у віці 2 місяців, для аналізу екзонів та місць сплайсингу. Ген HNF1A. Експертиза виявила нову гетерозиготну заміну Ser6Arg (AGC> AGA) в екзоні 1 гена HNF1A у всіх перевірених членів сім'ї. Ця заміна розташована у висококонсервативному регіоні. Постраждале положення також зберігається серед видів (рис. 1 b) і знаходиться в області, відповідальній за димеризацію білка [16]. Можливі функціональні та суттєві ефекти варіантів міссенсу HNF1A були передбачені за допомогою інструментів in silico PolyPhen-2 v.2.2.5 [17], SIFT та PROVEAN [18]. Веб-сервіси PolyPhen-2 v.2.2.5 та PROVEAN/SIFT передбачають можливий вплив заміщення амінокислот на структуру та функції людського білка. Виявлений варіант був передбачений як «потенційно патогенний» за допомогою PolyPhen-2 з оцінкою 0,815 та «пошкоджуючим» за допомогою SIFT з оцінкою 0,001.
У дослідженні HUNT2, потенційно патогенна мутація Ser6Arg була виявлена в кодоні 6, але в іншому нуклеотидному положенні, AGC> AAC, у норвезького пацієнта з MODY [19]. Це не було виявлено у 838 норвезьких недиабетних контрольних суб'єктів HUNT2.
Ми протестували ген HNF1A на Ser6Arg у трьох групах. Перша група складалася з 564 випадково відібраних пацієнтів, друга група - 188 пацієнтів із СД 2 типу (СД2), а третя група - 126 пацієнтів із фенотипом MODY. Всі аналізи проводились в Інституті внутрішньої та профілактичної медицини м. Новосибірська.
Загальна група пацієнтів, включена в аналіз, була обрана в результаті опитування населення, опитаного в рамках проекту HAPIEE [20], Новосибірськ, Росія (9360 учасників, віком 45–69 років, і 50% чоловіків, 97% кавказців) . У наше дослідження було включено 564 випадково вибраних пацієнтів (середній вік 54,2 ± 0,4). Групу DM2 складали 68 жінок та 87 чоловіків [середній вік 59,0 ± 6,7 років; середній ІМТ 31 кг/м 2 (чоловіки) та 32 кг/м 2 (жінки)]. Зразок DM2 був довільно відібраний з проекту HAPIEE [20]. Ми використовували критерії Американської діабетичної асоціації (http://care.diabetesjournals.org/content/40/Supplement_1) для діагностики СД2. Загалом 126 пацієнтів з фенотипом MODY (середній вік 23,8 ± 2,6 року) пройшли повне медичне обстеження протягом певного періоду між 2014 та 2017 роками, включаючи біохімічний аналіз крові; визначення HbA1c, С-пептиду, GAD, ICA, стану щитовидної залози та мікроальбумінурії; УЗД черевної порожнини та нирок; постійний моніторинг глюкози в режимі реального часу за допомогою Medtronic Paradigm MMT-722 (Meditronic, Дублін, Ірландія); та генетичні тести.
Ser6Arg генотипували за допомогою аналізу TaqMan SNP (BioLabMix, Новосибірськ, Росія) та системи ПЛР StepOnePlus у реальному часі (Thermo Fisher Scientific, США).
Тестування на заміщення Ser6Arg у гені HNF1A дало негативні результати у популяційній вибірці HAPIEE, у вибірці 188 суб'єктів із DM2 та серед 126 пацієнтів з клінічною картиною MODY.
Обговорення
Молоді пацієнти з дисбалансом вуглеводного обміну можуть отримати діагноз цукровий діабет 1 типу (СД1), СД2 або рідкіші моногенні форми СД [21]. Початок хвороби нашого пацієнта характеризувався відсутністю деяких особливостей найбільш поширених типів СД. Відсутність кетонурії та кетоацидозу є нетиповим; антитіл до GAD чи ICA не виявлено, які є у понад 70% пацієнтів з проявами DM1 [22]. Рівень С-пептиду був нормальним, але цей результат можна спостерігати на ранніх стадіях DM1. Пацієнт не мав надмірної ваги та не мав клінічних проявів інсулінорезистентності, таких як acanthosis nigricans, що характерно для DM2 на початку захворювання [23]. Діагноз MODY був підтверджений діагнозом СД у п’яти поколіннях, стабільною секрецією С-пептидів та дисліпідемією в молодому віці без зайвої ваги.
У представленому клінічному випадку заміщення було виявлено в екзоні 1, вік виявлення гіперглікемії у пробанда становив 12 років, але СД проявився у віці 21 року.
Найбільш раннім клінічним маркером захворювання може бути глікозурія, яка пов’язана з порушенням реабсорбції глюкози в нирках [1]. Були задокументовані випадки мікро- та макросудинних ускладнень у пацієнтів MODY-HNF1A, що наголошує на необхідності контролю рівня глюкози в крові у цих пацієнтів [25]. У родичів пробанда також були виявлені макросудинні ускладнення.
На додаток до розвитку СД, мутації гена HNF1A пов’язані з новоутвореннями печінки, такими як гепатоцелюлярна аденома (рідкісна доброякісна пухлина печінки, яка зазвичай зустрічається у молодих жінок, які використовують оральні контрацептиви), і в рідкісних випадках з гепатоцелюлярними карциномами [ 26]. Як правило, клінічні прояви MODY-HNF1A варіюються від субклінічної гіперглікемії до вираженої декомпенсації вуглеводного обміну серед різних пацієнтів і навіть серед родичів в одній родині з патогенною мутацією [10].
Препарати SU (SUP) є основним методом лікування. Відомо, що носії мутації HNF1A є більш чутливими до гіпоглікемічних ефектів SUP, ніж пацієнти з DM2 [1]. У досліджуваному випадку мати пробанда змогла досягти нормоглікемії під час прийому СУП, також протягом тривалих періодів. Згідно з літературою, приблизно 50% пацієнтів із прогресуючим захворюванням MODY-HNF1A потребують інсулінотерапії [27].
Прояв СД під час вагітності, що супроводжується значним збільшенням глікемії, відсутністю кетозу, розвитком мікросудинних ускладнень (ретинопатія та невропатія) з коротким клінічним перебігом та поєднання гіперглікемії з дисліпідемією є специфічними ознаками СД у пацієнтки що вивчається.
Висновок
Цей випадок виявляє незвичні особливості ЦД, пов’язані з новою заміною Ser6Arg у гені HNF1A (підтип MODY3). Ця зміна нуклеотидів не була виявлена в загальній вибірці популяції і зуміла викликати MODY3 у пробанда та її сім'ї. Цей випадок ілюструє особливе значення персоніфікованого підходу до діагностики та лікування для виявлення атипового перебігу СД у молодих людей із сімейною історією гіперглікемії.
Електронний додатковий матеріал
Нижче наведено посилання на електронний додатковий матеріал.
- Випадок зловживання метформіном для цілей зниження ваги у пацієнта без діабету - радник з ендокринології
- Нова генна структура сімейства дезінтегрінів Субодиниця димерного дезинтегріну має коротке кодування
- За проблемами із зображенням тіла сповивання молодих жінок
- Таблички з жиром на животі Найкращі відгуки Сімейний стоматолог Вентцвіль
- Сімейна трава Ніжна квітка і лист липи; Трав'яна академія