Гальмівна взаємодія між нейронами орексину та харчуванням
Ж. Антоніо Гонсалес
1 лабораторія Мілл Хілл, Інститут Френсіса Крика, Лондон NW7 1AA, Великобританія
Ліз Т. Дженсен
2 Інститут клінічної медицини Орхуського університету, 8200 Орхус, Данія
Панайота Йорданіду
1 лабораторія Мілл Хілл, Інститут Френсіса Крика, Лондон NW7 1AA, Великобританія
Моллі Стром
3 Центр здоров'я Сайнсбері, Університетський коледж Лондона, Лондон W1T 4JG, Великобританія
Ларс Фуггер
2 Інститут клінічної медицини Орхуського університету, 8200 Орхус, Данія
4 Оксфордський центр нейрозапалення, Відділ клінічної неврології та відділення імунології людини MRC, Відділ клінічних нейронаук Наффілда, Інститут молекулярної медицини Ветералла, Оксфордський університет, Оксфорд OX3 9DS, Великобританія
Денис Бурдаков
1 лабораторія Мілл Хілл, Інститут Френсіса Крика, Лондон NW7 1AA, Великобританія
5 Інститут психіатрії, психології та неврології, Департамент нейробіології розвитку, Королівський коледж Лондона, Лондон WC2R 2LS, Великобританія
Пов’язані дані
Резюме
Результати і обговорення
Динаміка природної популяції клітин ОГ під час добровільного харчування
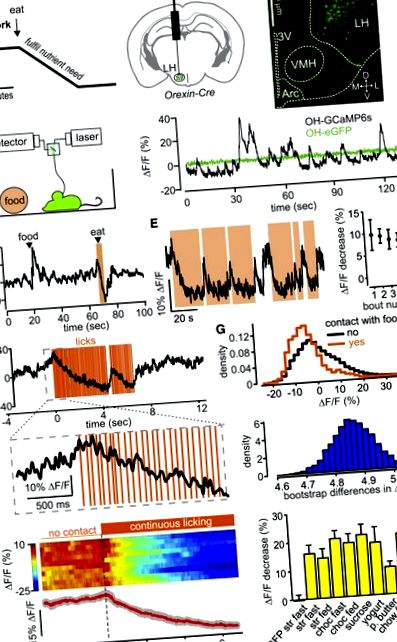
Клітини орексину/гіпокретину (ОН) активуються натще і на низькому рівні глюкози, і припускають, що вони керують їжею до тих пір, поки введена глюкоза повільно (протягом декількох хвилин) не інактивує їх (Малюнок 1 А) [19, 24]. Ми вимірювали активність популяції клітин ОН у мишей, що поводяться вільно, за допомогою волоконної фотометрії [17] індикатора активності GCaMP6s, націленого на клітини ОН, під час моніторингу прийому їжі за допомогою датчиків відеоспостереження або дотику (Рисунок 1 B; Рисунки S1 – S3). У мишей, що вільно поводяться, ми спостерігали коливання активності в клітинах OH-GCaMP6, але не в клітинах OH-eGFP (рис. 1 С). Величина цих коливань (~ 10% –40% ΔF/F) була подібною до динаміки мережі, зафіксованої подібними методами в інших регіонах мозку [25, 26]. Наше експериментальне кількісне визначення показників фотометрії дозволило припустити, що> 95% сигналу флуоресценції надходитиме на ∼0,5 мм від кінчика волокна (малюнки S2A та S2B), що добре підходить для розмірів кластеру ОН у гіпоталамусі миші. Ми підтвердили, що сигнал GCaMP6s відображає фізіологічну модуляцію клітин ОН шляхом відтворення раніше описаної активації клітин ОН звуками [14] та in vitro інгібування клітин ОН глюкозою [24] (малюнки S1C та S1D). Сигнал OH-GCaMP6s був прямо пропорційний швидкості випалу клітини OH (Рисунок S3).
Вплив харчування на динаміку природних клітин OH In Vivo
(А) Гіпотеза про часову модуляцію клітин ОН під час їжі.
(B) Зліва: схема націлювання GCaMP6s на клітини ОН для отримання даних, показаних на цьому малюнку (дані, що використовують альтернативне націлювання клітин ОН, показані на малюнках S2C – S2F). Справа: локалізація місця введення та шляху оптичного волокна. 3В, третій шлуночок; L, D, M, V, бічні, дорсальні, медіальні, черевні; VMH, вентромедіальний гіпоталамус; Дуга, дугоподібне ядро. Репрезентативне зображення n = 5 мозку.
(C) Зліва: схема запису. Справа: слід флуоресценції під час дослідження клітини для мишей, що експресують GCaMP6s або eGFP в нейронах ОН. Типові приклади n = 5 та n = 3 мишей відповідно.
(D) Слід флуоресценції під час введення їжі в клітку та її подальшого споживання (затінене апельсином місце). Їжею була крапля полуничного молочного коктейлю. Типовий приклад n = 5 мишей.
(E) Ліворуч: слід флуоресценції під час повторних припадків контакту з їжею (ділянки, затінені апельсином; їжа - це полуничний молочний коктейль). Типовий приклад n = 5 мишей. Справа: кількісне визначення зміни флуоресценції протягом перших 2 с послідовних припадків контакту з їжею (означає ± SEM, n = 3 миші).
(F) Зміна флуоресценції під час вилизування їжі, виявленого сенсорним датчиком (їжа - полуничний коктейль). Типовий приклад n = 5 мишей у восьми продуктах харчування, показаних у (H), праворуч.
(G) Вгорі: щільність ймовірності активності клітин ОН. Внизу: розподіл різниць у початковій стріпці тих самих даних. Типовий приклад n = 3 мишей.
(H) Ліворуч: графіки періодів подій, вирівняні до початку сутичок (пунктирна лінія). Теплова карта показує окремі спалахи (два на мишу), а слід під тепловою картою показує середнє значення пробних середніх показників від кожної миші (червона лінія; сірі лінії представляють SEM); n = 5 мишей. Справа: кількісна оцінка експерименту, показаного зліва, для різних продуктів харчування. У кожному стовпці відображається зміна флуоресценції протягом перших 4 с поєдинку вилизування (середні сигнали протягом 3,5-4 с мінус сигнал протягом −0,5 до 0 с, у рази відносно першого злизування). Дані є середніми значеннями ± SEM n = 4 мишей у кожній групі. Ліва колонка є контрольною (миші OH-eGFP); інші колонки - миші OH-GCaMP6; щодо харчових скорочень див. Додаткові експериментальні процедури; швидкий, нічний пост перед експериментом; годували, дозвільно годуючи перед експериментом. Усі зміни у мишей OH-GCaMP6s були значними (с 3.4).
Ми виявили, що контакт з продуктами харчування надзвичайно швидко пригнічує активність клітин ОН (рис. 1 D – 1H). Клітини ОН повернулись у вищий стан протягом декількох секунд після припинення контакту з їжею (Рисунки 1 D – 1F; Рисунок S2E), вказуючи на те, що швидка модуляція ОН-клітин не спричинена повільно змінюються харчовими сигналами. Цей ефект спостерігався як на голодуваних, так і на годуваних мишах OH-GCaMP6, але не в контролях OH-eGFP (рис. 1 H). Що стосується рідкої їжі, то падіння активності клітин ОН було очевидним лише за кілька злизувань (рис. 1 F; рисунки S2E та S2F). Депресія клітин ОГ, пов’язана з прийомом їжі, була подібною для продуктів різної консистенції (наприклад, чау проти йогурту) та різної апетитної цінності (наприклад, чау проти арахісового масла) (рис. 1 Н). Щоб підтвердити, чи відіграє роль калорійність, ми протестували нульову калорію «їжу» (розчин сукралози) і все ще спостерігали стійку інактивацію клітин ОН під час лизання (рис. 1 Н). Загалом, ці дані показують, що клітини ОН швидко інактивуються внаслідок прийому їжі, незалежно від властивостей їжі та енергетичного стану організму.
Природний вплив нейронів ОГ на харчування
Вищезазначені корелятивні дані мають дві можливі причинно-наслідкові інтерпретації: (1) клітини ОГ протистоять їжі, і їм заборонено вживати їжу, або (2) клітини ОН рухають їжу, і тому їжа припиняється незабаром після того, як клітини ОН замовчуються. Щоб розрізнити ці можливості, ми досліджували причинно-наслідковий зв'язок між природною активністю ОГ і харчуванням, інактивуючи клітини ОН у дорослих мишей за допомогою стратегії вибивання клітин, опосередкованої токсиновими рецепторами [27, 28].
Ми створили нових трансгенних мишей, у яких експресія людського рецептора дифтерійного токсину (DTR) управляється промотором ОН (див. Додаткові експериментальні процедури). У мишей OH-DTR, але не у контрольних мишей WT, ін’єкція дифтерійного токсину абляціювала всі клітини ОН, але не сусідні клітини, що містять меланін-концентрат, протягом декількох днів (рис. 2 A – 2D). Ця повна інактивація ОН-клітин, що не настільки легко досяжна за допомогою альтернативних методів мовчання, таких як опто- та хіміогенетика, може мати вирішальне значення для з'ясування їх повного впливу, оскільки фенотипи ключових дефіцитів не виявляються при частковій інактивації [13].
Вплив природної активності клітин ОН на спонтанний ритм годування
(А) Стратегія знищення нейронів ОГ у дорослих мишей.
(В) Імунофарбування для ОН (зеленого) та меланін-концентратного гормоносодержащего (МСН) (червоного) нейронів у DTR - (зверху) та DTR + (знизу) односмітників через 10 днів після ін’єкції DT. Ін'єкція DT призвела до втрати нейронів ОН у всіх досліджуваних мозках (n = 8). Смуги шкали представляють 500 мкм (ліворуч) та 100 мкм (праворуч). Пунктирними коробками на лівій панелі вказуються площі, показані на відповідних правих панелях.
(C) Часовий курс втрати клітин OH після ін’єкції DT в DTR + та їх DTR - односмітників (n = 5 мишей у кожній групі).
(D) Кількісне визначення кількості клітин ОН> 21 день після ін’єкції DT у DTR - та DTR + односмітників. Непарний t-тест, t (13,3) = 16,41, p = 3,2e-10, n = 8 мишей у кожній групі.
(E) Часові ряди ваги тіла DTR - і DTR + односмітників після ін'єкції DT. ANCOVA, F (1, 12) = 12,07, p = 0,005, n = 7 мишей у кожній групі.
(F) Щоденний ритм прийому їжі у мишей DTR - і DTR + після ін’єкції DT, протягом днів. n = 7 мишей у кожній групі.
Тимчасова дисоціація їжі, що залежить від голодування та ОГ
Вищезазначені результати демонструють, що природна активність клітин ОГ протистоїть харчуванню, і тому кидають виклик сучасним моделям, які передбачають, що клітини ОН стимулюють харчування. Однак оскільки ОН-клітини активуються натще, все ще можливо, що вони стануть критично важливими для компенсаційного харчування після голодування [11]. Щоб вивчити цю можливість, ми виміряли переїдання переїдання після голодування у мишей OH (тобто мишей DTR +, яким вводили DT), але напрочуд виявили, що це схоже на їх однокласники OH + (DTR - миші, яким вводили DT) (Рисунки 3 A та 3B ). Більше того, хоча миші OH - та OH + переїдають протягом декількох днів після голодування, у кожен із цих днів вони їли більше лише у фазі ранньої ночі (рис. 3 C та 3D), тобто на іншій фазі, коли їжа споживання природним шляхом регулювалося клітинами ОН (рис. 2 G). Ця тимчасова дисоціація показує, що, принаймні, за вивчених тут умов, дефіцит поживних речовин та клітини ОН регулюють різні щоденні фази споживання їжі. Ці дані свідчать про те, що клітини ОН не потрібні для компенсаційного переїдання після голодування, принаймні тоді, коли їжа доступна.
Вплив природної активності клітин ОН на прийом їжі після голодування
(A) Харчування у відповідь на 1-денний піст у контрольних мишей (OH +, DTR - миші, яким вводили DT) та їхні дефіцитні клітини OH (OH -, DTR + миші, яким вводили DT). n = 6 мишей у кожній групі.
(B) Щоденні ритми прийому їжі до та після одноденного голодування в ОН + та ОН - односмітники. n = 6 мишей у кожній групі.
(C) Щоденні ритми їжі за 3 дні до та після обмеження їжі. Повторні заходи ANOVA, взаємодія: F (7, 35) = 3,36, p = 0,008 (ліворуч) та F (7, 35) = 3,53, p = 0,006 (праворуч). Подальші тести показали суттєві відмінності лише у періоди, позначені зірочками (∗∗ p ∗∗∗ p + та OH - миші (n = 6 у кожній групі) протягом ранньої ночі (ZT12-14) у порівнянні з споживанням пізно ввечері ( ZT18–20). Парні t-тести.
Нормалізація прийому їжі запобігає набору ваги у мишей з дефіцитом клітин ОН
Визначення ефективної стратегії контролю маси тіла у осіб з дефіцитом ОГ має клінічний інтерес [21, 30]. У наших експериментах переїдання у OH-мишей (~ 10 г їжі протягом 50 днів або ~ 2% щодня) може бути теоретично достатнім для врахування надмірної ваги у цих мишей, виходячи з наступних міркувань. OH - миші набирають ∼10% ваги (відносно контролю OH +) протягом приблизно 45 днів, тобто,0,2% щоденного надлишку ваги (Малюнок 2 E). Наш експеримент натщесерце показує, що за 1 день 100% зміна споживання їжі може спричинити 10% зміну ваги (рис. 3 А). Якщо це співвідношення 10: 1 в цілому виконується, то збільшення щоденного прийому їжі на ~ 2% було б достатнім, щоб врахувати надлишкову вагу на 0,2% щодня.
Отже, ми дослідили, чи можна надмірне збільшення ваги у мишей OH - контролювати за допомогою м’яких дієтичних обмежень. Для досягнення цього ми застосували парадигму парного годування [31], коли їжа, доступна для кожної ОН-миші, щодня підбиралася до їжі, з’їденої контролером ОН + сміття (рис. 4 А). Це ефективно фіксує споживання їжі, але м’яко фізіологічно, без ненормальних періодів голодування [31].
Профілактика збільшення ваги, спричиненого втратою клітин ОГ шляхом дієти
(A) Стратегія експерименту з парним вигодовуванням (OH +, DTR - мишам, яким вводили DT; OH -, їх DTR + однолітки, яким вводили DT).
(B) Збільшення ваги однокласників OH - та OH + протягом 2 та 3 тижнів після введення DT та під час вільного годування (непарний t тест, t (11,93) = −4,327, p = 0,0009, n = 7 мишей у кожній групі) і парне годування (непарний t-тест, t (5.41) = -0.598, p = 0.574, n = 4 тварини в кожній групі).
Пара, що годує ОН - миші заважали їм ставати важчими за своїх братів і сестер ОН + (Малюнок 4 B). Навпаки, у контрольних експериментах, проведених у той же час, миші з вільним вигодовуванням ОН ставали значно важчими, ніж їх брати та сестри з ОН + (рис. 4 Б). Зауважте, що це не виключає, що інші фактори, крім прийому їжі, можуть опосередковувати збільшення ваги ОН-мишей, наприклад, зміни ритму сну/неспання та витрати енергії [2, 31, 32]. Однак наші результати дійсно свідчать про те, що за відсутності переїдання таких факторів недостатньо, щоб спричинити надмірне збільшення ваги.
Висновки
Наші висновки виявляють динаміку популяційної активності клітин ОГ під час прийому їжі і припускають, що їжа рідше відбувається, коли клітини ОН є природними активними. Клітини ОН стимулюють поведінку, яка не харчується, наприклад, рух (18). Хоча ці способи поведінки витрачають енергію, під час їх виконання важко їсти. Таким чином, можливим еволюційним обгрунтуванням наших висновків є те, що придушення залежної від ОН поведінки, що не харчується - шляхом замовчування клітин ОН при контакті з їжею - полегшило б їжу (наприклад, зробивши мишу рідше віддалятися від їжі). Спокусливо припустити, що підвищений прийом їжі після експериментальної стимуляції системи ОН [11, 13] може бути вторинною відповіддю на енерговитрати, обумовлені ОН [33], а не основною функцією клітин ОН.
Наші висновки визначають цікаві напрямки подальшої роботи. Ми виявили, що збільшення ваги у мишей з дефіцитом ОН-клітин можна запобігти м’яким обмеженням калорій. Це свідчить про те, що розвиток нефармакологічних втручань може бути корисним для управління надмірним збільшенням ваги при нервово-психічних станах, пов'язаних зі зниженою сигналізацією ОН [3, 21, 30, 34]. Крім того, наші результати дозволяють припустити, що клітини ОН, гіперактивність яких пов’язана з патологічними станами, такими як панічна тривога [5], можуть бути загальмовані простими добровільними діями, такими як їжа, незалежно від природи їжі. Подальші дослідження втручань у спосіб життя, що базуються на неврології для тривоги та ожиріння, можуть призвести до лікування, яке легше здійснити та мати менше побічних ефектів.
Експериментальні процедури
Активність клітин OH реєстрували in vivo, використовуючи волоконну фотометрію показника активності GCaMP6s, націленого на клітини OH, або використовуючи раніше охарактеризовані миші орексин-Cre та Cre-індуковані вірусні вектори GCaMP6s [35, 36] (Рисунок 1; Рисунок S1B) або з використанням нового генерував вектор залежного від промотору орексину аденоасоційованого вірусу (AAV) -GCaMP6s (характеризується на малюнках S2C – S2F і описується в Додаткових експериментальних процедурах). Клітини ОН були специфічно і повністю інактивовані за допомогою стратегії абляції клітин, опосередкованої рецептором дифтерійного токсину, у новостворених трансгенних мишей OH-DTR, описаних у Додаткових експериментальних процедурах. Споживання їжі контролювали за допомогою системи TSE PhenoMaster, чутливість та точність якої безпосередньо визначалися в нашій лабораторії (рисунки S4A – S4D). Тести на імуногістохімію та толерантність до глюкози проводили із застосуванням стандартних методик (див. Додаткові експериментальні процедури).
Внески автора
J.A.G. провели більшість експериментів; L.T.J. створили і охарактеризували трансгенних мишей DTR; П.І. проводив експерименти на малюнках S2C – S2F; РС. сприяв експериментам на малюнку S2C; Д.Б. та Л.Ф. розробили дослідження та отримали фінансування; та D.B., L.F. та L.T.J. написав роботу.
Подяка
Ми дякуємо докторам. Корнелія Шене, Руй Коста та Гохон Цуй за допомогу у волоконній фотометрії. Цю роботу профінансував Інститут Френсіса Крика, який отримує основне фінансування від Cancer Research UK, Британської ради з медичних досліджень та Wellcome Trust. L.F. підтримується MRC та Wellcome Trust.
Примітки
Опубліковано: 18 серпня 2016 р
Виноски
Додаткова інформація включає додаткові експериментальні процедури, чотири малюнки та один фільм, і їх можна знайти в цій статті в Інтернеті за адресою http://dx.doi.org/10.1016/j.cub.2016.07.013.
Додаткова інформація
Стрілка показує розташування носика для їжі, що містить рідку їжу (полуничний коктейль). Червоною крапкою позначений час, коли миша починає лизати.
- Пізно ввечері їсти, щоб скинути більше жиру; Побудуйте більше м’язів Kinobody
- Як; чистий; їжа допомогла мені подолати панічні атаки SBS Food
- Вилікуйте свої стосунки з їжею на кухні Рецепти інтуїтивного харчування
- Як; s Ваше дієтичне протизапальне харчування для оптимального харчування Карін Шенкс, доктор медичних наук
- Як зміна моїх харчових звичок допомогла моєму занепокоєнню; Південні кучері; Перлини