Дозозалежне збурення в серцевому енергетичному обміні пов’язане з індукованою радіацією ішемічною хворобою серця у ядерних працівників компанії «Маяк»
Омід Азімзаде
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
Тамара Азізова
2 Південно-Уральський інститут біофізики, Російська Федерація, Озорськ, Росія
Джуліана Мерл-Фам
3 Helmholtz Zentrum München-Німецький науково-дослідний центр з охорони навколишнього середовища (GmbH), Науково-дослідний підрозділ білкової науки, Мюнхен, Німеччина
Вікрам Субраманіан
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
Маюр В. Бакші
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
Марія Мосєєва
2 Південно-Уральський інститут біофізики, Російська Федерація, Озорськ, Росія
Ольга Зубкова
2 Південно-Уральський інститут біофізики, Російська Федерація, Озорськ, Росія
Стефані М. Хак
3 Helmholtz Zentrum München-Німецький науково-дослідний центр з охорони навколишнього середовища (GmbH), Науково-дослідний підрозділ білкової науки, Мюнхен, Німеччина
Наташа Анастасова
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
Майкл Дж. Аткінсон
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
4 Кафедра радіаційної біології, Технічний університет Мюнхена, Мюнхен, Німеччина
Soile Tapio
1 Helmholtz Zentrum München-Німецький дослідницький центр охорони навколишнього середовища (GmbH), Інститут радіаційної біології, Нойберг, Німеччина
Пов’язані дані
Неопрацьовані дані MS можна отримати з бази даних RBstore http://www.storedb.org/store_v3/study.jsp?studyId=1038
Анотація
ВСТУП
Виробниче об'єднання (ПА) "Маяк", розташоване в 150 км на південний схід від Катеринбурга, є одним з найбільших ядерних об'єктів у Російській Федерації. Індивідуальний дозиметричний моніторинг зовнішнього опромінення, проведений у ПА «Маяк», показав, що загальні дози зовнішнього гамма-випромінювання коливаються в межах від 100 мГр до понад 5 Гр, причому 32,6% працівників мають загальну дозу більше 1 Гр [1]. Епідеміологічні дослідження в цій когорті показали значне збільшення захворюваності на ішемічну хворобу серця (ІХС), пов’язану із загальною дозою зовнішнього гамма-випромінювання після корекції багатьох факторів, що конкурують, таких як куріння та вживання алкоголю [1–3]. Оцінки ризику ІХС щодо хронічної дози зовнішнього опромінення, як правило, сумісні з даними, повідомленими в інших великих професійних дослідженнях та японських вижилих А-бомб [4].
Мітохондріальна дисфункція відіграє ключову роль у патогенезі ІХС [5]. Високий рівень мітохондріального катаболізму вуглеводів та жирних кислот має вирішальне значення для забезпечення енергією, необхідною для роботи серця [6]. За нормальних умов серце дорослого в основному покладається на жирні кислоти для отримання цієї енергії за допомогою процесу окисного фосфорилювання (OXPHOS), причому лише 10% - 30% загального АТФ отримується з глюкози [7]. Однак нормальне серце може легко перемикатися між жирними кислотами та глюкозою для виробництва АТФ, залежно від потреби в енергії та наявності субстрату [8]. При таких патологічних станах, як ІХС, ця гнучкість втрачається і замінюється перевагою глюкози перед жиром [9] або загальним зниженням окисного метаболізму мітохондрій незалежно від джерела енергії [10]. Обидва сценарії пов'язані зі зниженням рівня активного рецептора, що активується проліфератором пероксисоми (PPAR) альфа в серцевих шлуночках [11]. PPAR альфа функціонує як ключовий регулятор серцевого метаболізму і має важливе значення для окислення жирних кислот [6].
Раніше ми показали, що локальне опромінення серця у мишей постійно зменшує дихальну здатність серцевих мітохондрій [12, 13], зменшує їх кількість і призводить до пошкодження структури крист [14]. Важливо, що активність фактора транскрипції PPAR альфа знижується залежно від дози збільшення фосфорилювання [14].
Хоча моделі мишей широко використовуються для вивчення серцевих захворювань, існують функціональні відмінності між мишачими та людськими серцями [15]. Інфаркт у мишей практично невідомий, мабуть, через їх короткий термін життя та відмінності у фізіології серця та харчуванні. Незважаючи на те, що моделі мишей привели до важливих спостережень щодо причин радіаційно-індукованої ІХС, питання про їх клінічну значимість залишається.
Метою цього дослідження було вивчити, чи сприяють зміни серцевого метаболізму та його ключовий регулятор PPAR альфа радіаційно-індукованому ІГС у людини. Тут ми досліджували профілі протеомів лівого шлуночка людини у працівників компанії «Маяк», які піддавались професійному впливу різних кумулятивних доз зовнішніх гамма-променів. Раніше у всіх учасників був діагностований ІХС, який також був основною причиною смерті [1, 16]. Протеомічний аналіз виявив дозозалежний ряд змін рівнів білків, що беруть участь у функціонуванні та структурі лівого шлуночка. Сюди входять білки, критичні для енергетичного обміну мітохондрій та цитоскелет серця. Значна інактивація PPAR альфа шляхом фосфорилювання спостерігалась у групі найвищих доз (> 500 мГр). Це дослідження вперше надає протеомічну ознаку ішемії серця, спричиненої радіацією. Це узгоджується з спостереженнями, зробленими з використанням опромінених мишей за дозою опромінення.
РЕЗУЛЬТАТИ
Хронічне опромінення змінює протеом серця залежно від дози
Глобальний протеомічний аналіз виявив загалом 1281 білок (додаткова таблиця S1). З кількісно визначених білків 101, 225 та 431 білок суттєво змінились у експресії (2 унікальних пептиди; зміна складок> 1,30 або 500 мГр відповідно. Це вказувало на дозозалежне збільшення кількості дерегульованих білків (Додаткові таблиці S2 – S4 ), як це видно на моделях опроміненого серця миші [14]. Велика кількість (72) дерегульованих білків була розподілена між усіма трьома опроміненими групами порівняно з контролем (таблиця (табл. 1). 1). Більшість із цих загальних білків належали до мітохондрій (24 білки) або цитоскелета (13 білків).
Таблиця 1
Номер приєднання, ідентифікатор білка, повна назва та зміна складки після впливу 500 мГр наведено для кожного білка.
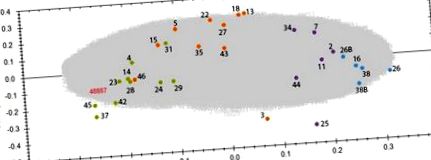
Щоб дослідити відмінності в профілях протеомів між різними групами доз, було проведено PCA на основі всіх особливостей протеоміки. Контрольні та опромінені зразки згруповано у чотири групи відповідно до дози (рис. (Рис. 1). 1). Відстань між кластером, який представляє контрольну групу, і кластерами, що представляють опромінені групи, збільшувалась із збільшенням дози. Незважаючи на те, що працівники, які зазнали дії найвищої дози (> 500 мГр), як правило, були старшими за представників інших груп, PCA не виявляла жодної кластеризації залежно від віку. Подібним чином не спостерігалося кластеризації на основі стану або індексу куріння, споживання алкоголю або індексу маси тіла (Додаткова таблиця S10).
PCA використовував функції із зарядами від +2 до +7, в результаті чого PC1 та PC2 виглядали наступним чином: PC1 23,65% та PC2 8,36%. Контрольні зразки з відповідним номером донора представлені у вигляді синіх плям, зразки піддані впливу 500 мГр зеленим кольором. Зразки № 26 та 38 були виконані як 2 технічні копії та позначені як 26, 26B та 38, 38B. Детальна інформація про донори зразків та точні дози наведені в додатковій таблиці S10. Аналіз проводився за допомогою програмного забезпечення Progenesis QI (http://www.nonlinear.com).
У кожній опроміненій групі було виявлено деякі викиди, а саме донорів 3, 25 та 46 (рис. (Рис. 1). 1). Зразок № 25, що належить до групи 500 мГр) (рис. (Рис. 1 1 та додаткова таблиця S10). Ці відхилення підсилюють докази відношення доза-реакція.
Детальний аналіз функціональних взаємодій та біологічних шляхів був проведений за допомогою IPA (http://www.INGENUITY.com) (Додаткові таблиці S5 та S6). Мітохондріальна дисфункція та порушення обміну речовин були показані у всіх опромінених групах порівняно з контрольною групою (рис. (Рис. 2А). 2А). Дозозалежне зниження виявлено у експресії білків дихальних комплексів I, III та V. Комплекси II та IV зазнавали впливу лише у двох групах із високими дозами (рис. (В2). 2В). Кількість дерегульованих мітохондріальних білків зростала із збільшенням дози опромінення (Рисунок 2C – 2E та Додаткова таблиця S6).
Дозозалежна зміна спостерігається на шляхах, задіяних у виробництві енергії. Оцінки шляху відображаються з використанням фіолетового градієнта кольору, де темніший фіолетовий відповідає вищим балам (підвищена статистична значущість). Оцінка - це від’ємний логарифм р-значення, отриманого в результаті тесту Фішера. За замовчуванням рядки (шляхи) з найбільшим загальним балом у наборі спостережень сортуються до початку (A). Карта тепла для значень експресії диференційовано експресованих білків OXPHOS між групами доз відображається з використанням зеленого градієнта кольору для білків, що регулюються вниз, де темно-зелений колір відповідає великій регуляції вниз. Цифри показують, скільки білків було дерегульовано в кожній субодиниці (B) (http://www.INGENUITY.com). Аналіз білково-білкової взаємодії суттєво диференційовано експресованих білків, що показує мережі дерегульованих білків мітохондрій у групах доз 500 мГр (Е) (http://string-db.org).
Кілька білків, що належать до шляхів вироблення енергії, пов'язаних з окисленням жирних кислот (метаболізм ліпідів, цикл Кребса), були регульовані шляхом опромінення (Рисунок (Малюнок 2A 2A та Додаткова таблиця S6). Також кілька ферментів у шляху гліколізу не регулювались (Додаткове зображення S1 та Додаткове Таблиця S6), яка вказує на загальне виснаження енергоносіїв, а не на перемикання глюкози/ліпідів.
Крім того, кількість дерегульованих білків, що належать до сигналів актинового цитоскелету або кальцію, збільшувалася дозозалежно (Додатковий малюнок S2 та Додаткова таблиця S6). Більшість суттєво змінених білків були пов'язані із захворюваннями серця, включаючи дисфункцію лівого шлуночка та гіпертрофію серця (додатковий малюнок S3 та додаткова таблиця S7).
Імуноблотинг підтверджує індуковану радіацією регуляцію структурних та антиоксидантних білків
Відповідно до даних протеоміки, імуноблотинг показав помітно знижений рівень антиоксидантних захисних білків пероксиредоксину 5 (PRDX 5) та супероксиддисмутази 2 (SOD2) після опромінення (рис. (Рис. 3). 3). Експресія фактора транскрипції Nrf2, центрального регулятора антиоксидантної реакції, була суттєво знижена в групі найвищих доз (рис. (Рис. 3). 3). У групі найвищих доз було виявлено суттєво знижену експресію структурних білків міозинового легкого ланцюга 2 (MYL2), тропоміозину 2 (TPM2) та тропоніну T (TNNT2) (рис. (Рис. 3, 3).
- Можливий сприятливий вплив метформіну на енергетичний обмін та обсяг вісцерального жиру
- 3-разові таблетки для схуднення для схуднення - підвищує енергію та метаболізм Еволюція Харчовий режим
- 10 дивовижних продуктів, що сприяють метаболізму для здоров’я!
- Кожна п'ята смерть у всьому світі пов'язана з неправильним харчуванням
- ЧЕРВОНИЙ ЕНЕРГЕТИЧНИЙ НАПІТ - Анна Левандовська - здоровий план Енн