Доказ концепції вакцини проти ожиріння, спричиненої вірусом; вакцинація проти агента ожиріння аденовірусом 36
Предмети
Анотація
Аденовірус людини 36 (Ad36) позитивно асоціюється з ожирінням у людей та тварин. Інфекція Ad36 характеризується підвищеним ожирінням та запаленням. Щоб дослідити можливість того, що кандидат для профілактичної вакцини може захистити від ожиріння та запалення, спричиненого Ad36, ми очистили Ad36 та опромінений ультрафіолетом вірус, щоб отримати кандидата на вакцину. Після імунізації мишей кандидатом на вакцину (вакцинована група) живий Ad36 вводили мишам в якості випробувального тесту. Невакцинованих мишей (контрольна група) імунізували забуференним фосфатом фізіологічним розчином, а потім заражали живим Ad36. Через чотирнадцять тижнів після зараження ми порівняли ожиріння та запалення у вакцинованих та контрольних мишей. Контрольна група показала на 17% більшу масу тіла та на 20% більше епідидимальних жирів порівняно з вакцинованою групою. Крім того, у вакцинованої групи знизився рівень прозапальних цитокінів у сироватці крові та проникли імунні клітини, особливо макрофаги M1, у жировій тканині. Таким чином, кандидат на вакцину проти Ad36 зміг захистити від збільшеної Ad36 маси тіла та жиру, а також запальних станів після зараження. Ці результати забезпечують доказ концепції профілактичної вакцинації проти ожиріння, спричиненого вірусом.
Вступ
Ожиріння пов'язане з підвищеним ризиком діабету 2 типу, серцево-судинних захворювань, розладів шлунково-кишкового тракту та декількох видів раку. 1 Оскільки ожиріння стало однією з провідних проблем здоров’я в сучасному суспільстві, існує потреба у розробці ефективних стратегій управління вагою. На сьогодні затверджені препарати проти ожиріння мають лише обмежену ефективність, як правило, сприяючи зниженню маси тіла на 5–10% і часто пов’язані з побічними ефектами. Таким чином, існує велика медична потреба у розробці нових препаратів проти ожиріння.
Недавні дослідження показали зв'язок між зараженням людським аденовірусом 36 (Ad36) та підвищеним ожирінням у людей, мишей, курей та мавп. 3, 4, 5 Ad36 інфекція у тварин асоціюється із збільшенням маси тіла, епідидимальних жирів, вісцеральних та пахових жирів. 4,5 Крім того, інфекція Ad36 викликає запалення в жирових тканинах через запальні цитокіни та інфільтровані імунні клітини. 6 Тому для контролю інфекції Ad36 необхідна вакцина проти ожиріння.
У цьому дослідженні ми інактивували очищений Ad36 ультрафіолетовим (УФ) опроміненням. Мишей, яким вводили інактивований вірус, захищали від ожиріння, спричиненого Ad36, та запалення. Таким чином, наші результати забезпечують доказ концепції профілактичної вакцинації проти ожиріння, спричиненого вірусом.
Матеріали і методи
Очищення та інактивація аденовірусу 36
Аденовірус людини 36 (Ad36) був придбаний у American Type Culture Collection (Манассас, штат Вірджинія, США). Клітинна лінія A549 (аденокарциномічні альвеолярні базальні епітеліальні клітини людини) була використана для росту Ad36. Ad36 збирали з надосадової рідини заражених клітин A549, отриманих шляхом заморожування-відтавання тричі. Потім вірус очищали методом CsCl. 7 Очищений вірус інактивували опроміненням, використовуючи УФ-зшивач 115 В змінного струму (2500 мДж/см2; GE Healthcare Life Sciences, Piscataway, NJ, США). 8 Інактивація очищеного ультрафіолетового випромінювання вірусу підтверджена повторним зараженням до клітин A549 (дані не наведені).
Догляд за тваринами
Чотири тижні мишей C57BL/6 були придбані у компанії Orient Bio Inc. (Соннам, Корея). Мишей адаптували до лабораторних умов (18–23 ° C, вологість 55–60%, цикл 12 годин світло/темрява з включеним освітленням на 0700 год). Мишей годували нормальним харчуванням і водою ad libitum. Щотижня у мишей контролювали споживання їжі та води, а також масу тіла. З усіма мишами маніпулювали відповідно до вказівок та норм Корейської асоціації лабораторних тварин. Протокол був схвалений Міжнародним комітетом по догляду за тваринами та використанням, містечко Сунгім, Католицький університет Кореї (# 2012-017).
Вакцинація та виклик
Миші (n= 10) вводили внутрішньочеревно по 5 мкг кандидата на вакцину та повного ад'юванта (співвідношення 1: 1, повний ад’ювант Фрейнда, # F5881; Sigma-Aldrich, Сент-Луїс, Міссурі, США). Через два тижні після першої імунізації мишам знову ввели 5 мкг кандидата на вакцину та неповного ад'юванта (неповний ад'ювант Фрейнда, # F5506; Sigma-Aldrich). Через тиждень після останньої імунізації мишей заражали внутрішньочеревно живим Ad36 (1 × 10 7 одиниць, що утворюють бляшки на мишу) для тесту на зараження. Вага тіла мишей контролювали протягом 14 тижнів після зараження. Контрольна група миші (n= 10) вводили забуференний фосфатом фізіологічний розчин, змішаний з тим же адъювантом, і графіки введення та введення були точно такими ж, як і вакцинованій групі. При цьому як вакциновані, так і контрольні групи отримували однаковий виклик за допомогою живого Ad36. Середня вага 4-тижневих мишей як у вакцинованій, так і в контрольній групах становила 10–12 г, а їх вага становила 14–15 г на початку випробувального тесту. Обидві групи годувались нормальним харчуванням під час імунізації кандидатом на вакцинацію та отримували живий Ad36.
Статистичний аналіз
Усі дані були проаналізовані за допомогою Стьюдента т-тест за допомогою програми SAS 9.1 (SAS Institute Inc., Cary, NC, USA). Дані представлені як середні значення ± е. Багаторазові порівняння аналізували аналізом дисперсійного тесту. Різниця між середніми показниками вважалася статистично значущою при P
Результати
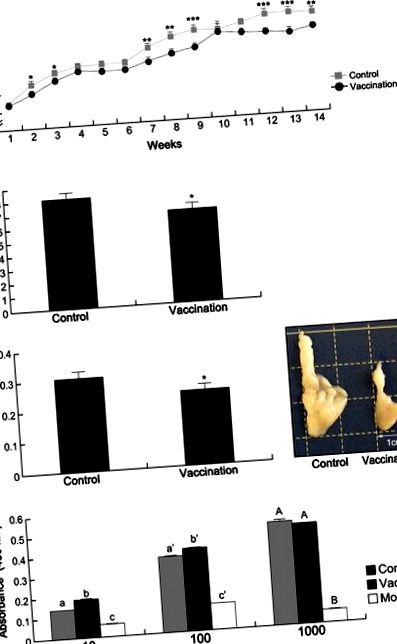
Кандидат на вакцину для Ad36 зменшує збільшення ваги та жиру
Кандидат на вакцину для Ad36 зменшує запалення
Інфекція Ad36 збільшує проникнення в жирові тканини імунних клітин, таких як макрофаги. 6 Імунні клітини інфільтрують жирову тканину і секретують цитокіни, що призводить до посилення запального стану та ожиріння. 6,9,10 У цьому дослідженні ми спостерігали, що кандидат на вакцину захищав мишей від проникнення імунних клітин у епідидимальні жири. Через чотирнадцять тижнів після ін'єкції викликали епідидимальний жир у мишей і фарбували гематоксиліном та еозином. Інфільтровані імунні клітини зменшились у вакцинованій групі порівняно з контрольною групою (рис. 2а). Більше того, нарізані жири також фарбували антитілом F4/80 для підтвердження інфільтрованих макрофагів. Інфільтрація макрофагів також зменшилась у вакцинованій групі порівняно з контрольною групою (рис. 2а).
Раніше повідомлялося, що індуковане Ad36 ожиріння посилює запалення через прозапальні цитокіни, такі як MCP 1 та TNF α. 6 Тут рівні цих двох цитокінів у сироватці крові вимірювали за допомогою імунологічного аналізу через 14 тижнів після зараження. Рівні сироватки MCP 1 у вакцинованій групі знизились у чотири рази порівняно з контрольною групою (рис. 2b; P= 0,0002). Рівень TNF α у вакцинованій групі також був знижений порівняно з контрольною групою (рис. 2b; P= 0,022). Більше того, рівні MCP 1 мРНК в епідидимальних жирах вакцинованої групи була зменшена порівняно з контрольною групою (рис. 2в; P= 0,0003). Однак вираз TNF α мРНК у епідидимальних жирах суттєво не відрізнялася між вакцинованою та контрольною групами (рис. 2в; P= 0,446).
На основі імунної відповіді макрофаги можна розділити на два підтипи: макрофаги M1 (прозапальні макрофаги, CD64) та макрофаги М2 (протизапальні макрофаги, CD206). 6 У цьому дослідженні у вакцинованої групи спостерігалося зменшення макрофагів М1 (P= 0,014) на відміну від макрофагів М2 (рис. 2г). Згідно з цими результатами, кандидат на вакцину зменшив вироблення прозапальних цитокінів у сироватці крові, а також інфільтрацію імунних клітин після живого зараження Ad36.
Обговорення
Ad36 асоціюється з ожирінням людини в США, Кореї та Італії. 3,11,12 На додаток до людей, вірусна інфекція викликає ожиріння у тварин, включаючи курей, мишей, щурів та мавп. 4,5 Більше того, інфекція Ad36 індукує запалення в жировій тканині та підтримує запальний стан за допомогою прозапальних цитокінів. Зрештою, посилене запалення здатне підтримувати ожиріння. Тому необхідно розробити терапевтичні препарати або профілактичні вакцини, які можуть регулювати зараження вірусом.
У цьому дослідженні ми інактивували Ad36 ультрафіолетовим опроміненням для створення кандидата на вакцину Ad36. УФ-опромінення може інактивувати віруси без шкідливого впливу на антигенну структуру та біологічну функцію білків. 13 У попередньому дослідженні також оцінювали Ad36, опромінене ультрафіолетом. 8 Однак зміни маси тіла та жиру не спостерігались через 4 дні після зараження. 8 Насправді, 4 днів недостатньо часу для виявлення змін маси тіла або жиру після зараження Ad36. Таким чином, ми контролювали масу тіла протягом 14 тижнів після прямого зараження Ad-36. Кандидат на вакцину забезпечив захист від збільшення маси тіла та жиру після зараження Ad36 (рисунок 1). Більше того, кандидат на вакцину зменшив індукцію прозапальних цитокінів, а також макрофагів M1 в жировій тканині шляхом зараження Ad36 (рис. 2); таким чином, вказуючи на те, що вакцина полегшує індуковане Ad36 запалення.
Наскільки нам відомо, результати цього дослідження є першим підтвердженням концепції розробки вакцини проти Ad36.
Список літератури
Ревен ГМ. Усі люди, що страждають ожирінням, не є рівними: резистентність до інсуліну є основним фактором, що визначає серцево-судинні захворювання у осіб із надмірною вагою/ожирінням. Diab Vasc Dis Res 2005 рік; 2: 105–112.
Хайнер V. Порівняльна ефективність та безпека фармакологічних підходів до лікування ожиріння. Догляд за діабетом 2011 р .; 34: S349 – S354.
Atkinson RL, Dhurandhar NV, Allison DB, Bowen RL, Israel B, Augustus AS та ін. Аденовірус-36 людини асоціюється із збільшенням маси тіла та парадоксальним зменшенням рівня ліпідів у сироватці крові. Int J Obes (Лондон) 2005 рік; 29: 281–286.
Dhurandhar NV, Ізраїль BA, Kolesar JM, Mayhew GF, Cook ME, Atkinson RL. Підвищене ожиріння у тварин через вірус людини. Int J Obes Relat Metab Disord 2000 р .; 24: 989–996.
Dhurandhar NV, Whigham LD, Abbott DH, Schultz-Darken NJ, Israel Israel, Atkinson RL та ін. Аденовірус людини Ad-36 сприяє збільшенню ваги у самців макак-резусів та бабаків. J Nutr 2002; 132: 3155–3160.
Na HN, Nam JH. Аденовірус 36 як агент ожиріння підтримує стан ожиріння за рахунок збільшення MCP-1 та індукування запалення. J Інфекційний дис 2012 р .; 205: 914–922.
Толлефсон А.Е., Куппусвамі М, Шашкова Є.В., Доронін К, Волд В.С. Підготовка та титрування запасів аденовірусу з діапазоном CsCl. Методи Mol Med 2007; 130: 223–235.
Pasarica M, Loiler S, Dhurandhar NV. Гострий ефект зараження адипогенним аденовірусом людини Ad36. Арка Вірол 2008; 153: 2097–2102.
Lumeng CN, Saltiel AR. Запальні зв’язки між ожирінням та метаболічними захворюваннями. J Clin Invest 2011 р .; 121: 2111–2117.
Sun S, Ji Y, Kersten S, Qi L. Механізми запальних реакцій жирової жирової тканини. Annu Rev Nutr 2012 р .; 32: 261–286.
Na HN, Kim J, Lee HS, Shim KW, Kimm H, Nam JH та ін. Асоціація аденовірусу людини-36 у дорослих корейських людей із зайвою вагою. Int J Obes (Лондон) 2012 р .; 36: 281–285.
Trovato GM, Castro A, Tonzuso A, Garozzo A, Martines GF, Catalano D та ін. Взаємозв’язок ожиріння людини з аденовірусом Ad36 та резистентністю до інсуліну. Int J Obes (Лондон) 2009; 33: 1402–1409.
Равів Y, Viard M, Bess JW, Chertova E, Blumenthal R. Інактивація ретровірусів із збереженням структурної цілісності шляхом націлювання на гідрофобний домен вірусної оболонки. J Вірол 2005 рік; 79: 12394–12400.
Крішнапурам R, Дхурандхар EJ, Дубюйсон О, Кірк-Баллард H, Баджпей S, Батт N та ін. Шаблон для поліпшення глікемічного контролю без зменшення ожиріння або жиру в їжі. Am J Physiol Endocrinol Metab 2011 р .; 300: E779 – E789.
Trovato GM, Martines GF, Trovato FM, Pirri C, Pace P, Garozzo A та ін. Серопозитивність аденовірусу-36 посилює ефекти дієтичного втручання на ожиріння, яскраву печінку та резистентність до інсуліну. Dig Dis Sci 2012 р .; 57: 535–544.
Laing EM, Tripp RA, Pollock NK, Baile CA, Della-Fera MA, Rayalam S та ін. Аденовірус 36, ожиріння та міцність кісток у жінок пізнього підліткового віку. J Bone Miner Res 2013; 28: 489–496.
Дхурандхар Н.В. Інсулінозберігаюча дія аденоїрусу 36 та його E4orf1 білка. J Ускладнення діабету 2013; 27: 191–199.
Чой Ю, Чанг Дж. Вірусні вектори для застосування вакцин. Clin Exp Vaccine Res 2013; 2: 97–105.
Берчілл М.А., Тамбуріні Б.А., Пеннок Н.Д., Уайт Дж.Т., Курче Й.С., Кедль Р.М. Т-клітинна вакцинологія: вивчення відомих невідомих. Вакцина 2013; 31: 297–305.
Lee SG, Jin JY, Kwon BM, Park SW, Paik SY. Інактивація пандемічного вірусу грипу A людини H1N1 2009 року фотокаталізатором під ультрафіолетовим опроміненням. J Bac Virol 2012 р .; 42: 83–85.
Подяки
Ця робота була підтримана грантом GRRC Католицького університету Кореї та Програмою фундаментальних наукових досліджень Національного дослідницького фонду Кореї (NRF), що фінансується Міністерством освіти, науки та технологій (2012R1A1A2039819).
Інформація про автора
Приналежності
Департамент біотехнологій, Католицький університет Кореї, Бучхон, Корея
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
- Спекулятивний страх перед ожирінням та вакциною проти вірусу СОВІТ - ConscienHealth
- Римонабант, моторика шлунково-кишкового тракту та ожиріння Bentham Science
- Патомеханізми розвитку ожиріння в деяких ендокринопатіях; # 8212; огляд Pujanek
- Худий ген може стати зброєю в боротьбі з ожирінням Science The Guardian
- Ожиріння є фактором ризику важкого гострого жовчного та алкогольного панкреатиту - PubMed