Дієтичні добавки арахідоновою кислотою збільшують вміст арахідонової кислоти в лапі, але не впливають на тяжкість артриту або вміст простагландину Е2 у моделі артриту, викликаного ад’ювантом щурів.
Анотація
Передумови
Арахідонова кислота (ARA) - незамінна жирна кислота та головна складова біомембран. Він перетворюється в різні ліпідні медіатори, такі як простагландин Е2 (PGE2), який бере участь у розвитку ревматоїдного артриту (РА). Однак вплив дієтичної АРА на РА незрозумілий. Нашою метою було з'ясувати вплив дієтичної АРА на експериментальну модель артриту щурів.
Методи
Легких щурів годували трьома змістами дієти ARA (0,07%, 0,15% або 0,32% ARA у дієті (мас.)), Дієти докозагексаєнової кислоти (DHA) (0,32% DHA) або контрольної дієти. Через 4 тижні артрит викликався ін’єкцією повного ад’юванта Фрейнда в задню натоптиш. Ми спостерігали розвиток артриту ще протягом 4 тижнів та оцінювали ступінь тяжкості артриту, вміст жирних кислот та ліпідного медіатора в лапі та експресію генів, пов’язаних з утворенням ліпідного медіатора та запальними цитокінами. Також оцінювалось лікування індометацином.
Результати
Вміст ARA у фосфоліпідах у лапі значно підвищувався при дієтичному ARA залежно від дози. Дієтична ARA, а також DHA не впливали на тяжкість артриту (набряк лапи, оцінка артриту та ерозія кісток). Вміст PGE2 в лапі збільшувався внаслідок індукції артриту, але не змінювався дієтичним ARA. Дієтична ARA не впливала на вміст інших ліпідних медіаторів та експресію генів циклооксигенази (ЦОГ) -1, ЦОГ-2, ліпоксгеназ та запальних цитокінів. Індометацин пригнічував тяжкість артриту та вміст PGE2 в лапі.
Висновок
Ці результати свідчать про те, що дієтична ARA збільшує вміст ARA в лапі, але не впливає на тяжкість артриту та вміст PGE2 в лапі на моделі артриту щурів.
Вступ
Поліненасичені жирні кислоти (ПНЖК), такі як арахідонова кислота (ARA) та докозагексаєнова кислота (DHA), є природними поживними речовинами, присутніми в звичайних продуктах харчування (наприклад, яєчному жовтку, м'ясі та риб'ячому жирі) і є фізіологічно важливими складовими біомембран. ARA є жирною кислотою n-6 і перетворюється з лінолевої кислоти (LA) in vivo. ARA також виступає субстратом для різних медіаторів ліпідів, таких як простагландини (PG), лейкотрієни, ліпоксини (LX), ендоканабіноїди та епоксиеікозатетраноати [1–3]. Недавні дослідження продемонстрували, що здатність перетворення з LA в ARA знижується зі старінням [4], а дієтичні добавки ARA покращують когнітивну реакцію [5, 6] та серцево-судинну функцію [7, 8] у людей похилого віку та вікових щурів.
З'ясовано, що дієтична ARA впливає на вміст ARA у фосфоліпідах у людей та тварин [9–14]. Дослідження ex vivo з використанням клітин, приготованих від тварин, у яких маніпулювали споживанням жирних кислот, показало, що різні дієти впливали на вироблення ПГ та лейкотрієнів [15–18]. Ми повідомляли, що добавки ARA у здорових японських людей похилого віку підвищували ARA плазми, але не збільшували похідні ARA ліпідні медіатори або клінічні параметри, включаючи параметри запалення, такі як С-реактивний білок, інтерлейкін-6 (IL-6) та фактор некрозу пухлини - α (TNF-α) [12]. Нещодавно ми вивчали вплив дієтичної ARA на гостре запалення і повідомляли, що дієтична ARA збільшує вміст ARA та LXA4 в товстій кишці, але не впливає на тяжкість запалення або вміст PGE2 на моделі мишачого коліту [14].
Ревматоїдний артрит (РА) є одним з основних аутоімунних захворювань і пов’язаний із хронічним запаленням суглобів та кісток. Біологічні протиревматичні препарати, що модифікують захворювання, часто рекомендуються для терапії РА, що вказує на те, що запальні цитокіни є важливими молекулами в патології РА [19–21]. Нестероїдні протизапальні препарати (НПЗЗ) та інгібітори циклооксигенази (ЦОГ) вже не є препаратами першої лінії для РА, але до появи біологічної терапії ці засоби широко використовувались для РА, оскільки ліпідні медіатори, що виробляються з АРА за допомогою ЦОГ, такі як PGE2, беруть участь у розвитку РА [22, 23]. Отже, метаболізм ARA все ще важливий при лікуванні РА, але вплив дієтичного ARA на хронічне запалення, таке як РА, до кінця не вивчений.
У цьому дослідженні, щоб з’ясувати вплив дієтичної АРА на хронічне запалення та статус PGE2, ми оцінили ефекти АРА у різних дозах на тяжкість моделі ад'ювантного артриту (АІА) у щурів та визначили вміст АРА і ліпідні медіатори, отримані з ARA, і експресія генів, що відносяться до цих ліпідних медіаторів та запальних цитокінів.
Матеріали і методи
Тварини, дієти та експериментальний дизайн
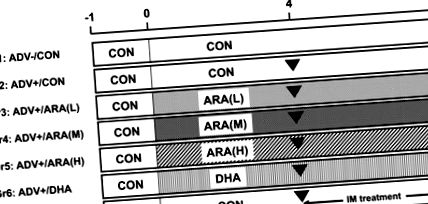
Експерименти були схвалені Комітетом з догляду за тваринами та використання Suntory Holdings Ltd. (Осака, Японія), і ми дотримувались Рекомендацій з догляду за тваринами та використання Suntory Holdings Ltd. Сімдесят 4-тижневих самців щурів Lew було отримано з річки Чарльз Японія (Йокогама, Японія). Щурів утримували в стандартних умовах і мали вільний доступ до води та дієти.
Індукція та оцінка AIA
Експериментальна процедура для моделі артриту, викликаного ад’ювантом щурів, у цьому дослідженні.
Аналіз жирних кислот
Ліпіди у дієтах, лапах та плазмі витягували та очищали методом Folch et al. [26]. Ліпіди в лапі та плазмі поділяли на фосфоліпіди (PL) та інші ліпідні фракції методом тонкошарової хроматографії з використанням силікагелю 60 (Merck, Дармштадт, Німеччина). Система розчинників складалася з гексану/діетилового ефіру (7/3, об./Об.). Залишки жирних кислот в екстрагованих ліпідах або відокремлених фосфоліпідах аналізували методом Sakuradani et al. [27]. Коротко кажучи, кожну ліпідну фракцію інкубували з внутрішнім стандартом (пентадекановою кислотою) у метанольній HCl при 50 ° C протягом 3 год, щоб трансметилювати залишки жирних кислот у метилові ефіри жирних кислот, які екстрагували n-гексану та аналізують за допомогою капілярної газорідинної хроматографії.
Аналіз ліпідних медіаторів гомогенатів натоптишів
Кількісна ланцюгова реакція полімерази в режимі реального часу (QRT-PCR)
Статистичний аналіз
Дані представлені як середні значення ± SD. Дані аналізували неспареним двостороннім t-тестом або одностороннім дисперсійним аналізом з подальшим множинним порівнянням Даннета або Сталі. Кореляційний аналіз проводили за допомогою кореляційного тесту Спірмена. P
Результати
Вміст жирної кислоти задньої лапи та плазми
Вплив дієтичної АРА на симптоми АІА
Оцінка кісткової ерозії суглоба контралатеральних задніх лап щурів, викликаних ад’ювантом артриту. В кінці експериментів колінний і гомілковостопний суглоби контралатеральної лапи фіксували 10% нейтральним буферизованим формаліном, а рентгенологічні показники визначали, як описано в Матеріали та методи. Дані є середніми ± SD (n = 10 на групу).
Ліпідний медіатор та експресія генів
Індукція артриту суттєво збільшила вміст PGE2 в лапі (група ADV +/CON, 15,0 ± 17,5 пг/мг вологої маси тканини; і група ADV-/CON; 1,8 ± 2,5 пг/мг вологої маси тканини) (рис. 6а). Вміст PGE2 в лапах у групах, які годували ARA або DHA, не відрізнявся від вмісту в групі ADV +/CON. Лікування індометацином суттєво пригнічувало вміст PGE2 в лапі. Вміст LXA4 (група ADV +/CON; 0,13 ± 0,1 пг/мг вологої маси тканини; та група ADV-/CON, 0,05 ± 0,1 пг/мг вологої маси тканини) та LTB4 (група ADV +/CON; 0,81 ± 0,46 пг/мг вологої маси тканини; а група ADV-/CON 0,24 ± 0,16 пг/мг вологої маси тканини), здавалося, зростала з індукцією артриту, але не суттєво (рис. 6b та c). Ефектів дієти та індометацину у вмісті LXA4 та LTB4 не спостерігалося. Щоб з’ясувати взаємозв’язок між вмістом ARA та вмістом PGE2 в лапі та об’ємі лапи, ми проаналізували кореляцію цих параметрів у групах, які отримували ад’ювант та ARA (групи 2–5). Як показано на малюнку 7, ми не виявили кореляції іпсиратерального об'єму лапи або вмісту лапи PGE2 із вмістом ARA в лапі (рис. 7а та b), вмісту PGE2 в лапі з іпсиратеральним об'ємом лапи (рис. 7в).
Кореляційний аналіз. Виконано кореляційний аналіз між вмістом ARA в іпсилатеральній задній лапі та набряку лапи (маркер захворювання) (а), Вміст PGE2 (b), та між набряком лапи та вмістом PGE2 (c). ●; ADV +/CON, △; ADV +/ARA (L), ◇; ADV +/ARA (M), ☐; ADV +/ARA (H).
Ми проаналізували експресію генів, пов’язаних з утворенням ліпідних медіаторів, таких як cPLA2, COX-1, COX-2, 5-LOX та 12/15-LOX (Додатковий файл 5: Рисунок S4 a-e). Тільки експресія COX-1 у групі ADV-/CON була значно нижчою, ніж у групі ADV +/CON, але жодна інша експресія генів не відрізнялася між групами ADV-/ADV +/CON. Дієта ARA або DHA не впливала на експресію цих генів. Лікування індометацином збільшувало лише експресію гена ALOX5. Крім того, для визначення впливу дієт на вироблення цитокінів, пов’язаних із запаленням, ми також проаналізували експресію генів IL-1beta, IL-6, TNF-α та IL-10. Не було відмінностей між цими групами в цих генах (додатковий файл 6: Рисунок S5 a-d).
Обговорення
У цьому дослідженні дієтичні добавки ARA суттєво збільшували вміст ARA у запаленій лапі залежно від дози, але не впливали на тяжкість та вміст ліпідних медіаторів у моделі AIA на щурах. Це перше дослідження, яке продемонструвало вплив дієтичної АРА на АІА у щурів.
Інший ліпідний медіатор, отриманий з ARA, LXA4, продукується 15- та 5-ліпоксигеназами і, як з’ясовано, має протизапальну роль [37]. На моделі артриту на тваринах миші з дефіцитом 12/15-ліпоксигенази проявляли посилений запальний ефект та знижували рівень LXA4 [38], а агоніст рецепторів ліпоксину міг модулювати імунну відповідь та зменшити тяжкість мишачого артриту [39]. У цьому дослідженні вміст LXA4 у групах ARA був дещо вищим порівняно з контрольною групою, але не було знайдено значущих відмінностей або залежності від дози (рис. 6), хоча дієтична ARA збільшувала вміст LXA4 у товстій кишці у нашому попередньому дослідженні модель мишачого коліту [14]. Ці результати дозволяють припустити, що вплив дієтичного ARA на продукцію LXA4 відрізняється залежно від моделі запалення. Показано, що LTB4, один з основних лейкотрієнів, виробляється в суглобах хворих на РА [40, 41]. У цьому дослідженні вміст LTB4 в лапі, як правило, збільшувався внаслідок індукції артриту, і на нього не впливала дієтична ARA. Ці результати подібні до результатів для моделі коліту [14] і свідчать про те, що дієтична АРА мало впливає на вироблення LTB4.
Експресія генів COX-1 і COX-2 пов'язана з синтезом PGE2, така як 15-LOX і 5-LOX пов'язана з синтезом LXA4 і LTB4, а експресія cPLA2 пов'язана з усіма цими медіаторами через вивільнення ARA з мембрани фосфоліпіди. Експресія генів цих медіаторів була незмінною за допомогою дієтичного ARA (додатковий файл 5: Рисунок S4). Це узгоджується з результатами, які показують, що вміст PGE2, LXA4 та LTB4 не змінювався під час дієтичного ARA (рисунок 6). Однак, оскільки ми не могли спостерігати збільшення експресії генів за допомогою індукції артриту, за винятком ЦОГ-1, ми не можемо зробити твердий висновок про його вплив на експресію генів. Подальші дослідження, наприклад експеримент з часовим курсом [42, 43], необхідні для визначення впливу дієтичного ARA на експресію генів, пов’язану з ліпідними медіаторами. Ці результати подібні до випадку експресії генів запальних цитокінів. У цьому дослідженні дієтична ARA не впливала на експресію генів цих цитокінів in vivo (додатковий файл 6: Малюнок S5). Однак ми не змогли спостерігати збільшення експресії генів за допомогою індукції артриту, і необхідні подальші дослідження для визначення впливу дієтичного ARA на експресію генів запальних цитокінів.
У цьому дослідженні ми показали кількість ліпідних медіаторів в лапах, але їхній внесок у стан захворювання не підтверджений повністю. Хоча відомо, що PGE2, LXA4 та LTB4 є важливими, як описано вище, залишається незрозумілим, чи достатньо їх вмісту в цьому експерименті, щоб показати фізіологічну/патологічну активність чи ні. Це може бути виявлено шляхом місцевого введення PGE2, LXA4 та LTB4 або конкретних антагоністів, наприклад. Кількість перекисів ліпідів, утворення вільних радикалів та вміст антиоксидантів у тканинах та клітинах можуть допомогти прояснити. Крім того, добре відомо, що медіатори ліпідів можуть впливати на кількість TGF-β бета [44]. Очікується також, що цитокіновий профіль буде з’ясований в результаті подальших досліджень.
Як повідомлялося, DHA, EPA або риб’ячий жир були ефективними проти артриту як у тваринах, так і в клінічних дослідженнях [31–34, 45], тоді як деякі дослідження не показали жодної користі [32, 46]. У цьому дослідженні введення DHA значно підвищувало вміст DHA та EPA в лапі, але не впливало ні на запальні параметри, ні на кількість PGE2, LXA4 та LTB4. Однією з причин може бути те, що експериментальні дієти в цьому дослідженні були розроблені з однаковим співвідношенням n-6/n-3, і тому співвідношення n-6/n-3 було майже однаковим у контролі (2.0) та Дієта DHA (2.2). Співвідношення n-6/n-3 у попередніх дослідженнях здається різним між контролем та групами DHA, EPA або риб'ячого жиру або неясними [31–34], і це може спричинити різницю в ефективності DHA.
Наскільки нам відомо, в 1997 р. Є одне дослідження щодо впливу ARA на AIA у щурів з дефіцитом незамінних жирних кислот (EFAD). Добавки ARA можуть збільшити вміст ARA у EFAD та відновити пригнічену запальну реакцію у щурів EFAD порівняно з нормальними щурами [47]. Це був ранній і важливий звіт, але він не обов'язково відображає ситуацію із загальним артритом. Профіль жирних кислот у EFAD є досить ненормальним, тобто ARA та LA надзвичайно знижені. Крім того, кислота Мід, яка, як було з’ясовано, має протизапальні властивості [48–50], була ендогенно синтезована замість ARA в EFAD і була зменшена при введенні ARA [47]. Також повідомляється, що кислота Мід виявляється в суглобовому хрящі новонароджених тварин, що припускає, що кислота Мід може мати невідому роль у розвитку хряща [51]. Тому важко оцінити вплив ARA на AIA з попереднього звіту за умови EFAD.
Дієтичне споживання ARA для груп ARA (L), ARA (M) та ARA (H), за оцінками, становило приблизно 35, 73 та 156 мг/кг/день відповідно, припускаючи, що щури споживали дієту приблизно 10 % від ваги їх тіла щодня. У людей середнє споживання ARA з щоденних продуктів становить приблизно 150–200 мг ARA на день [52]. Порівняно із споживанням ARA людьми, дози ARA, використані у цьому дослідженні, помітно вищі. Таким чином, результати цього дослідження можуть розглядатися як результати надлишкового введення ARA.
Висновок
Дієтичні добавки ARA значно збільшували вміст ARA у запаленій лапі дозозалежним чином, але не впливали на показники запалення артриту або вміст ліпідних медіаторів у моделі AIA на щурах.
- Сирий дієтичний лецитин збільшує системну доступність дієтичної докозагексаєнової кислоти з
- Дієтична недостатність фолієвої кислоти та добавки фолієвої кислоти погіршують метаболізм і
- Вплив дієтичних добавок із ізофлавонами із червоної конюшини на амбулаторний артеріальний тиск
- Ефективність дієтичних добавок тригліцеридної олії середнього ланцюга для зменшення частоти судом у
- Оцінка режимів змішаного годування з різним вмістом білка в харчуванні за ростом