Дієта з високим вмістом жиру індукує утворення спонтанної ліпосаркоми в жировій тканині миші з надмірною експресією інтерлейкіну 22
Чжен Ван
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Лінг Ян
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Юхуй Цзян
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Чжи-Цян Лін
2 Науково-дослідний інститут раку Чжецзян, Онкологічна лікарня провінції Чжецзян, Центр раку Чжецзян, Ханчжоу, Китай,
Чжиган Лі
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Юань Ченг
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Хен Хуан
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Лінгді Ван
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
І Пан
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Чженьчжен Ван
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Сяоцян Янь
3 корпорація Generon, Парк високих технологій Чжан Цзян, Шанхай, Китай,
Ян Чень
1 Ключова лабораторія харчування та обміну речовин, Інститут харчових наук, Шанхайський інститут біологічних наук, Китайська академія наук, Вища школа Китайської академії наук, Шанхай, Китай,
Задумав і спроектував експерименти: Ю. Чень. Виконував експерименти: Чжен Ван LY YJ ZL Y. Cheng HH LW. Проаналізовано дані: Z-QL YP Zhenzhen Wang Y. Chen. Внесені реагенти/матеріали/інструменти аналізу: XY. Написав папір: Чжен Ван Ю. Чень.
Анотація
Інтерлейкін 22 (IL-22) - це секретується Т-клітинами цитокін, який модулює запальну реакцію в негемопоетичних тканинах, таких як епітелій та печінка. Функція IL-22 в жировій тканині в даний час невідома. Ми створили трансгенну модель миші з надмірною експресією IL-22, особливо в жировій тканині. Трансгенні миші IL-22 не мали явних змін ожиріння та резистентності до інсуліну після годування з дієтою з високим вмістом жиру (HFD). Несподівано у всіх трансгенних мишей IL-22, яких годували HFD протягом чотирьох місяців, у жировій тканині епідидиму виникали спонтанні пухлини. Гістологічний аналіз показав, що пухлини являли собою добре диференційовані ліпосаркоми з інфільтрацією запальних клітин. Надмірна експресія IL-22 сприяє виробленню запальних цитокінів, таких як IL-1β та IL-10, та стимулює фосфорилювання ERK в жировій тканині. Крім того, лікування IL-22 у диференційованих адипоцитах 3T3-L1 може індукувати експресію IL-1β та IL-10, разом із стимуляцією фосфорилювання ERK. У сукупності наше дослідження не тільки встановило нову модель миші зі спонтанною ліпосаркомою, але також показало, що надмірна експресія IL-22 може співпрацювати з ожирінням, спричиненим дієтою, щоб впливати на розвиток пухлини у мишей.
Вступ
На додаток до своєї основної ролі в модуляції запалення, IL-22 сприяє росту пухлинних клітин та апоптозу. Повідомлялося, що IL-22 може сприяти росту та виживанню клітин у клітинах HepG2, активуючи STAT3 та індукуючи експресію різноманітних антиапоптотичних та мітогенних білків [11]. У недрібноклітинної карциноми легенів (НМРЛ) надмірна експресія IL-22 захищала клітинні лінії раку легенів від апоптозу, тоді як зниження регуляції IL-22 суттєво пригнічувало ріст клітин пухлинних клітин людини у голих мишей BALB/c [13]. На відміну від цього, в клітинах раку молочної залози було виявлено, що IL-22 ефективно зменшує ріст пухлинних клітин, що корелює з пригніченням фосфорилювання ERK та AKT та індукцією зупинки клітинного циклу [14]. Отже, вплив IL-22 на розвиток раку, як видається, залежить від клітинного контексту.
Нещодавно наша група виявила, що IL-22 відіграє захисну роль в індукованому стетозом печінки з високим вмістом жирів шляхом регулювання зниження експресії пов'язаних з ліпогенезом генів, включаючи критичні фактори транскрипції та ферменти для синтезу ліпідів [15]. У цьому дослідженні ми додатково досліджували потенційну функцію IL-22 на жировій тканині шляхом генерації трансгенної моделі миші із специфічною для жиру експресією IL-22. Цікаво, що миші з надмірною експресією IL-22 в жировій тканині не мали ні явного фенотипу, ні метаболічних змін, коли їх годували дієтою з високим вмістом жиру. Однак у трансгенних мишей IL-22 спонтанно виникали ліпосаркоми в жировій тканині після тривалого годування з дієтою з високим вмістом жиру, що вказує на те, що дієта може взаємодіяти із змінами запалення, пов'язаними з надмірною експресією IL-22 в пухлинній тканині в жировій тканині.
Матеріали і методи
Покоління трансгенної миші IL-22
Усі тварини утримувались і використовувались відповідно до вказівок Інституційного комітету з догляду за тваринами та використання Інституту харчових наук Китайської академії наук (CAS) із безкоштовним доступом до звичайної чау-миші та водопровідної води. Усі експериментальні процедури проводились відповідно до Комісії з етики CAS з номером затвердження 2010-AN-8. Повна довжина кДНК IL-22 миші посилювалась за допомогою RT-PCR з кДНК тимусу миші. Після підтвердження шляхом секвенування ДНК мишачу кДНК клонували у вектор pBS-aP2-sv40pA (від Addgene, Cambridge, MA, USA). Для генерування трансгенних мишей трансгенну касету вирізали з плазміди та використовували для мікроін'єкції в пронуклеї запліднених ооцитів штаму ICR мишей. Трансгенних мишей генотипували методом ПЛР з геномною ДНК з праймерами 5′-AAACATACAGGGTCTGGTCAT-3 ′ та 5′-GCATAAAGGTGCGGTTGA -3 ′. Усі миші, що використовувались у цьому дослідженні, мали рівень ICR.
Екстракція геномної ДНК, виділення РНК, зворотна транскрипція та ПЛР (RT-PCR) та кількісна RT-PCR у реальному часі (qRT-PCR)
Аналіз прийому їжі, тест на толерантність до глюкози (GTT) та тест на толерантність до інсуліну (ITT)
Самців диких типів і трансгенних мишей-самців 1 місяця годували або звичайною чау (SLACOM, Шанхай, Китай), або дієтою з високим вмістом жиру (що містить 60% калорій від жиру, від Research Diets Inc., Нью-Брансвік, Нью-Джерсі, США). Прийом їжі реєстрували кожні два дні. Для GTT та ITT миші голодували протягом ночі, а потім внутрішньочеревно вводили глюкозу (1 г/кг маси тіла, для GTT) або інсуліну (1 U/кг маси тіла, для ITT) відповідно. Рівні глюкози в крові в різний час після ін’єкції визначали за допомогою електронного глюкометра (Freestyle Freedom, Abbott Diabetes Care, Alameda, CA, USA).
Фарбування гематоксилін-еозином та імуногістохімія
Свіжа біла жирова тканина епідидимуму (eWAT) та пухлини фіксували у 10% -ному сольовому розчині, забуференному формаліном/фосфатом, а потім вносили у парафін. Зрізи піддавали стандартному фарбуванню гематоксилін-еозином (ВІН) та імуногістохімії, як описано раніше [16].
Культура клітин 3T3-L1, диференціація, лікування IL-22 та імуноблотинг
Клітини фібробластів миші 3T3-L1 були отримані від Банку/Банку стовбурових клітин Шанхайського інституту біологічних наук Китайської академії наук. Клітини вирощували під 5% СО2 у стандартному середовищі, що містить модифіковане середовище орлів Дульбекко (GIBCO, Карлсбад, Каліфорнія, США), 10% фетальної бичачої сироватки (FBS) та 0,1% суміші пеніцилін-стрептоміцин (GIBCO). Для диференціації адипоцитів клітинам 3T3-L1 було дозволено досягти місця злиття, і через два дні після злиття (день 0) клітини спонукали диференціюватись при середовищі 10% СО2 із середовищем, що містить 10% плодової бичачої сироватки, 10 мкг/мл інсуліну, 1 мкМ дексаметазону та 0,5 мМ IBMX протягом 2 днів. Після цього додавали середовище після диференціації, що містить лише інсулін і 10% FBS, і клітини культивували ще 2 дні. Відтоді поживне середовище поповнювалось кожні 2 дні стандартним середовищем. Повністю диференційовані клітини 3T3-L1 обробляли протягом 48 годин 500 нг/мл рекомбінантного IL-22, як описано раніше [15]. Потім оброблені IL-22 клітини використовували для RT-PCR та імуноблотингу, як описано раніше [15]. Антитіло до фосфо-ERK1/2 було придбано у компанії Cell Signaling Technology (Danvers, MA, США). Загальне антитіло до ERK1/2 було від компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія, США). Антитіло до тубуліну було від Sigma-Aldrich (Сент-Луїс, Міссурі, США).
Вимірювання концентрації IL-22 у сироватці крові
Концентрацію білка в сироватці миші IL-22 вимірювали за допомогою набору ELISA від eBioscience (Сан-Дієго, Каліфорнія, США) відповідно до вказівок виробника.
Статистичний аналіз
Всі дані були проаналізовані неспареним двостороннім t-критерієм Стьюдента і виражені як середнє значення ± стандартне відхилення.
Результати
Генерація та характеристика трансгенних мишей з експресією IL-22 в жировій тканині
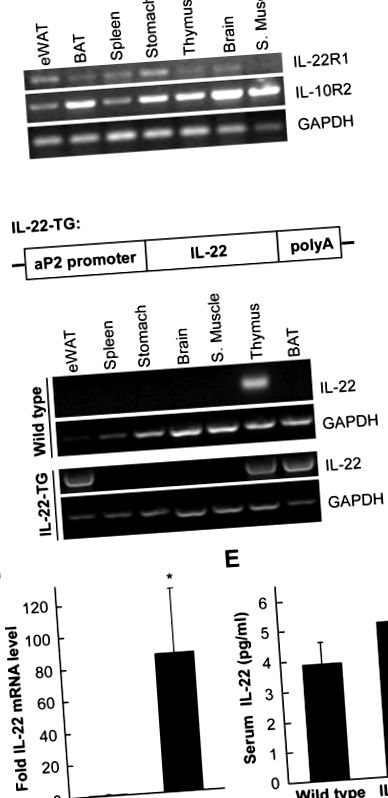
Наше попереднє дослідження показало, що IL-22 впливає на ліпогенез у печінці [15]. Тому ми припустили, що IL-22 може мати функцію в жировій тканині. IL-22 здійснює свій ефект, взаємодіючи з двома мембранними рецепторами, специфічним рецептором IL-22R1 та загальним компонентом IL-10R2 [17]. Ми проаналізували, чи жирові тканини експресують ці два рецептори. Для виділення загальної РНК використовували різні тканини миші з подальшим аналізом за допомогою RT-PCR (Фігура 1А). Ми виявили, що обидва рецептори IL-22 були присутні в багатьох тканинах мишей, включаючи епідидимальну білу жирову тканину (eWAT) і коричневу жирову тканину (BAT), що вказує на те, що IL-22 може відігравати функціональну роль у цих тканинах.
(A) Рецептори IL-22 присутні в жировій тканині. Різні тканини були виділені від мишей ICR і використані в RT-PCR для виявлення рівнів експресії IL-22R1 та IL-10R2. В якості контролю завантаження використовували GAPDH. eWAT означає епідидимальний білий жир, а BAT - коричневий жир. (B) Діаграма для зображення трансгенної конструкції. КДНК миші IL-22 миші повної довжини клонували за промотором aP2. (C) Аналіз рівнів мРНК IL-22 у мишей дикого типу та трансгенних IL-22 (IL-22-TG). У РТ-ПЛР використовували різні тканини мишей для виявлення рівня мРНК IL-22. Зауважимо, що порівняно з контролем дикого типу, експресія IL-22 помітно зросла у eWAT та BAT у мишей IL-22-TG. (D) Аналіз рівня IL-22 мишей eWAT за допомогою кількісної RT-PCR в режимі реального часу (qRT-PCR). Відносний рівень експресії IL-22 порівняно з β-актином був показаний як середнє значення ± SD (n = 7 для кожної групи). * вказує на p Малюнок 1B). Трансгенну касету мікроін’єктували у пронуклеуси запліднених яєць ICR миші для отримання трансгенних мишей IL-22 (IL-22-TG). Потім мишей IL-22-TG схрещували з мишами ICR для отримання потомства, яке використовувалось у дослідженні. У мишей дикого типу мРНК IL-22 в основному була в тимусі (рис. 1С). Однак у мишей IL-22-TG IL-22 був високоекспресований у eWAT та BAT (рис. 1C), що підтверджує успішну надмірну експресію IL-22 у жировій тканині під промотором aP2 у трансгенних мишей. Далі ми проаналізували експресію IL-22 в eWAT за допомогою кількісного методу RT-PCR в реальному часі. Ми виявили, що рівень мРНК IL-22 у мишей IL-22-TG був помітно підвищений у порівнянні з тваринами дикого типу (малюнок 1D). Однак рівень білка IL-22 у крові, судячи з усього, не зазнав значного впливу надмірної експресії IL-22 в жировій тканині.
Надмірна експресія IL-22 у жировій тканині не має очевидного впливу на метаболізм
(Від A до C) Маса тіла, споживання їжі та вага білого жиру (eWAT) дикого типу та мишей дикого типу та IL-22-TG, яких годували або нормальним чау (NC), або дієтою з високим вмістом жиру (HFD) протягом 4 місяців (n = 7 і 8 для двох груп відповідно). (D, E) Тест на толерантність до глюкози (D) та тест на толерантність до інсуліну (E) проводили на мишах дикого типу та IL-22-TG після годування HFD протягом 4 місяців (n = 7 та 8 для обох груп відповідно).
Дієта з високим вмістом жиру індукувала утворення мимовільних ліпосарком у мишей IL-22-TG
Несподівано ми виявили, що тривале годування HFD могло спричинити утворення спонтанних пухлин у жировій тканині. Мишей як дикого типу, так і IL-22-TG годували або нормальним чау, або HFD протягом 4 місяців. Дивно, але у 100% мишей IL-22-TG, які отримували HFD, у жировій тканині епідидиму розвинулись спонтанні пухлини (рис. 3А). Однак, жодна з мишей дикого типу, що годувались HFD або IL-22-TG мишами, які годувались нормальним чау, не мала пухлин в жировій тканині (Фігура 3А). Усі пухлини, що утворились у мишей, знаходились у придатку яєчка, більшість із них мали некроз посередині (рис. 3В). Ми не спостерігали метастазування пухлини в інші органи мишей (дані не наведені).
(А) Короткий зміст випадків спонтанної пухлини в жировій тканині епідидиму у мишей, яких годували нормальним чау (NC) або дієтою з високим вмістом жиру (HFD) протягом різного періоду часу. HFD розпочато у мишей у віці 1 місяця. Зверніть увагу, що спонтанне утворення пухлини у 100% мишей IL-22-TG після годування HFD протягом 4 місяців. (B) Репрезентативні фотографії епідидимісу дикого типу та мишей IL-22-TG. Стрілка вказує на спонтанні пухлини, утворені у мишей IL-22-TG, яких годували HFD протягом 4 місяців.
Гістологічний аналіз з фарбуванням гематоксилін-еозином (ВІН) показав, що жирова тканина, що прилягає до пухлини, була подібною до тканини дикого типу (рис. 4А). Однак форма адипоцитів у мишей IL-22-TG була не такою регулярною, як форма адипоцитів у мишей дикого типу (Фігура 4А). Фарбування ВІН зразками пухлини виявило, що ці пухлини, швидше за все, були ліпосаркомами добре диференційованого типу (рис. 4В). Мікроскопічно пухлина складалася з широких листків і смуг адипоцитів, змішаних з випадковими ліпобластами, розділених волокнистими перегородками, що містять клітини веретена з гіперхроматичними та слабо плеоморфними ядрами. Також були помічені клітини з печаткою, що нагадують нормальну жирову тканину та багатовакулярні ліпобласти. Розмір жирових клітин був різним, і деякі ураження всередині пухлини були просочені невеликою та помірною кількістю хронічних запальних клітин. Також спостерігались великі ядра та незначна атипія клітин. Тому діагноз добре диференційованої «ліпомоподібної» ліпосаркоми був поставлений на основі гістопатологічного вигляду пухлин (рис. 4В).
(А) Фарбування ВІН жирової тканини епідидиму у мишей дикого типу та сусідньої тканини пухлини у миші IL-22-TG. (B) Фарбування ВІЛ зразків ліпосаркоми у мишей IL-22-TG. Зображення на правій панелі - це посилені зображення вставки всередині зображень на лівій панелі (позначені синьою суцільною лінією).
IL-22 сприяє виробленню запальних цитокінів та фосфорилювання ERK в жировій тканині та адипоцитах
Було припущено, що запалення сприяє пухлинному генезу [18], а IL-22 виконує функціональну роль у модулюванні запальної реакції в периферичних тканинах [3], [4]. Ми припустили, що опосередкована IL-22 запальна реакція може, принаймні частково, сприяти розвитку пухлин в жировій тканині. Для вирішення цієї гіпотези ми проаналізували вплив надмірної експресії IL-22 на експресію набору цитокінів, пов’язаних із запаленням, у жировій тканині. Цікаво, що ми виявили, що рівні мРНК IL-1β та IL-10 були значно підвищені внаслідок надмірної експресії IL-22 в жировій тканині (рис. 5А). Рівень мРНК INF-γ суттєво не змінився внаслідок надмірної експресії IL-22 (рис. 5А). Крім того, рівні мРНК TNF-α та IL-6 також були значно підвищені внаслідок надмірної експресії IL-22 (рис. 5А). Ці дані вказують на те, що надмірна експресія IL-22 може викликати експресію підгрупи запальних цитокінів у жировій тканині, що, ймовірно, сприяє розвитку спонтанних ліпосарком у миші під час годування HFD.
Далі ми використовували клітинну модель для подальшого аналізу функції IL-22 на запалення та активацію ERK в адипоцитах. Преадипоцити 3T3-L1 індукувались до зрілих адипоцитів, використовуючи класичний протокол диференціації “коктейль”. Рецептори IL-22 IL-22R1 та IL-10R2 були присутні в диференційованих адипоцитах 3T3-L1 (малюнок 6A), що вказує на те, що ці клітини, ймовірно, реагують на IL-22. Цікаво, що лікування клітин збільшило експресію IL-22R1 (Фігура 6А). Подібно до висновків у жировій тканині миші (Фігура 5А), лікування IL-22 змогло значно підвищити експресію IL-1β та IL-10 у диференційованих адипоцитах 3T3-L1 (Фігура 6B). Однак IL-22 не впливав на експресію INF-γ, TNF-α та IL-6 (рисунок 6B). Крім того, IL-22 може стимулювати фосфорилювання ERK залежно від часу (рис. 6C). У сукупності ці висновки вказують на те, що індукована IL-22 експресія запальних цитокінів та активація ERK можуть сприяти утворенню спонтанних ліпосарком у мишей IL-22-TG, яких годували HFD.
(A) Рецептори IL-22 експресуються в диференційованих клітинах 3T3-L1. Рівні мРНК IL-22R1 та IL-10R2 аналізували за допомогою RT-PCR. В якості контролю завантаження використовували GAPDH. Клітини обробляли рекомбінантним IL-22 (500 нг/мл) протягом 24 годин, як зазначено. (B) Експресія IL-1β та IL-10 підвищувалася при лікуванні IL-22. Диференційовані клітини 3T3-L1 обробляли рекомбінантним IL-22 (500 нг/мл) протягом 24 годин, а загальну РНК виділяли та використовували в кількісному RT-PCR в реальному часі для виявлення рівнів експресії IL-1β, IL-10, INF-γ, TNF-α та IL-6. Дані відображаються як середнє значення ± SD (n = 3 для кожної групи). ** вказує на p Дюмутьє L, Louahed J, Renauld JC. Клонування та характеристика IL-10-пов'язаного Т-клітинного похідного фактора (IL-TIF), нового цитокіна, структурно спорідненого з IL-10 і індукованого IL-9. J Імунол. 2000 р .; 164: 1814–1819. [PubMed] [Google Scholar]
- Дієта з високим вмістом жиру викликає гіперчутливість дихальних шляхів у мишей Наукові звіти
- Дієта та фізичні вправи з високим вмістом жиру призводять до порушення метилому ДНК у печінці миші
- Кетогенна дієта та запалення жирової тканини - проста історія Жировий шанс! Природний обмін речовин
- Поліпшення поляризації жирового макрофага у мишей, що страждають ожирінням, що страждають ожирінням GHSR з високим вмістом жиру
- Довгострокові ефекти високоліпідної та високоенергетичної дієти на сироваткові ліпіди, склад жирних кислот мозку,