Дієта з високим вмістом жиру викликає у мишей гіперреактивність дихальних шляхів
Предмети
Анотація
Експеримент був проведений для вивчення впливу дієти з високим вмістом жиру (HFD) на гіперреактивність дихальних шляхів (AHR) у мишей. Двадцять три дорослих самця мишей C57BL/6 J годували HFD або регулярною дієтою чау протягом двох тижнів. Загальний респіраторний опір вимірювали методом примусових коливань на початковому рівні та після впливу аерозолю метахоліном на рівні 1, 3, 10 та 30 мг/мл. Проведено бронхоальвеолярне промивання (БАЛ). Рівні ліпідів та перекисне окислення ліпідів у легеневій тканині вимірювали разом із експресією генів множинних цитокінів. Легені перетравлювались та визначали секрецію IL-1β легеневими макрофагами. Харчування HFD призвело до збільшення маси тіла на 11% порівняно з чау. HFD не впливав на респіраторну резистентність на початковому рівні, але значно посилив реакцію дихальних шляхів на метахолін порівняно з дієтою чау (збільшення на 40,5 ± 17,7% при 30 мг/мл метахоліну, р
Вступ
Астма є одним з найпоширеніших захворювань, і поширеність астми продовжує зростати, що пояснюється епідеміями ожиріння 1,2,3. Астма при ожирінні, схоже, відрізняється від типової алергічної астми, що викликається TH2, демонструючи погану реакцію на інгаляційні кортикостероїди 4. Можливі механізми включають дихання при менших обсягах легенів, зміну структури дихальних шляхів, посилення окисного стресу в дихальних шляхах та посилення системного запалення 5. Посилення регуляції запалення NLRP3 та IL-1β впливає на астму при ожирінні, спричиненому дієтою з високим вмістом жиру (HFD) 6. HFD є протизапальним через прямий вплив вільних жирних кислот 7. Однак вплив дієти з високим вмістом жиру як такої на гіперреактивність дихальних шляхів (AHR) не досліджували. Ми припускаємо, що дієта з високим вмістом жиру викликає запалення, яке може впливати на AHR незалежно від ожиріння.
Методи
Дослідні тварини
Двадцять три дорослих самців мишей C57BL/6 J віком 10 тижнів (лабораторія Джексона, Бар-Харбор, Массачусетс) годували HFD (TD 03584, Teklad WI, 5,4 ккал/г, 35,2% жиру, 58,4% ккал від жиру, n = 10) або дієта чау (3,0 ккал/г, 4,4% жиру, 13% ккал від жиру, n = 13) протягом 14 днів. Детальна інформація про склад HFD наведена в Додатковій таблиці 1. HFD охолоджували при 4-8 ° C перед тим, як його додавали в клітки. Їжу та воду було забезпечено ad libitum. Мишей утримували у стандартному лабораторному середовищі при температурі 22 ° C у 12-годинному циклі світло/темрява (9:00 - 21:00 включено світло/21:00 - 9:00). Для забезпечення відтворюваності вимірювань мишей розділяли на дві партії (партія 1, HFD, n = 5, дієта чау, n = 6; партія 2, HFD, n = 5, дієта чау, n = 7), які були вивчені через шість місяців з використанням різних партій HFD. Дослідження було схвалено Комітетом з використання та догляду за тваринами університету Джонса Хопкінса (протокол № MO15M257) та відповідало вимогам Американського фізіологічного товариства щодо досліджень на тваринах.
Фізіологічні вимірювання та гістологія
На 14 день мишей знеболювали кетаміном/ксилазином ip, трахеостомізували, а загальний респіраторний опір (Rrs) вимірювали методом примусових коливань (Flexivent) на початковому рівні та після аерозольного впливу метахоліну при 1, 3, 10 і 30 мг/мл, як описано 8,9. Кров відбирали з аорти, проводили бронхоальвеолярний лаваж (BAL) за допомогою 2 × 0,8 мл стерильного сольового розчину, забуференного фосфатом (PBS) через трахеальну канюлю. Грудну клітку відкрили, а праву легеню зв’язали, розібрали вільно і негайно заморозили в рідкому азоті і зберігали при -80 ° C. Залишилася ліва легеня була надута формаліном при тиску 26 смH2O протягом 20 хв, пов'язана і поміщена надута у формалін на 2 дні. Обсяги лівої легені вимірювали водою.
Для гістології ліву легеню зневоднювали в етанолі та вбудовували в парафін. Для морфометрії з поперечних блоків вирізали зрізи товщиною 5 мкм і фарбували трихромом Массона.
Аналіз крові, плазми та тканин легенів
Визначали загальний аналіз крові (CBC). Тригліцериди та вільні жирні кислоти (FFA) вимірювали в гомогенатах легенів та плазмі за допомогою наборів від Wako Inc (Richmond, VA). Інсулін у плазмі та лептин вимірювали за допомогою наборів від Alpco Diagnostics (Salem, NH) та Abcam (Cambridge, MA), відповідно. Рівні глюкози в крові вимірювали за допомогою глюкометра (ACCU-CHECK Aviva Plus, Roche, Indianapolis, IN). Загальну РНК екстрагували з легеневої тканини за допомогою реагенту Trizol (Life Technologies, Rockville, MD). кДНК отримували із загальної РНК з використанням набору Advantage RT для ПЛР від Clontech (Пало-Альто, Каліфорнія). ПЛР у режимі реального часу проводили для панелі цитокінів, включаючи інтерлейкіни (IL) 1β, 4, 5, 6, 10, 13, 17, TNF-α, IL-21, IL-23, адипонектин, лептин, білок вилки коробки вилки (FOXP3), матрична металопептидаза (MMP 9), а також платоподібні рецептори (TLR) -2 і 4 з готовими праймерами від Invitrogen (Карлсбад, Каліфорнія) та зонди Taqman від Applied Biosystems (Фостер Сіті, Каліфорнія) з використанням 18 S як ген ведення домашнього господарства (Додаткова таблиця 2).
Виготовлені на замовлення 18 S праймери були прямими 5′-CTCTTTCGAGGCCCTGTAATTGT-3 ′, зворотними, 5′-AACTGCAGCAACTTTAATATACGCTATT-3 ′ та зондом 6FAM-AGTCCACTTTAAATCCTT. Цільовий рівень мРНК нормалізували до 18 с рРНК, використовуючи формулу: Цільова/18 с = 2 Ct (18 с) –Ct (мішень). Активність ядерного фактора κB (NF- κB) отримували з фосфорильованого до загального білка IκBα за допомогою набору від Abcam. Перекисне окислення ліпідів у легенях вимірювали за рівнем малонового диальдегіду за допомогою набору від Abcam.
Секреція цитокінів та проточна цитометрія
Наявність даних
Усі дані, отримані або проаналізовані під час цього дослідження, включені в цю опубліковану статтю.
Статистичний аналіз
Усі значення подаються як середні значення ± SEM. Всі дані в дослідженні перевіряли на нормальність за допомогою тесту на придатність хі-квадрат. Статистичне порівняння ненормально розподілених значень проводили за допомогою U-критерію Манна-Уітні. Статистичну значимість для нормально розподілених значень визначали за допомогою t-критерію студента або двостороннього аналізу дисперсійного тесту (ANOVA) з корекцією Бонферроні, коли це доречно. Значення р
Результати
Базові характеристики експериментальних тварин описані в таблиці 1. Харчування HFD протягом 2 тижнів призвело до вищої маси тіла на 11%, ніж у мишей, що годувались чау, удвічі збільшили розмір епідидимальних та заочеревинних жирових прокладок. Варто відзначити, що пахові жирові прокладки не збільшувались. Харчування HFD індукувало гіперглікемію та підвищення рівня інсуліну та лептину в плазмі, тоді як тригліцериди у плазмі були незмінними (табл. 1). У CBC не було різниці (Додаткова таблиця 3). Дієта не впливала на обсяги лівих легенів, які становили 0,16 мл ± 0,03 на дієті чау та 0,18 ± 0,03 на СНВ.
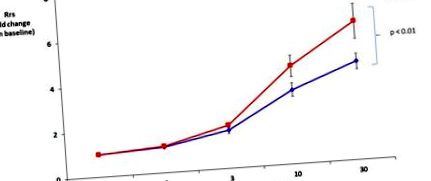
Тестування легеневої функції не виявило різниці в загальному опорі легенів на вихідному рівні між мишами, яких годували чау та HFD (Rrs 0,69 ± 0,04 см H2O * с/мл та 0,63 ± 0,03 см H2O * с/мл, відповідно). HFD значно посилював реакцію дихальних шляхів на метахолін порівняно з дієтою чау (рис. 1).
Дієта з високим вмістом жиру (HFD) збільшила загальний опір дихальної системи (Rrs) у відповідь на метахолін. Значення Rrs були нормалізовані до базового рівня (без суттєвої різниці між групами на вихідному рівні).
Вплив дієти з високим вмістом жиру (HFD) на популяцію лейкоцитів у легенях миші. CD4, CD8 лімфоцити, інтерстиціальні макрофаги, моноцити та альвеолярні макрофаги були ідентифіковані за допомогою проточної цитометрії за протоколом, описаним Мішаріним та ін. (посилання 10) в (A) загальна лейкоцитарна суспензія легенів і (B) популяція прикріплених клітин, як описано в методах.
Обговорення
Наскільки нам відомо, це перше дослідження, яке демонструє, що дієта з високим вмістом жиру викликає гіперреактивність дихальних шляхів (AHR) на ранніх термінах, лише після двох тижнів годування. Ще однією новою знахідкою дослідження є те, що годування HFD індукує експресію IL-1β у легеневій тканині та збільшує секрецію IL-1β у легенях до розвитку значного ожиріння.
Яким може бути потенційний механізм, за допомогою якого харчовий жир індукує IL-1β у легенях? У пацієнтів з астмою дієтична їжа з підвищеним вмістом жиру посилює запалення дихальних шляхів і зменшує реакцію дихальних шляхів на бронходилататори 15. Ендотеліальні клітини легеневих мікросудин відповідають за поглинання тригліцеридів та кліренс тригліцеридів 16. FFA може активувати шлях NF-κB з подальшим регулюванням рівня IL-1β 17. Іншим можливим механізмом може бути активована дієтою з високим вмістом жиру активація запалення NLRP3 за допомогою жирних кислот або кристалів холестерину в легеневих макрофагах, що призводить до утворення IL-1β. Однак ми не виявили збільшення FFA або активації шляху NF-κB. Також відсутність впливу HFD на IL-17, необхідний компонент запалення, може аргументувати цей механізм 6 .
Посилення регуляції IL-1β не є єдиним можливим механізмом реактивності бронхів, спричиненої HFD. HFD викликав 3-кратне збільшення лептину в плазмі. У хворих на астму високий рівень лептину незалежно асоціюється з тяжкістю захворювання 18. На моделі миші лікування лептином індукувало відповідь TH2 та алергічне запалення дихальних шляхів 18. Варто зазначити, що лептин може також підвищувати IL-1β 19,20, що відповідає сучасним висновкам. Нарешті, наші дані свідчать про те, що годування HFD протягом 2 тижнів викликало ранні прояви метаболічного синдрому, включаючи відкладення вісцерального жиру зі збільшеним розміром вісцеральних жирових подушечок (епідидимальної та заочеревинної), але не підшкірних жирових подушечок (пахових), гіперглікемії та гіперінсулінемії (Таблиця 1). Співіснування метаболічного синдрому та астми добре задокументовано в літературі 21. Системне запалення низького ступеня, що спостерігається при метаболічному синдромі, може сприяти розвитку ожиріння астми через IL-1β та іншими шляхами. Крім того, лікування інсулінорезистентності, що є характерним проявом метаболічного синдрому, може мати сприятливий ефект при ожирінні астми 22 .
Обмеження
Основним обмеженням нашого дослідження є те, що роль IL-1β у астмі, індукованої HFD, не підтверджена в механістичних експериментах з використанням мишей, що вибивають IL-1β, або блокаторів рецепторів IL-1β. Однак цей причинно-наслідковий зв'язок раніше був показаний іншими дослідниками на мишах із ожирінням, спричиненим дієтою 6. Потрібні подальші експерименти з використанням блокаторів рецепторів IL-1β.
Висновок та наслідки
Наші дані свідчать про те, що HFD може швидко викликати гіперреактивність дихальних шляхів до розвитку значного ожиріння з ранньою участю IL-1β. Враховуючи, що продукція IL-1β не реагує на стероїди при важкій астмі 23,24, наші дані вказують на те, що обмеження жиру в їжі може бути важливим доповненням до інших видів терапії, що застосовуються при астмі із ожирінням.
Список літератури
Akinbami, L. J. & Fryar, C. D. Сучасна поширеність астми за станом ваги серед дорослих: США, 2001–2014. Короткий опис даних NCHS, 1–8 (2016).
Мосен, Д. М., Шац, М., Магід, Д. Дж. І Камарго, К. А. молодший Взаємозв'язок між ожирінням та тяжкістю астми та контроль у дорослих. Журнал алергії та клінічної імунології 122, 507–511.e506, https://doi.org/10.1016/j.jaci.2008.06.024 (2008).
Тейлор, Б. та ін. Індекс маси тіла та тяжкість астми в Національному обстеженні астми. Грудна клітка 63, 14–20, https://doi.org/10.1136/thx.2007.082784 (2008).
Пітерс-Голден, М. та ін. Вплив індексу маси тіла на реакцію на агенти, що контролюють астму. Європейський респіраторний журнал 27, 495–503, https://doi.org/10.1183/09031936.06.00077205 (2006).
Шор, С. А. та Джонстон, Р. А. Ожиріння та астма. Фармакологія та терапія 110, 83–102, https://doi.org/10.1016/j.pharmthera.2005.10.002 (2006).
Кім, Х. та ін. Вроджені лімфоїдні клітини, що продукують інтерлейкін-17, та запальний процес NLRP3 полегшують гіперреактивність дихальних шляхів, пов’язану з ожирінням. Природна медицина 20, 54–61, https://doi.org/10.1038/nm.3423 (2014).
Kanneganti, T. D. & Dixit, V. D. Імунологічні ускладнення ожиріння. Імунологія природи 13, 707–712, https://doi.org/10.1038/ni.2343 (2012).
Бішай, Дж. М. і Міцнер, В. Вплив сильного обмеження калорій на легені у двох штамів мишей. Американський фізіологічний журнал - Клітинна та молекулярна фізіологія легенів 295, L356 – L362, https://doi.org/10.1152/ajplung.00514.2007 (2008).
Soutiere, S. E. & Mitzner, W. Про визначення загальної ємності легенів у миші. Журнал прикладної фізіології (Bethesda, Md .: 1985) 96, 1658–1664, https://doi.org/10.1152/japplphysiol.01098.2003 (2004).
Мішарін, А. В., Моралес-Небреда, Л., Мутлу, Г. М., Будінгер, Г. Р. С. та Перлман, Х. Проточний цитометричний аналіз макрофагів та дендритних клітинних підмножин у легенях миші. Американський журнал респіраторної клітини та молекулярної біології 49, 503–510, https://doi.org/10.1165/rcmb.2013-0086MA (2013).
Діксон, А. Е. та Пойнтер, М. Е. Механізми астми при ожирінні. Плейотропні аспекти ожиріння породжують виразні фенотипи астми. Американський журнал респіраторної клітини та молекулярної біології 54, 601–608, https://doi.org/10.1165/rcmb.2016-0017PS (2016).
Ansell, T. K., Mitchell, H. W., McFawn, P. K. & Noble, P. B. Експозиція TNF та IL-1β збільшує звуження дихальних шляхів, але не змінює бронходилататорну реакцію на глибоке вдихання в сегментах дихальних шляхів. Респірологія (Carlton, Vic.) 21, 1041–1048, https://doi.org/10.1111/resp.12800 (2016).
Скотт, Х. А., Гібсон, П. Г., Гарг, М. Л. і Вуд, Л. Г. Запалення дихальних шляхів посилюється ожирінням та жирними кислотами при астмі. Європейський респіраторний журнал 38, 594–602, https://doi.org/10.1183/09031936.00139810 (2011).
Теленга, Е. Д. та ін. Ожиріння при астмі: більше нейтрофільного запалення як можливе пояснення зниженої реакції на лікування. Алергія 67, 1060–1068, https://doi.org/10.1111/j.1398-9995.2012.02855.x (2012).
Вуд, Л. Г., Гарг, М. Л. і Гібсон, П. Г. Проблема з високим вмістом жиру збільшує запалення дихальних шляхів і погіршує відновлення бронходилататора при астмі. Журнал алергії та клінічної імунології 127, 1133–1140, https://doi.org/10.1016/j.jaci.2011.01.036 (2011).
Яо, Q. та ін. Вплив хронічної інтермітуючої гіпоксії на поглинання тригліцеридів у різних тканинах. Журнал досліджень ліпідів 54, 1058–1065, https://doi.org/10.1194/jlr.M034272 (2013).
Ян, В. та ін. Голодування в інший день захищає печінку мишей від індукованого запаленням жиру, пов’язаного з придушенням сигналізації Toll-подібного рецептора 4/ядерного фактора kappaB. Дослідження харчування (Нью-Йорк, Нью-Йорк) 36, 586–593, https://doi.org/10.1016/j.nutres.2016.02.001 (2016).
Чжен, Х. та ін. Лептин посилює відповідь TH2 та ILC2 при алергічній хворобі дихальних шляхів. Журнал біологічної хімії 291, 22043–22052, https://doi.org/10.1074/jbc.M116.743187 (2016).
Бойд, К. А. Плацентарний транспорт досліджували за допомогою ізольованих везикул плазматичної мембрани. Праці Товариства з харчування 50, 337–343 (1991).
Luheshi, G. N., Gardner, J. D., Rushforth, D. A., Loudon, A. S. & Rothwell, N. J. Leptin, дії на споживання їжі та температуру тіла опосередковані IL-1. Праці Національної академії наук Сполучених Штатів Америки 96, 7047–7052 (1999).
Баффі, К. В. та ін. Метаболічний синдром і легені. Грудна клітка 149, 1525–1534, https://doi.org/10.1016/j.chest.2015.12.034 (2016).
Carpaij, O. A. & van den Berge, M. Взаємозв'язок астма-ожиріння: основні механізми та наслідки лікування. Сучасна думка в легеневій медицині 24, 42–49, https://doi.org/10.1097/mcp.0000000000000446 (2018).
Хью, М. та ін. Відносна кортикостероїдна нечутливість мононуклеарів периферичної крові при важкій астмі. Американський журнал респіраторної та критичної медицини 174, 134–141, https://doi.org/10.1164/rccm.200512-1930OC (2006).
Кім, Р. Ю. та ін. Роль для NLRP3, опосередкованої запальним шляхом, IL-1бета-залежних відповідей при важкій стероїдостійкій астмі. Американський журнал респіраторної та критичної медицини 196, 283–297, https://doi.org/10.1164/rccm.201609-1830OC (2017).
Подяки
NNH та VYP підтримуються грантом NIEHS P50 ES018176 та Угодами EPA 83615201 & 83451001. VYP також підтримується грантами NHLBI R01 HL128970, HL133100 та HL138932. Ця публікація офіційно не розглядалась EPA. Погляди, висловлені в цьому документі, є виключно поглядами Фріке та його колег і не обов'язково відображають позиції Агентства. EPA не підтримує жодних продуктів чи комерційних послуг, згаданих у цій публікації.
Інформація про автора
Катрін Фріке, Марсела Вієйра та Харіс Юнас однаково внесли свій внесок у цю роботу.
Приналежності
Відділ медицини легеневої та критичної медицини, Медичний факультет, Медичний факультет Університету Джона Гопкінса, Балтимор, США
Катрін Фріке, Марсела Віейра, Харіс Юнас, Мі-Кун Шін, Шеннон Беванс-Фонті, Слава Бергер, Рейчел Лі, Франко Р. Д’Алессіо, Цонг Чжун, Надя Н. Гензель та Всеволод Ю. Полоцький
Департамент охорони навколишнього середовища та інженерії, Школа громадського здоров'я Джона Хопкінса Блумберга, Балтимор, штат Медіка, США
Ендрю Нельсон, Джефф Лубе, Ян Санчес та Уейн Міцнер
Відділ легеневої медицини, кафедра внутрішньої медицини, Ганноверська медична школа, Ганновер, Німеччина
Ви також можете шукати цього автора в PubMed Google Scholar
- Дієта з високим вмістом насичених жирів і низьким вмістом вуглеводів зменшує тривалість життя незалежно від маси тіла мишей
- Дієта з високим вмістом жиру викликає утворення спонтанної ліпосаркоми в жировій тканині миші з
- Механізми порушення функції β-клітин підшлункової залози у мишей, що страждають ожирінням з високим вмістом жиру. Роль
- Дієта з високим вмістом жиру модулює вміст білка в транспортерах поживних речовин у тонкому кишечнику мишей
- Поліпшення поляризації жирового макрофага у мишей, що страждають ожирінням, що страждають ожирінням GHSR з високим вмістом жиру