Дефіцит інсуліну
Дефіцит інсуліну індукує відповіді, подібні до реакцій, спричинених ацидозом, включаючи активацію системи убиквітин-протеасома, залежність від глюкокортикоїдів та подібний характер змін у експресії генів (389, 490, 577).
Пов’язані терміни:
- Резистентність до інсуліну
- Гіперглікемія
- Глюкоза
- Цукровий діабет
- Білок
- Інсулін
- Вивільнення інсуліну
- Інсулінозалежний цукровий діабет
Завантажити у форматі PDF
Про цю сторінку
Інсулін, маса тіла та ріст у молодих хворих на муковісцидоз
Шихаб Хамід, Чарльз Ф. Вердж, Дієта та фізичні вправи при муковісцидозі, 2015
24.6.1 Зміни в метаболізмі білка внаслідок дефіциту інсуліну внаслідок катаболізму
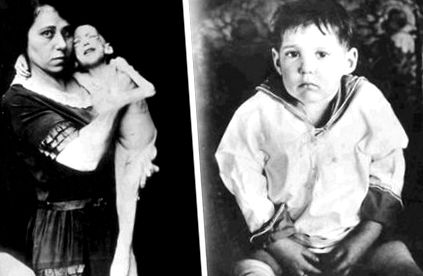
Дефіцит інсуліну призводить до прискореного катаболізму білка, а також до зменшення синтезу білка. Це проявляється як поганий набір ваги та втрата ваги (див. Малюнок 24.3). Виснаження білка також може бути пов'язане зі зниженою здатністю долати інфекції, як це спостерігається у пацієнтів з гіпотрофією білка [88]. Часткова панкреатектомія у тварин (що призводить до дефіциту інсуліну) пов’язана із суттєвим зниженням синтезу м’язового білка після фізичних вправ [89]. Це підвищує ймовірність того, що дефіцит інсуліну може призвести до погіршення набору м’язової маси у суб’єктів МВ після вправ. Сила дихальних м’язів, безумовно, є важливим фактором дихальної функції, що залежить від зусиль.
РИСУНОК 24.3. Висвітлюючи анаболічні ефекти інсуліну, один з перших пацієнтів, який пережив початок діабету 1 типу, продемонстрував різке поліпшення ваги після лікування інсуліном.
Відтворено з дозволу Елі Ліллі та архівів компанії.
Системне запалення призводить до високого рівня циркулюючого ФНП-альфа. Як зазначено у розділі 24.3.1, TNF-альфа може погіршити дію інсуліну. Вважається, що цей ефект опосередковується зменшенням активності тирозинкінази рецептора інсуліну [49]. Таким чином, системні захворювання можуть сприяти катаболізму через дефіцит інсуліну.
Надалі до цих катаболічних ефектів додається втрата глюкози через глікозурію. На кожен грам глюкози, що виділяється із сечею, з організму втрачається 4,1 ккал [90], а глікозурія виникає при перевищенні ниркового порогу реабсорбції глюкози (приблизно 7 ммоль/л, 126 мг/дл).
У сукупності ці висновки викликають значне занепокоєння у хворих на МВ, у яких відзначено хронічно підвищений рівень катаболізму білка [91,92]. Обнадійливо, як показано, лікування інсуліном успішно перевертає катаболізм білка при ХФРД [93] .
Кетоацидоз діабетичний
Жанна М. Розвадовскі, доктор медичних наук, доктор медичних наук Філіп С. Мелер, у “Критичні секрети догляду” (четверте видання), 2007
2 Опишіть патофізіологічні основи ДКА.
Дефіцит інсуліну є центральною точкою розладу і викликає як гіперглікемію, так і кетонемію. У нормальному стані інсулін забезпечує зберігання глюкози у вигляді глікогену в печінці. При дефіциті інсуліну спостерігається як збільшення вироблення глюкози в печінці за рахунок посиленого глікогенолізу та глюконеогенезу, так і зменшення споживання глюкози. Результат - гіперглікемія.
Кетонемія так само обумовлена станом дефіциту інсуліну. За нормальних умов інсулін дозволяє вільним жирним кислотам, як тригліцериди, зберігатися в жировій тканині. В результаті зниження рівня інсуліну та супутньо підвищених рівнів гормонів, що регулюють рівень регуляції глюкози, відбувається надмірне вироблення вільних жирних кислот внаслідок розпаду тригліцеридів. Вільні жирні кислоти перетворюються в кетонові тіла в печінці. Крім того, зменшення споживання кетонів сприяє виникненню кетонемії.
Cateels K, Mathieu C: Діабетичний кетоацидоз. Rev Endocrinol Metab Disord 4: 159–166, 2003.
Мед: Профіль та особливості: Застосування проти діабету
4.1 Роль меду у дефіциті інсуліну та резистентності до інсуліну
Ендокринологія
Дисфункція
Дефіцит інсуліну призводить до гіперглікемії. Наслідки гіперглікемії - це виснаження солі та води через осмотичний діурез, втрата ваги, втома, блювота, гіпотонія, інфекції, гіпервентиляція (внаслідок кетоацидозу) та порушення рівня свідомості та коми. Хронічна гіперглікемія призводить до мікроангіопатії (вражає нирки, нерви та сітківку ока) та макроангіопатії, що викликає периферичні, ішемічні та мозкові судинні захворювання.
Гіпоглікемія (визначається як рівень цукру в крові
Досягнення в галузі досліджень наркотиків
2.2 Ліпіди
При дефіциті інсуліну рівні базальної плазмової кислоти і окислення ліпідів підвищені і не можуть нормально знижуватися (DeFronzo, 1988). Швидкість вироблення жирних кислот збільшується до трьох разів. Це відображає дефіцит інсуліну за наявності нормальної діяльності симпатичної нервової системи та нормального рівня циркулюючих катехоламінів.
При втраті дії інсуліну та надлишку катаболічних гормонів гідроліз тригліцеридів помітно підвищується, надходження гліцерину зростає, а оборот тригліцеридів у плазмі збільшується при одночасному збільшенні кетокислоти, одержуваної в результаті печінкового окислення FFA. Жирні кислоти частково окислюються до кетонових сполук. Синтез кетонів збільшується більш ніж у три рази в стані дефіциту інсуліну в результаті низького співвідношення інсулін/глюкагон та високого надходження жиру в печінку. При низькому рівні інсуліну також значно зменшується поглинання і використання периферичної тканини.
При діабетичному кетоацидозі концентрація кетонів у плазмі крові часто підвищується до 200–300 разів від норми голодування через додаткове порушення ниркової елімінації. Надмірна мобілізація FFA зумовлена посиленим розщепленням тригліцеридів та зниженою швидкістю використання FFA для етерифікації в жировій тканині. Збільшення окислення жирних кислот сприяє печінковому глюконеогенезу.
Існує знижена здатність периферичної тканини приймати тригліцериди при цукровому діабеті з дефіцитом інсуліну або в інсулінорезистентному стані. FFA та кетони пригнічують поглинання та окислення глюкози в м’язах, сприяючи гіперглікемії та, як вперше зазначили Randle et al. (1963), FFA пригнічують окислення пірувату, гліколіз і, можливо, транспорт глюкози. Існує взаємна залежність між метаболізмом глюкози та метаболізмом жирів, відомим як цикл глюкозо-жирних кислот.
Діабетичний кетоацидоз та гіперосмолярний гіперглікемічний стан
Джоел Дж. Шнуре, доктор медичних наук, доктор медицини Джек Л. Ліхі, у статті Critical Care Secrets (п’яте видання), 2013
4 Як DKA викликає метаболічний ацидоз у аніонній щілині?
Дефіцит інсуліну та підвищений вміст глюкагону та катехоламінів спричиняють надмірне вивільнення жирових кислот із жирової тканини та активацію метаболічних шляхів у печінці для перетворення в кетокислоти: ацетоацетат, ацетон та β-гідроксибутират. Їх накопичення призводить до метаболічного ацидозу аніонної щілини, що характерно для ДКА. Аніонний гапіс розраховується шляхом віднімання концентрації основних аніонів (хлориду та бікарбонату) у сироватці крові від основного катіону (натрію). Різниця більше 12 мекв/л разом із зниженим рівнем бікарбонату (
Моделі ендокринної недостатності
Томас К. Варі, в хірургічних дослідженнях, 2001
C. Діазоксид
Гострий дефіцит інсуліну може виникнути у годували щурів з використанням діазоксиду, специфічного інгібітора секреції інсуліну. У цьому протоколі діазоксид (20 мг у 3 мл 0,05 N гідроксиду натрію/100 кг маси тіла) вводять внутрішньочеревно. Концентрація інсуліну в плазмі крові знижується протягом 1 години і залишається такою протягом 3 годин після ін’єкції. Зазвичай дефіцит інсуліну пов'язаний зі змінами інших гормонів. Однак концентрації IGF-I, глюкагону та кортикостерону не відрізнялися від контрольних показників, які отримували лише один носій (8). Щури, оброблені діазоксидом, також демонструють збільшення нестерифікованих жирних кислот у плазмі та β-гідроксибутирату, характерних для дефіциту інсуліну. Таким чином, ця процедура є досить специфічною для зниження концентрації інсуліну в плазмі.
Існує щонайменше два обмеження цієї методики, щоб викликати відносний дефіцит інсуліну. По-перше, β-острівці залишаються чутливими до секретагогів інсуліну. Діазоксид блокує секрецію інсуліну, не пригнічуючи його біосинтез. Тому інсулін, швидше за все, накопичується в β-клітинах і може виділятися після болюсної ін’єкції секретагогу. Наприклад, вливання високих доз фенілаланіну призводить до швидкого підвищення плазмових концентрацій інсуліну (8). Для запобігання секреції інсуліну можна дати другу (15 мг у 2 мл 0,05 N гідроксиду натрію/100 г маси тіла) та/або третю дозу діазоксиду. Таким чином, слід бути обережним при проведенні метаболічних досліджень із сполуками, які, як відомо, модулюють секрецію інсуліну. По-друге, ефекти діазоксиду є тимчасовими і зворотними протягом 5 годин. Однак це останнє обмеження також можна вважати унікальним серед моделей дефіциту інсуліну. Таким чином, певні вимірювання теоретично можуть проводитись на одній і тій же тварині до, під час та після індукції перехідного дефіциту інсуліну. Ще однією перевагою цього методу є те, що концентрація інших гормонів у плазмі крові (наприклад, IGF-I, кортикостерон, гормон росту) не змінюється помітно після введення діазоксиду (8).
На додаток до діазоксиду, LN5330, бензотіадіазин зі структурною схожістю з діазоксидом, також спричинює швидке зниження концентрації інсуліну в плазмі крові (9). На відміну від діазоксиду, LN5330 також спричиняв помітне збільшення концентрації глюкагону в плазмі. Отже, ця сполука може ефективно індукувати гормональне середовище, яке спостерігається під час діабету, при цьому спостерігається як дефіцит інсуліну, так і гіперглюкагонемія.
Діабет і нервова система
Обґрунтування вивчення інсуліну
Те, що дефіцит або резистентність до інсуліну можуть бути пов’язані з нейропатією, може здатися очевидним висновком, проте підтримку він отримав лише нещодавно. Гіперглікемія, вторинна внаслідок недостатності β-клітин підшлункової залози, та її метаболічні наслідки затьмарили уявлення про пряму роль інсуліну в периферичній нейропатії. Основні клінічні дослідження, такі як ускладнення діабету та контрольне дослідження (DCCT), відзначали, що посилений контроль гіперглікемії знижує частоту та поширеність ДПН при діабеті 1 типу (з подальшими дослідженнями, що виявляють подібні переваги при діабеті 2 типу). Однак у DCCT суворий контроль гіперглікемії вимагав введення більш високих, частіших доз інсуліну. У деяких хворих на цукровий діабет інсулін може не вводитися, може бути неадекватним у дозі або може не імітувати фізіологічну дію через переривчасту дію екзогенних доз. Крім того, рівень інсуліну в сироватці крові не обов'язково відображає рівень спинномозкової рідини, де вона отримує доступ до нейронів (Folli et al., 1994). Таким чином, сучасні підходи до вживання інсуліну у людей не обов'язково є оптимальними для підтримки периферичних нейронів.
Невропатичні больові синдроми
Роберт В. Херлі,. Крістофер Л. Ву, у Практичному управлінні болем (п’яте видання), 2014
Контроль глікемії
Гіперглікемія та дефіцит інсуліну пов’язані з патогенезом ДПН. Здається, глікемічний контроль є одним із найефективніших методів уповільнення прогресування захворювання та затримки його початку. 1 У дослідженні, проведеному дослідницькою групою з контролю за діабетом та ускладненнями, загалом 1441 пацієнт із інсулінозалежним цукровим діабетом (726 з яких не мали ретинопатії, а 715 - з легкою ретинопатією) спостерігався протягом 6,5 років після випадкового призначення інтенсивного зовнішнього терапія інсуліновою помпою або три або більше ін'єкцій інсуліну щодня. Дослідження дійшло висновку, що в групі без ретинопатії інтенсивна терапія знижує ризик розвитку ДПН на 76% порівняно із звичайною терапією. У групі ретинопатій інтенсивна терапія зменшила прогресування на 54%. Дослідження також показало, що прогресування мікроальбумінурії в обох групах зменшувалось на 39%, альбумінурії на 54% та клінічної нейропатії на 60% при інтенсивній терапії інсуліном. 121 Таким чином, жорсткий контроль глікемії сприяє уповільненому початку та уповільненому прогресуванню ДПН.
ЦУКРОВИЙ ДІАБЕТ | Етіологія
Діагностика
Хоча як дефіцит інсуліну, так і резистентність до інсуліну призводять до порушень обміну жирів, білків та вуглеводів, саме на зміні рівня глюкози в крові в першу чергу базуються як діагностика, так і моніторинг.
Донедавна діагноз діабету базувався на критеріях, встановлених Всесвітньою організацією охорони здоров’я (ВООЗ), використовуючи стандартний пероральний тест на толерантність до глюкози (OGTT). У переважної більшості пацієнтів ГТТ є непотрібним, і діагноз ставлять на підставі клінічного анамнезу та випадкового рівня глюкози в крові та/або натощак, який зазвичай є однозначним. (Виняток становить вагітність, під час якої скринінг на гестаційний діабет за допомогою ГТТ є звичайною практикою.) Однак суворі критерії та стандартна діагностична процедура важливі, особливо для епідеміологічних цілей. Інтерпретація GTT базується на рівні глюкози в стані голодування і через 2 години після навантаження глюкозою 75 г (або еквівалент); ні 1-годинний рівень глюкози, ні вимірювання рівня глюкози в сечі або інсуліну в плазмі не мають діагностичного значення. Навантаження глюкози слід розчинити у 250–300 мл води і випити протягом 5 хв після нічного голодування; дієтичні вуглеводи не повинні обмежуватися протягом 3 днів до тесту.
Критерії ВООЗ нещодавно переглянуті, і нові критерії наведені в таблиці 3. Основною причиною змін є той факт, що 1-годинний рівень глюкози в плазмі крові після навантаження 11,1 ммоль l -1 (найважливіший критерій діагностики діабету) краще корелює з рівнем голодування 7, ніж 6 ммоль l -1. Також була запропонована нова категорія `` порушеної глюкози натще '' (глюкоза в плазмі натще 6,1–7,0 ммоль л -1), оскільки було показано, що поширеність діабетичних ускладнень (ретинопатія) починає значно зростати у людей із вмістом глюкози в плазмі натще 6 ммоль л -1. (Див. ГЛЮКОЗА | Підтримання рівня глюкози в крові; ГЛЮКОЗА | Толерантність до глюкози та глікемічний (глікемічний) індекс.)
Таблиця 3. Діагностичні значення для перорального тесту на толерантність до глюкози (ВООЗ, 1999)
- Гіпурікемія - огляд тем ScienceDirect
- Гіпердинамічна циркуляція - огляд тем ScienceDirect
- Лікарський гриб - огляд тем ScienceDirect
- Лейкоенцефалопатія - огляд тем ScienceDirect
- Ілеїт - огляд тем ScienceDirect