Бруцельоз людини у фебрильних пацієнтів, які шукають лікування у віддалених лікарнях, Північно-Східна Кенія,
Протягом 2014–2015 років у пацієнтів на північному сході Кенії проводили оцінку на наявність бруцельозу та характеристик, які можуть допомогти клініцистам виявити бруцельоз. Серед 146 підтверджених хворих на бруцельоз 29 (20%) мали негативні серологічні тести. Жодна клінічна характеристика не була хорошим показником інфекції, яка була пов’язана з контактом з тваринами та вживанням сирого молока.
Бруцельоз - зоонозна хвороба, яка може спричинити важкі захворювання у людей та значні економічні втрати у тваринництві (1). Основними збудниками бруцельозу у людей є Brucella abortus, B. melitensis та B. suis (2). Інфікування людей відбувається переважно через потрапляння в організм забруднених продуктів тваринного походження, вдихання забруднених частинок, що потрапляють у повітря, або безпосередній контакт із зараженими тваринами або їх продуктами (3). Клінічні ознаки та симптоми бруцельозу людини є неспецифічними та дуже мінливими (4). Особи, які працюють з тваринами та їхні сім'ї, вважаються ризикованими зараженням (3,5). У тварин бруцельоз протікає безсимптомно, але може спричинити аборти, слабке потомство та стерильність (5).
У країнах, що розвиваються, серологічні аналізи, засновані на швидких тестах аглютинації слайдів, є головним фактором для діагностики бруцельозу, але ці аналізи мають слабку специфічність (6). Як правило, ІФА вважається більш конкретним та чутливим, що дозволяє краще співвідноситися з клінічною ситуацією. Хоча аналізи ПЛР є високочутливими та специфічними інструментами для швидкої діагностики бруцельозу людини та одночасної диференціації генотипів бруцели, вони часто недоступні у багатьох із цих країн (7).
Огляд епідеміології бруцельозу в Африці, що знаходиться на південь від Сахари, підкреслив той факт, що бруцельоз є ендемічним у системах скотарства, де програми спостереження та боротьби з хворобами погано виконуються (1). У межах Кенії зареєстровано 2% та 7% серопревенцій серед осіб з високим ризиком захворювання на бруцельоз відповідно в графствах Найробі та Накуру (8), а у 2007 році було зареєстровано національну серопролевантність 3% (9). Зовсім недавно Осоро та ін. (10) показали різницю (2,4% –46,5%) у серопролевантності в 3 округах Кенії.
Діагностика гарячкових захворювань у країнах, що розвиваються, є складною через відсутність візуалізації та надійної лабораторної підтримки. Клінічне лікування таких захворювань часто проводиться емпіричним шляхом, що призводить до неточного лікування пацієнтів та рутинного недооцінювання захворювання (11). Дані про поширеність та потенційні фактори ризику, пов’язані з бруцельозом людини в Кенії, мізерні. Поширені види бруцел в Кенії залишаються в основному невідомими. Метою цього дослідження було оцінити частку хворих на бруцельоз у 2 лікарнях на північному сході Кенії та описати характеристики пацієнтів, які можуть допомогти клініцистам виявити випадки бруцельозу в районах без лабораторної підтримки.
Навчання
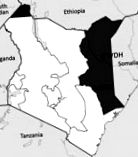
Малюнок. Місця розташування 2 лікарень у північно-східній провінції Кенії (темно-сіре затінення), де діагностували бруцельоз людини у гарячкових пацієнтів, які звертаються за лікуванням, Кенія, 2014–2015. Суцільна чорна область в.
Протягом 2014–2015 рр. Ми включали пацієнтів із гострими фебрильними захворюваннями, які звертались за допомогою до лікарень Гарісса та Ваджир на північному сході Кенії (рисунок), використовуючи систематичні інтервали відбору проб на основі раніше задокументованих пропорцій фебрильних хворих, зареєстрованих у кожній лікарні. Протокол дослідження був затверджений Науково-етичним комітетом з перегляду Кенійського медичного дослідницького інституту. Ми отримали зразки сироватки та протестували їх на бруцельоз, використовуючи модифікований тест Бенгальської пластинки (RBPT) (VLA Weybridge, Великобританія) (12) та набори SERION ELISA classic Brucella IgM/IgG (Virion/Serion, Вюрцбург, Німеччина) відповідно до інструкції виробників. Ми витягли ДНК із зразків сироватки за допомогою набору високого чистого шаблону (Roche Diagnostics, Мангейм, Німеччина). Ми провели кількісні аналізи ПЛР у реальному часі (qPCR) для виявлення бруцельозу та видоутворення видів бруцел, як описано раніше (13) (Таблиця 1 технічного додатка 1). Ми класифікували хворих на бруцельоз, якщо вони мали позитивні результати qPCR або позитивні результати RBPT, підтверджені позитивними результатами ІФА. Ми підготували багатовимірні моделі логістичної регресії для оцінки демографічних, клінічних особливостей та ймовірних факторів ризику, пов’язаних із серопозитивністю до бруцельозу, за допомогою процедури поступового зворотного аналізу.
Загалом у дослідженні взяли участь 1067 пацієнтів; 580 (54,4%) учасників були жінками, а 963 (90,3%) - сомалійської національності (Технічний додаток, таблиця 2). Бруцельоз був встановлений у 146 пацієнтів (13,7%, 95% ДІ 11,7% –15,9%). З них 29 (2,7%) мали негативні результати серологічних тестів на інфекцію бруцел. B. abortus був єдиним видом бруцел, знайденим за допомогою специфічного для виду Brucella qPCR.
Статистичний аналіз не показав суттєвих відмінностей у зараженні за етнічною групою, округом проживання, статусом освіти чи віковою групою. У чоловіків була значно вища ймовірність (співвідношення шансів [АБО] 1,98, р = 0,001) на наявність бруцельозу (таблиця 1).
Для клінічної діагностики бруцельозу в обох лікарнях було виявлено значний низький рівень чутливості (Технічний додаток, таблиця 3). У хворих на бруцельоз в основному діагностували черевний тиф (63 пацієнти [43,2%]), малярію (30 [20,5%]), пневмонію (12 [8,2%]) та інші поширені тропічні лихоманки або лихоманки невідомого походження (14 [9,6 %]) (Таблиця 1).
У підсумковому комбінованому багатофакторному аналізі бруцельоз був суттєво асоційованим (р 14 днів (з поправкою OR [aOR] 2,86), контактом з великою рогатою худобою (aOR 6,50) або кількома видами тварин (aOR 2,35), забоєм тварин (aOR 2,20) та споживанням сирого молока великої рогатої худоби (aOR 3,88). Пастухи були в 1,69 рази частіше серопозитивними (табл. 2).
Висновки
Це лікарняне дослідження, проведене переважно скотарською громадою в Кенії, показало високу поширеність (13,7%) бруцельозу у хворих на гарячку, виділивши бруцельоз як важливу причину гострих гарячкових захворювань на північному сході Кенії. Хоча раніше було описано, що бруцельоз трапляється у госпітальних пацієнтів у Кенії (1), у нашому дослідженні його не діагностували лікуючі лікарні лікарні у 119/146 (81,5%) випадках. Натомість ці випадки в основному пояснювались іншими причинами лихоманки або лихоманки невідомого походження. Крім того, 29 (2,7%) пацієнтів, які мали негативні результати серологічних тестів на бруцеллу, мали позитивні результати щодо B. abortus за допомогою qPCR.
Наші висновки настійно свідчать про те, що пацієнти з бруцельозом, швидше за все, залишали лікарню без спеціального лікування бруцельозу. Це узгоджується з нещодавніми висновками, які показали, що клініцисти в Кенії продовжують лікувати гарячкових хворих від передбачуваної малярії, що призводить до втрачених можливостей для точного виявлення та лікування інших причин лихоманки (11,14). Результати також підкреслюють корисність qPCR як додаткового аналізу до комбінованого діагностичного підходу ELISA та RBPT у діагностиці гострого бруцельозу та необхідність створення національних та регіональних референтних лабораторій з обладнанням для проведення аналізів qPCR.
У нашому дослідженні контакт із великою рогатою худобою або багатьма видами тварин та споживання сирого молока від великої рогатої худоби були суттєво пов'язані з бруцельозом (табл. 2). Цю асоціацію можна пояснити професійними та побутовими контактами з тваринництвом та соціально-культурними практиками серед громад на досліджуваній території, які збільшують ризик передачі бруцелли, включаючи кочові пересування, догляд за тваринами під час пологів, споживання сирого молока від великої рогатої худоби та верблюдів та побутовий забій тварин під час традиційних та релігійних обрядів (9,15).
У цьому дослідженні єдиним виявленим видом Brucella був B. abortus, що підтверджує припущення, що бруцельоз може бути тісно пов’язаний з великою рогатою худобою більше, ніж інші види тварин; проте подальші дослідження є виправданими. Крім того, ще потрібно визначити поширені генотипи та біовари бруцелли у Кенії.
Наше дослідження не змогло краще визначити надійні клінічні прогностичні фактори для бруцельозу. Відсутність чіткого клінічного алгоритму прогнозування бруцельозу підтверджує необхідність підвищення обізнаності лікаря про захворювання та посилення діагностичних можливостей щодо бруцельозу в лікарняних умовах.
Це дослідження має потенційні обмеження. Спочатку в дослідженні використовували зразки сироватки гострої фази, що ускладнювало демонстрацію 4-кратного підвищення титру. Спостереження за пацієнтами для отримання зразка сироватки у фазі реконвалесценції було неможливим через триваючі міжкланові конфлікти та діяльність міліції в регіоні. Отже, не можна виключати можливість пацієнтів, які раніше мали вплив на бруцеллу, але мали залишкові антитіла в обігу.
Доктор Неру - науковий співробітник Інституту Фрідріха-Леффлера в Єні, Німеччина. Його основним науковим інтересом є епідеміологія зоонозних хвороб.
Подяка
Ми дякуємо пацієнтам за участь у цьому дослідженні. Ми вдячні працівникам Інституту Фрідріха-Леффлера та працівникам лікарні за їх цінні внески. Ми також дякуємо Еріку Осоро за сприяння збору даних. Нарешті, ми дякуємо директору Кенійського медичного дослідницького інституту за фінансову підтримку Дж. та дозвіл на публікацію цієї статті.
Дослідження підтримано Німецькою службою академічних обмінів (грант № A/12/97862), Дослідницькою програмою CGIAR для сільського господарства з питань харчування та охорони здоров’я (під керівництвом Міжнародного інституту досліджень харчової політики [грант № 1100783/1]), та Міністерство науки та освіти Німеччини (грант № 01KI1501).
- Індивідуальний підхід до лікування хворих на СДК із ожирінням може зменшити антропометричні показники,
- Аномалії обміну речовин у пацієнтів з реакцією пролактиноми на лікування каберголіном
- Пізня діарея у хворих на цукровий діабет, які отримують метформін Небажаний ефект від появи молекули
- Дієта пізнього верхнього палеоліту людини, перші стабільні ізотопні дані від Ріпаро Тальєнте (Верона,
- Головний біль після вправи 5 Потенційні причини, лікування та профілактика