Аполіпопротеїн В48 натще пов’язаний з атеросклеротичним інсультом великих артерій: дослідження "випадок-контроль"
Предмети
Анотація
Повідомляється, що аполіпопротеїн B48 (ApoB48) натще є сурогатним маркером постпрандіальної ліпідемії і неодноразово асоціювався із серцево-судинними захворюваннями. Однак, чи є ApoB48 також фактором ризику розвитку ішемічного інсульту, не повідомлялося. У цьому дослідженні наша мета - дослідити взаємозв'язок між рівнем ApoB48 у плазмі натще та інсультом атеросклерозу великих артерій (LAA). Проведено дослідження з контролем випадків віку (± 2) у віці (± 2). Пацієнти LAA та здорові особи контролю, які потрапляли до нашого центру, були найняті на перспективу. Були зібрані клінічні дані та використаний імуноферментний аналіз (ІФА) для вимірювання рівнів ApoB48 у плазмі натще. Включена когорта 234 хворих на інсульт LAA та 234 контрольних. Рівень ApoB48 у плазмі натще був значно вищим у пацієнтів з інсультом LAA, ніж у контрольних (4,76 (3,46) проти 4,00 (2,4), P
Вступ
Гіпертригліцеридемія, що не дотримується, зумовлена накопиченням багатих тригліцеридами хіломікронів та їх частково гідролізованих хіломікронів, які є високоатерогенними. Поглинаючі клітини тонкої кишки виробляють аполіпопротеїн B48 (ApoB48), утворюючи хіломікрони. Кожна частинка хіломікрону містить одну молекулу ApoB48 9. Крім того, попередні дослідження показали, що концентрація ApoB48 натще може бути хорошим сурогатним маркером для рівня постпрандіальної ліпідемії 10,11. Тому рівень ApoB48 натще може бути хорошим біомаркером для атеросклеротичних захворювань, включаючи серцево-судинні захворювання та ішемічний інсульт. Клінічні дослідження довели, що рівень ApoB48 натще пов’язаний із каротидним атеросклерозом 12,13,14,15,16, захворюванням периферичних артерій 17 та ішемічною хворобою 18,19. Однак зв'язок між ApoB48 натще і ішемічним інсультом досі невідома. Таким чином, метою цього дослідження було вивчити взаємозв'язок між рівнем ApoB48 у плазмі крові та атеросклеротичним інсультом великої артерії (LAA).
Результати
За період дослідження в це дослідження було включено 234 пацієнта, які відповідають критеріям включення. Чоловіків було 147 (62,82%), середній вік становив 59,97 ± 11,45 років. Контролі були набрані за віком (1: 1) (± 2) та за гендерною відповідністю протягом того самого періоду дослідження. Середній вік контролерів становив 59,76 ± 11,39 років. У таблиці 1 узагальнено демографічні та клінічні особливості хворих з інсультом контролю та LAA. Порівняно з контролем, у пацієнтів з інсультом LAA спостерігалася вища поширеність судинних факторів ризику (артеріальна гіпертензія, діабет, куріння, пиття) та вищі середні значення ІМТ та рівнів TG (всі p Таблиця 1 Клінічні характеристики контрольних груп та пацієнти з LAA інсульт.
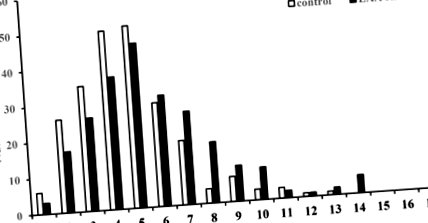
Розподіл рівнів ApoB48 у плазмі натще у контрольних групах та пацієнтах з інсультом LAA. Плазмові концентрації ApoB48 = 1 представляють концентрації від 0 до 1,0 мкг/мл.
Подальший аналіз показав, що існує лінійна залежність між рівнями ApoB48 і рівнями TG у контролях (p Рисунок 2
Кореляція ApoB48 з інсультом LAA може бути переплутана різними факторами. Таким чином, були проведені подальші аналізи, щоб виявити, чи ApoB48 не залежить самостійно від інсульту LAA. Ці змінні з р 5,29 мкг/мл ”були введені в модель (Додаткова таблиця 1), високий рівень ApoB48 також був суттєво пов’язаний з інсультом LAA (OR = 3,50, 95% ДІ = 1,69–7,26, P = 0,001).
Обговорення
У цьому дослідженні ми продемонстрували, що вперше рівні ApoB48 натще були вищими у пацієнтів з інсультом LAA, а більш високий рівень ApoB48 (ApoB48> 5,29 мкг/мл) був майже в два рази частіше у пацієнтів з інсультом LAA (42,74%) ніж у контрольних групах (23,50%). У багатоваріантному аналізі рівні ApoB48 натще (OR = 1,18, 95% ДІ = 1,04-1,35, P = 0,014) та високий рівень ApoB48 (OR = 3,50, 95% ДІ = 1,69-7,26, P = 0,001) були пов'язані з LAA інсульт, незалежний від загальноприйнятих факторів ризику. Рівень TG натще позитивно корелював з рівнем ApoB48; однак рівні ТГ у плазмі натще не були незалежним фактором ризику розвитку інсульту LAA.
HTG після їжі є одним із незалежних факторів ризику розвитку атеросклерозу. Більше того, попередні великі когортні дослідження довели, що рівні ТГ після їжі можуть бути більш підходящим маркером для ішемічного інсульту, ніж рівень ТГ натще. Однак не існує стандартизованого способу вимірювання рівня ТГ після їжі. Рівень ТГ після їжі традиційно оцінюється як відповідь на стандартну багату їжу з високим вмістом жиру. Цей тест вимагає від 6 до 8 годин і вимагає співпраці пацієнтів. Отже, виявлення сурогатних маркерів постпрандіального HTG, які можна було б легко виміряти в звичайній клінічній практиці, буде корисним для оцінки ризику інсульту. Оскільки одна частинка хіломікрону містить одну молекулу ApoB48, рівень ApoB48 у плазмі крові вказує на кількість частинок після їжі [9]. Рівні швидкості ApoB48 тісно корелюють з рівнями TG після їжі після ліпідного прийому їжі [10]. Ця інформація свідчить про те, що рівень ApoB48 натще є сурогатними маркерами HTG після їжі. Попередні дослідження показали, що ApoB48 натще може бути фактором ризику розвитку атеросклерозу та атеросклеротичних серцево-судинних захворювань. Це поперечне дослідження, яке показує, що ApoB48 натще пов'язане з інсультом LAA, додає нову інформацію до цього зв'язку.
Наші висновки про те, що ApoB48 натще пов’язаний з інсультом LAA, вказують на те, що містять ApoB48 ліпопротеїни можуть брати участь у розвитку атеросклерозу 20. Багато експериментальних досліджень вказали на можливі основні механізми. ApoB48 має місце зв'язування з протеогліканами артеріальної стінки 21. В результаті ApoB48 було виявлено в атеросклеротичних бляшках людини у зразках стегнової та сонної ендартеректомії 22 . В пробірці Дослідження показали, що залишки хіломікрону можуть поглинатися перитонеальними макрофагами миші та макрофагами, отриманими з моноцитів людини, за допомогою безлічі механізмів 23. Більше того, залишки хіломікрону можуть індукувати експресію білка-хемоаттрактанта моноцитів за допомогою активації p38 MAPK та регулювати фактор ранньої реакції на ріст-1 у гладком'язових клітинах судин 24,25. Крім того, залишки хіломікрону можуть збільшити продукцію інгібітора активатора плазміногену-1 (PAI-1) та посилити апоптоз в ендотеліальних клітинах 26. Ці дослідження забезпечують фізіопатологічні механізми, що підтверджують наші висновки.
У цьому дослідженні є деякі обмеження. По-перше, як дослідження поперечного перерізу, це дослідження не може допомогти зробити причинно-наслідкові умовиводи. По-друге, рівні ApoB48 натще можуть змінюватися після початку захворювання. Однак ми завербували пацієнтів, які потрапили до нас у лікарню протягом 24 годин після початку захворювання, і існуюче дослідження показує, що концентрація ліпідів не суттєво змінюється протягом перших днів після початку інсульту 27 .
На закінчення, рівні ApoB48 у плазмі натще були суттєво корельовані з поширеністю інсульту LAA. Отже, ApoB48 може бути новим маркером для інсульту LAA, а також можливою терапевтичною мішенню.
Матеріал та методи
Пацієнти та контролі
Це дослідження було схвалено комітетами з етики Народної лікарні міста Деян. Інформована згода була отримана від кожного учасника. Усі методи виконувались відповідно до відповідних рекомендацій та правил. З лютого 2015 року по грудень 2017 року послідовних пацієнтів з ішемічною хворобою, які потрапили до нашої лікарні, пройшли перспективний обстеження для зарахування. Діагноз інсульту LAA підтвердили два неврологи. Критерієм включення був допуск протягом 24 годин після початку ішемічного інсульту. Критеріями виключення були такі: (1) перенесений в минулому інсульт або ішемічна хвороба серця; (2) після лікування до прийому, включаючи лікування статинами; (3) позбавлення плазми натще протягом 24 годин після прийому; (4) наявність неповних даних про етіологію інсульту та/або дві або більше етіології інсульту; (5) які мають систематичні захворювання. Ми набрали здорових добровольців для контролю, які проходили медичне обстеження в нашій лікарні протягом того ж періоду дослідження. У це дослідження були включені ті добровольці, які не мали анамнезу інсульту, інфаркту міокарда та систематичних захворювань. Врешті-решт, у це дослідження було набрано 234 хворих на інсульт LAA та 234 здорових добровольців.
Оцінка факторів ризику інсульту
Демографічні характеристики, минула історія хвороби та клінічні дані про контрольні групи та пацієнтів реєструвались проспективно. Були зафіксовані загальні судинні фактори ризику, включаючи гіпертонію, цукровий діабет, пияцтво, куріння та серцеві захворювання. Цукровий діабет та гіпертонія були визначені відповідно до вказівок щодо діагностики. Куріння визначалося як куріння, яке дорівнює або більше однієї сигарети на день протягом одного року або більше. Вживання алкоголю визначали як минулу або поточну історію вживання алкоголю частіше одного разу на день протягом більше 1 року. Хвороби серця визначали так, ніби у суб’єкта було одне або кілька захворювань серця, таких як інфаркт міокарда та фібриляція передсердь. Магнітно-резонансна томографія (МРТ) з дифузійно-зваженою візуалізацією, МР або КТ-ангіографією, сонною дуплексною ультрасонографією, трансторакальною ехокардіографією, 24-годинним моніторингом за Холтером та іншими рутинними лабораторними дослідженнями для прийому були проведені для оцінки підтипу інсульту. За необхідності також проводили трансезофагеальну ехокардіографію. Ішемічний інсульт LAA був оцінений двома незалежними неврологами згідно з випробуванням Org 10172 у дослідженні лікування гострого інсульту 28 .
У всіх пацієнтів та контрольних груп з інсультом LAA ліпідні панелі натощак були витягнуті після нічного голодування. Загальний холестерин, тригліцериди, ЛПВЩ, ЛПНЩ вимірювали стандартними лабораторними методами на свіжій плазмі. Крім того, додаткову плазму кожного пацієнта та контрольної групи заморожували у морозильній камері -80 ° C для подальшого використання.
Імуноферментний аналіз
Рівні ApoB48 у плазмі натще визначали кількісно за допомогою імуноферментного аналізу (ІФА) відповідно до вказівок виробника (Фудзіребіо, Токіо, Японія) 29. Концентрації ApoB48 вимірювали порціями. Референтні зразки плазми об'єднували з 20 здорових контролів і додавали до кожної пластини, щоб мінімізувати варіації між пластинами. Сертифіковані лабораторіями, які пройшли сертифікацію ради, провели вимірювання, і вони були засліплені для групування інформації. Відтворюваність результатів оцінювали шляхом обчислення середнього коефіцієнта варіації (CV) у пластинах та між пластинами. Середнє значення CV у внутрішньо-аналізі становило 2 тести. Багатофакторний аналіз проводили шляхом умовної логістичної регресії, щоб визначити, чи рівень ApoB48 натще не був незалежним від інсульту LAA після корекції загальних факторів ризику. Відмінності між групами вважалися значними, якщо р-значення було менше 0,05 (двостороння). Для проведення статистичного аналізу був використаний Статистичний пакет соціальних наук (SPSS, версія 22).
Набори даних, створені під час та/або проаналізовані під час поточного дослідження, доступні у відповідного автора за обґрунтованим запитом.
Список літератури
Колову, Г. Д. та ін. Оцінка та клінічна значимість тригліцеридів не натще і після їжі: заява експертної групи. Curr Vasc Pharmacol 9, 258–270 (2011).
Патель, А. та ін. Тригліцериди в сироватці крові як фактор ризику серцево-судинних захворювань в Азіатсько-Тихоокеанському регіоні. Тираж 110, 2678–2686, https://doi.org/10.1161/01.CIR.0000145615.33955.83 (2004).
Бергер, Дж. С. та ін. Біомаркери ліпідів та ліпопротеїнів та ризик ішемічного інсульту у жінок у постменопаузі. Інсульт 43, 958–966, https://doi.org/10.1161/STROKEAHA.111.641324 (2012).
Шахар, Е. та ін. Ліпідний профіль плазми та інцидент ішемічного інсульту: дослідження ризику атеросклерозу в громадах (ARIC). Інсульт 34, 623–631, https://doi.org/10.1161/01.STR.0000057812.51734.FF (2003).
Боумен, Т. С. та ін. Холестерин та ризик ішемічного інсульту. Інсульт 34, 2930–2934, https://doi.org/10.1161/01.STR.0000102171.91292.DC (2003).
Freiberg, J. J., Tybjaerg-Hansen, A., Jensen, J. S. & Nordestgaard, B. G. Непості тригліцеридів та ризик ішемічного інсульту серед загальної популяції. ДЖАМА 300, 2142–2152, https://doi.org/10.1001/jama.2008.621 (2008).
Варбо, А. та ін. Тригліцериди, що не приймають пост, холестерин та ішемічний інсульт у загальній популяції. Енн Нейрол 69, 628–634, https://doi.org/10.1002/ana.22384 (2011).
Бансал, С. та ін. Голодування порівняно з тригліцеридами, що не дотримуються голоду, та ризик серцево-судинних подій у жінок. ДЖАМА 298, 309–316, https://doi.org/10.1001/jama.298.3.309 (2007).
Філліпс, М.Л. та ін. На залишку людського хіломікрону присутня одна копія аполіпопротеїну В-48. J Ліпід 38, 1170–1177 (1997).
Smith, D., Watts, G. F., Dane-Stewart, C. & Mamo, J. C. Постпрандіальна реакція хіломікрону може бути передбачена за допомогою одного вимірювання плазмового аполіпопротеїну B48 у стані голодування. Eur J Clin Invest 29, 204–209 (1999).
Масуда, Д. та ін. Сироватковий аполіпопротеїн В-48 натще може бути маркером гіперліпідемії після їжі. J Атеросклер Тромб 18, 1062–1070 (2011).
Мейєр, Е. та ін. Аномальні постпрандіальні аполіпопротеїни В-48 та тригліцеридні реакції у нормоліпідемічних жінок із понад 70% стенозуючої ішемічної хвороби серця: дослідження "випадок-контроль". Атеросклероз 124, 221–235 (1996).
Танімура, К. та ін. Асоціація рівня сироваткового аполіпопротеїну В48 з наявністю каротидного нальоту при цукровому діабеті 2 типу. Діабет Res Clin Pract 81, 338–344, https://doi.org/10.1016/j.diabres.2008.04.028 (2008).
Накатані, К. та ін. Рівні аполіпопротеїну B-48 у сироватці крові корелюють з товщиною каротидної інтима-середовища у осіб із нормальним рівнем тригліцеридів у сироватці крові. Атеросклероз 218, 226–232, https://doi.org/10.1016/j.atherosclerosis.2011.05.009 (2011).
Лапіс, Е. та ін. Аполіпопротеїн B48 натще асоціюється з безсимптомним захворюванням периферичних артерій у хворих на цукровий діабет 2 типу: дослідження "випадок-контроль". Атеросклероз 223, 504–506, https://doi.org/10.1016/j.atherosclerosis.2012.05.038 (2012).
Аліпур, А. та ін. Дослідження значення apoB48 як маркера атеросклерозу в клінічній практиці. Eur J Clin Invest 42, 702–708, https://doi.org/10.1111/j.1365-2362.2011.02635.x (2012).
Манчера-Ромеро, Дж. та ін. Аполіпопротеїн В48 натще є маркером захворювання периферичних артерій при цукровому діабеті 2 типу. Акта Діабетол 50, 383–389, https://doi.org/10.1007/s00592-012-0434-x (2013).
Масуда, Д. та ін. Кореляція сироваткового аполіпопротеїну В-48 натще з поширеністю ішемічної хвороби. Eur J Clin Invest 42, 992–999, https://doi.org/10.1111/j.1365-2362.2012.02687.x (2012).
Морі, К. та ін. Концентрація аполіпопротеїну В48 натще у сироватці крові залишає залишковий ризик у пацієнтів з новою та хронічною хворобою ІХС. Clinica chimica acta; міжнародний журнал клінічної хімії 421С, 51–56, https://doi.org/10.1016/j.cca.2013.02.005 (2013).
Масуда, Д. та Ямасіта, С. Гіперліпідемія після їжі та залишкові ліпопротеїди. J Атеросклер Тромб 24, 95–109, https://doi.org/10.5551/jat.RV16003 (2017).
Повінь, С. та ін. Ідентифікація місця зв'язування протеоглікану в аполіпопротеїні В48. J Biol Chem 277, 32228–32233, https://doi.org/10.1074/jbc.M204053200 (2002).
Pal, S., Semorine, K., Watts, G. F. & Mamo, J. Ідентифікація ліпопротеїдів кишкового походження в атеросклеротичних бляшках людини. Clin Chem Lab Med 41, 792–795, https://doi.org/10.1515/CCLM.2003.120 (2003).
Fujioka, Y., Cooper, A. D. & Fong, L. G. У поглинанні залишків хіломікрону перитонеальними макрофагами миші беруть участь багато процесів. J Ліпід 39, 2339–2349 (1998).
Домото, К. та ін. Залишки хіломікрону індукують експресію білка-1 хемоаттрактанта моноцитів за допомогою активації p38 MAPK у гладком'язових клітинах судин. Атеросклероз 171, 193–200 (2003).
Такахасі, Ю. та ін. Залишки хіломікрону регулюють фактор ранньої реакції на ріст-1 у гладком'язових клітинах судин. Life Sci 77, 670–682, https://doi.org/10.1016/j.lfs.2005.01.012 (2005).
Кавасакі, С. та ін. Залишок хіломікрону індукує апоптоз в ендотеліальних клітинах судин. Ann N Y Acad Sci 902, 336–341 (2000).
Weir, C. J., Sattar, N., Walters, M. R. & Lees, K. R. Низький рівень тригліцеридів, не низька концентрація холестерину, незалежно передбачає поганий результат після гострого інсульту. Цереброваска Dis 16, 76–82, https://doi.org/10.1159/000070119 (2003).
Адамс, Х. П. молодший. та ін. Класифікація підтипу гострого ішемічного інсульту. Визначення для використання в багатоцентровому клінічному дослідженні. ТОСТ. Випробування Org 10172 при лікуванні гострого інсульту. Інсульт 24, 35–41 (1993).
Сакай, Н. та ін. Вимірювання рівнів апоВ-48 в сироватці крові натще у пацієнтів із нормоліпідемією та гіперліпідемією методом ІФА. J Ліпід 44, 1256–1262, https://doi.org/10.1194/jlr.M300090-JLR200 (2003).
Подяки
Це дослідження було підтримане грантом Департаменту науки і технологій провінції Сичуань, Китай (№ 2015JY0169).
Інформація про автора
Цзин Тянь і Хун Чень внесли однаковий внесок.
Приналежності
Департамент неврології, Народна лікарня міста Деян, Північна дорога Тайшань 173, місто Деян, 618000, Китай
Цзін Тянь, Хонг Чень, Пінг Лю, Чун Ван та Йон Чен
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
Йон Чень розробив, спонсорував та керував цим дослідженням. Цзін Тянь та Гон Чен вимірювали рівні ApoB48 у плазмі крові, збирали клінічні дані та аналізували результати. Пінг Лю та Чун Ван окремо оцінили підтипи інсульту та допомогли зібрати клінічні дані та плазму. Цзін Тянь, Хун Чень та Йон Чень проаналізували дані та написали рукопис. Пінг Лю та Чун Ван доказово читали та давали пропозиції до рукопису.
Відповідний автор
Декларації про етику
Конкуруючі інтереси
Автори декларують відсутність конкуруючих інтересів.
Додаткова інформація
Примітка видавця: Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Сприятливий запальний статус після періодичного голодування у хворих на атеросклеротичний
- Подумайте про пісний сталий вибір морепродуктів під час посту
- Дієтичні та соціально-економічні фактори, пов'язані з надмірною вагою та ожирінням у південній Франції
- Chaitra Navratri 2020 5 продуктів, які ви все ще можете їсти під час посту - Їжа NDTV
- Дієта при нервовій булімії пов'язана з посиленням обмеження їжі та психопатологією, але