Вплив олії амаранту (Amaranthus cruentus L.) та ріпаку (Brassica napus L.) на окислювальний метаболізм нейтрофілів у пацієнтів із ожирінням *
Домініка Каніковська
кафедра патофізіології Познанського університету медичних наук, Познань, Польща;
Аліна Каніковська
b Кафедра внутрішніх хвороб, метаболізму та харчування, Познанський університет медичних наук, Познань, Польща;
Рафал Рутковський
кафедра патофізіології Познанського університету медичних наук, Познань, Польща;
Малгожата Влочаль
b Кафедра внутрішніх хвороб, метаболізму та харчування, Познанський університет медичних наук, Познань, Польща;
Зофія Ожеховська
кафедра патофізіології Познанського університету медичних наук, Познань, Польща;
Альдона Юхач
b Кафедра внутрішніх хвороб, метаболізму та харчування, Познанський університет медичних наук, Познань, Польща;
Агнешка Завада
b Кафедра внутрішніх хвороб, метаболізму та харчування, Познанський університет медичних наук, Познань, Польща;
Маріан Гжиміславський
b Кафедра внутрішніх хвороб, метаболізму та харчування, Познанський університет медичних наук, Познань, Польща;
Магдалина Рошак
c Кафедра інформатики та статистики Познанського університету медичних наук, Познань, Польща;
Макі Сато
d Кафедра фізіології, Медичний університет Айті, Нагакуте, Японія
Анджей Бремборович
кафедра патофізіології Познанського університету медичних наук, Познань, Польща;
Януш Вітовський
кафедра патофізіології Познанського університету медичних наук, Познань, Польща;
Анотація
Контекст: Олії амаранту та ріпаку використовуються традиційно. Визначено, що амарант представляє інтерес через його надзвичайну поживну цінність. Олія амаранту є багатим джерелом вкрай ненасичених жирів і тому може бути цінною дієтичною альтернативою для людей, які страждають ожирінням. Реактивні форми кисню (АФК) припускають, що вони беруть участь у системному запаленні та окисному стресі. Активовані поліморфно-ядерні нейтрофіли (ПМН) генерують велику кількість активних форм кисню.
Завдання: Наше дослідження досліджує вплив добавок олій амаранту та ріпаку на окислювальний метаболізм у пацієнтів із ожирінням. Ми припустили, що завдяки своїм гіполіпідемічним та антиоксидантним властивостям олія амаранту та ріпаку захищає від окисного стресу.
Матеріали і методи: Ми протестували 19 пацієнтів із ожирінням [індекс маси тіла (ІМТ) = 41,1 ± 7,8 кг/м 2, (середнє значення ± SD)]. Протокол складався з двох етапів: фази обкатки 2 тижні та експериментальної стадії - добавки ріпакової або амарантової олії (20 мл/день) з дієтою обмеження калорій протягом 3 тижнів. Окислювальний сплеск нейтрофілів виражався інтенсивністю флуоресценції (IF).
Результати: Окислювальний сплеск значно збільшився в кінці лікування в обох групах ІФ: (21,4 ± 11,15 проти 35,9 ± 20,3; середнє значення ± SD) p Ключові слова: Нейтрофільний окислювальний сплеск, ожиріння, рослинна олія
Вступ
Окислювальний стрес є результатом дисбалансу між утворенням активних форм кисню та антиоксидантним механізмом. Припускають, що активні форми кисню беруть участь у системному запаленні та окисному стресі у пацієнтів із ожирінням. Жирова тканина складається з адипоцитів, але також містить інші клітини, такі як попередні адипоцити, лімфоцити, макрофаги, фібробласти та судинні клітини; в основному він міститься у підшкірних та вісцеральних складах (Ouchi et al. 2011). Нейтрофіли беруть участь у модуляції запалення жирової тканини на ранній стадії ожиріння (Talukdar et al. 2012; Huh et al. 2014; Xu et al. 2015).
Ожиріння визначається як надлишок жирової тканини і є значним фактором ризику метаболічних та серцево-судинних захворювань, включаючи діабет 2 типу (Klein et al. 2004; Yach et al. 2006; Всесвітня організація охорони здоров'я 2011). Ожиріння пов'язане з дисфункцією жирової тканини, включаючи підвищені прозапальні маркери (Hotamisligil 2006), і ці запальні фактори є головним фактором розвитку метаболічного захворювання (Xu et al. 2015). Ожиріння викликає зміни в жировій тканині; хронічний, низькоякісний системний запальний стан характерний для ожиріння, яке еволюціонувало протягом певного періоду (Lumeng and Saltiel 2011). Запальна реакція, пов’язана з ожирінням, призводить до збільшення циркулюючих цитокінів (Hotamisligil et al. 1995) та окисного стресу (Gregor and Hotamisligil 2011).
У пацієнтів із ожирінням спостерігається значне збільшення як білків, отриманих нейтрофілами, включаючи мієлопероксидазу та кальпротектин (Nijhuis et al. 2009; Olza et al. 2012) або нейтрофілів еластазу (Talukdar et al. 2012). Активовані поліморфно-ядерні нейтрофіли генерують велику кількість активних форм кисню. Підвищення активності окисного нейтрофільного сплеску було продемонстровано за рахунок обмеження енергії (Suzuki et al. 2003).
Встановлено, що як зменшення споживання жиру тваринного походження, так і збільшення вживання ненасичених жирів є корисними для зниження маси тіла, що може зменшити ризик серцево-судинних захворювань.
Наше дослідження досліджує, чи впливає добавка олії амаранту та ріпаку на окислювальний метаболізм у пацієнтів із ожирінням під час обмеження калорій. Гіпотеза полягає в тому, що завдяки своїм гіполіпідемічним та антиоксидантним властивостям олія амаранту та ріпаку покращить функцію нейтрофілів (що відображається окислювальним сплеском) від осіб, які отримували в раціоні добавки олії амаранту/ріпаку.
Матеріали і методи
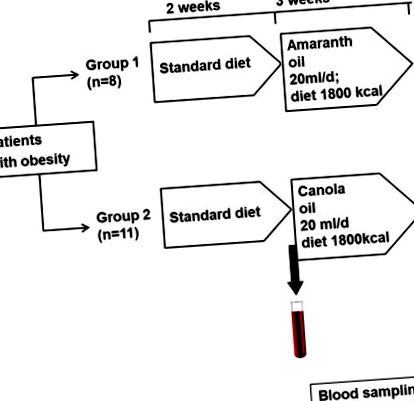
Пацієнтів розподілили випадковим чином у дві групи - 11 пацієнтів у маслі ріпаку та 8 у групі олії амаранту. Добавки отримували комерційні оливи (Ol’Amar, Co., Ломжа, Польща та VitaCorn Co., Познань, Польща). Олії давали пацієнтам у той самий час дня (в середині ранку), щоб уникнути циркадних впливів, а дієтолог контролював їх споживання. Протокол дослідження такий (рис. 1).
Зразки крові (2,5 мл) збирали в гепаринові пробірки літію. (1) Для вимірювання інтенсивності вироблення АФК до всіх зразків додавали дигідрородамін (123 DHR, Sigma, США) у концентрації 10 мкг/мл та інкубували у темряві (37 ° C) протягом 5 хв. (2) Стимулятор окисного вибуху, форбол 12-миристат 13-ацетат (РМА, Sigma-Aldrich, США), був доданий до зразків у концентрації 40 мкг/мл. Потім зразки інкубували в темряві та при кімнатній температурі протягом 15 хв. (3) До зразків додали 450 мкл розчину для лізису еритроцитів.
Дві аликвоти крові фарбували DHR (незаряджений показник АФК, що вимірюється потоковою цитометрією при окисленні до катіонного родаміну 123). Одну з аликвот стимулювали РМА (загальновживаний лабораторний засіб загального призначення, який індукує клітинну активацію гранулоцитів). Вимірювали середню інтенсивність флуоресценції як стимульованих, так і нестимульованих пробірок. Результати виражали як співвідношення інтенсивності флуоресценції (IF): IF DHR + PMA/IF DHR. Виробництво АФК вимірювали за допомогою цитометра BD FACSAria III (BD Biosciences, США), і всі результати аналізували за допомогою BD FACSDiva Soft wave (BD Biosciences, США).
Статистичний аналіз проводили за допомогою Statistica 12.5 (StatSoft, Талса, США). Значення виражали як середнє значення ± SD і порівнювали за допомогою критерію Вількоксона та t-критерію Стьюдента, тоді як для кореляції між різними параметрами використовували коефіцієнт кореляції Спірмена. Значимість була встановлена на p Рисунок 2. Окислювальний сплеск суттєво збільшився в кінці лікування в обох групах (рис. 3), і цієї суттєвої зміни не спостерігалось у групі, що додає масло амаранту (рис. 4). У таблиці 1 наведені зміни у вазі та складі тіла. У базовому стані не було значної різниці у віці, вазі та ІМТ. Маса тіла до і після прийому олії та обмеження калорій суттєво змінилася в обох групах р 0,05 (незначно).
Таблиця 1.
Окислювальний сплеск у базової лінії та в кінцевій точці перевіряли на кореляцію Спірмена з наступними коваріатами: (значення кінцевої точки - вихідне значення) для ваги (r = −0,23, p = 0,33), ІМТ (r = −0,3, p = 0,2), співвідношення талія/стегна (r = 0,44, p = 0,06), маса жиру в організмі (r = 0,07, p = 0,76), маса без жиру (r = −0,3, p = 0,2) та базальний рівень метаболізму (r = - 0,32, р = 0,16). Ніяких стосунків не спостерігалося.
Обговорення
Наше дослідження є першим, хто задокументував можливу модуляцію ріпакової олії на активність окисного вибуху в нейтрофілах в умовах in vivo. Цей результат узгоджується з іншими дослідженнями, які виявили посилений окислювальний сплеск у здорових молодих чоловіків після 8 тижнів прийому риб'ячого жиру (Gorjão et al. 2006; Bartelt et al. 2008). Масло каноли характеризується високим рівнем ПНЖК (Lin et al. 2013). Література про вплив дієтичних добавок з омега-3 ПНЖК на функції лейкоцитів не повністю узгоджується. Численні дослідження показали, що дієтичні добавки з омега-3 ПНЖК призводять до зменшення хемотаксичної міграції нейтрофілів (Sperling et al. 1993), збільшення генерації супероксидних аніонів (Chen et al. 1994). З іншого боку, кілька експериментів продемонстрували протилежні ефекти на функцію нейтрофілів: зменшення генерації супероксидних аніонів у нейтрофілах (Poulos et al. 1991). Механізми, за допомогою яких ПНЖК здійснюють свої імуномодулюючі дії, невідомі. Вважається, що імунодепресивний ефект спрацьовує через зміни у виробництві ейкозаноїдів (Kelley et al. 1999). Також пропонується, щоб ПНЖК опосередковували свій ефект за рахунок зміни експресії генів або структури мембрани (Szekely et al. 2007).
Оскільки рослина ріпаку містить велику кількість природних антиоксидантів, воно може чинити захисний ефект через пригнічення вироблення АФК. Вивчення рослини ріпаку Ву та співавт. (2015) показали, що більш високі рівні ендогенного флавонолу корелювали з вищими захопленнями АФК.
Наші висновки запропонували складну та багаторівневу систему регулювання. Потрібні подальші дослідження для визначення ролі Brassica napus у функції нейтрофілів.
На закінчення, у цьому дослідженні висловлено думку про імуностимулюючу дію на окислювальний сплеск після 3 тижнів прийому олії ріпаку у пацієнтів із ожирінням.
Заява про розкриття інформації
Автори не повідомляли про потенційний конфлікт інтересів.
Наявність даних та матеріалів
Дані, що підтверджують висновки цієї статті, включені до рукопису. Набір даних доступний у відповідного автора за запитом.
- Гречана надута амарантова крупа; Їстівна перспектива
- 011 Джейсон Вробель - Висока сировина, веганське життя для високої енергії
- C; R Market - Fulton Health; Оздоровчі статті 5 Порад щодо підтримання здорової ваги
- Новачок; s Керівництво з харчування; MariEasyFitness
- 5 продуктів, що підвищують енергію та можуть замінити добавки перед тренуванням