Зв’язок профілів експресії серцевих генів та ETS2 із мінливістю тривалості життя у щурів
Пов’язані дані
РЕЗЮМЕ
Вступ
Визначення генів, що сприяють збільшенню тривалості життя, є центральним для сучасних дослідницьких досліджень у галузі геронтології. Протягом останнього десятиліття дослідники виявили численні гени та варіанти генів, які збільшують тривалість життя в простих модельних системах, таких як S cerevisiae, C elegans та D melanogaster (Biteau et al., 2011; Partridge, 2011), і подальший аналіз в системах ссавців підтримує генетична основа довголіття. Однак тривалість життя залежить від виду та штаму, а тривалість життя лише частково знаходиться під генетичним контролем (Campisi and Yaswen, 2009; Rikke et al., 2010; Sinclair and Michan, 2007). Отже, обмеження в харчуванні, яке, як правило, сприяє довголіттю різних видів ссавців (Kapahi and Katewa, 2010), може також скоротити тривалість життя залежно від штаму (Nelson et al., 2010). Отже, довголіття у ссавців, за відсутності хижацтва або хвороби, є наслідком різноманітних генних дій та обмінних процесів, і в даний час неможливо апріорі знати, чи сприятиме певний генний продукт сприяти збільшенню тривалості життя (Martin, 2002; Zahn та ін., 2007). Ця невизначеність ускладнюється тим фактом, що деякі гени, пов’язані з довголіттям, можуть функціонувати специфічно для органу.
Для подальшого з'ясування молекулярної основи мінливості нормальної тривалості життя у ссавців ми постулювали, що КМ експресують унікальні набори генів, пов'язаних із виживанням. Щоб перевірити цю гіпотезу, ми дослідили експресію генів у серцях із трьох плям щурів з різною абсолютною тривалістю життя. Ми повідомляємо про ідентифікацію унікального набору генів, що передбачає смертність, та одного фактора транскрипції (TF), безпосередньо причетного до втрати СМ. Цей TF регулюється гетерогенно в КМ in vivo і спеціально сприяє запрограмованому некрозу in vitro, який, принаймні частково, сприяє серцевому компоненту неоднорідності довголіття, який спостерігається у щурів.
Результати
Аналіз мікрочипів та прогнозування генів, пов’язаних із довгім довголіттям
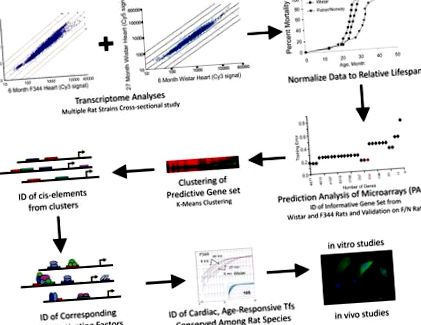
Для ідентифікації розшифровок зі зміненим достатком, що передбачають відносну тривалість життя, ми створили транскриптомічні профілі чоловічих сердець Fisher (F) 344 та Wistar щурів у залежності від віку (рис. 1 та S1A). Замість того, щоб просто повідомляти про суттєві відмінності та зміни складності ряду транскриптів, ми «виправили» абсолютну змінну «вік» на «відносну тривалість життя» та реорганізували всі дані мікрочипів у групи смертності (тобто класи) на основі кумулятивної ймовірності смерті в вказаний вік у кожній когорті щурів (рис. 1 та S1B, таблиця 1). Потім ми проаналізували реорганізовані та комбіновані дані від обох штамів, використовуючи варіант найближчої класифікованої стиснутої центроїдної класифікації, який називається Prediction Analysis of Microarrays (PAM), який спочатку був розроблений для класифікації та прогнозування діагностичних характеристик зразків раку. Ми спеціально застосували PAM для прогнозування груп смертності на основі профілів експресії генів та кривих відносної смертності (Schaner et al., 2003; Sorlie et al., 2003). Потім «навчання» PAM використовувалося для ідентифікації транскриптів генів, центроїд яких був стабільним у зразках того ж класу від щурів F344 та Wistar, а перехресна перевірка PAM використовувалася для статистичної ідентифікації мінімального набору генних транскриптів (n = 252), що найкраще характеризує кожен клас (рис. 2А). Помилки тесту PAM також були розраховані для точності прогнозування (рис. 2B).
Це дослідження було розроблене для використання наборів даних мікрочипів, нормалізованих до "відносної тривалості життя" для ідентифікації транскриптів генів, що передбачають групи довголіття. Дані були згруповані, ідентифіковані цис- та транс-фактори, а дані проаналізовані як функція смертності з використанням 3 штамів щурів. Отримані дані використовувались для ідентифікації незалежних від штаму та вікових ФТ, які імітували та, можливо, регулювали експресію інформативного набору генів. Були проведені функціональні аналізи, щоб визначити, як один фактор може сприяти мінливості довголіття у гризунів.
Таблиця 1
Вікові групи та групи відносної смертності
| Fisher 344 (F344) | 1–3 дні (NNCM) | ||
| 3 місяці (ACM) | 0% | ||
| 6 місяців | 6 | 0 | |
| 12 | 12 | 4 | |
| 18 | 18 | 8 | |
| 24 | 24 | 30 | |
| 30 | 30 | 80 | |
| Вістар (W) | 6 місяців | 6 місяців | 0% |
| 12 | 12 | 4 | |
| 18 | 17/18 | 8 | |
| 23/24 | 23/24 | 30 | |
| 27 | 27 | 80 | |
| Фішер × Браун Норвегія (F/N) | 2 місяці | 0% | |
| 6 місяців | 6 | 0 | |
| 12 | 4 | ||
| 16 | 8 | ||
| 24 | 20 | ||
| 32 | 30 | ||
| 36 | 36 | 80 |
Мікровимірювання проводили на збірних зразках серця щурів (n = 4), отриманих у зазначених віках. Порівняння проводили з 6-місячними щурами, які відповідали штаму, коли смертність, спричинена старінням, наближалась до 0%. Інше стосується аналізів, проведених на зразках тканин або клітин, отриманих із кардіоміоцитів щурів новонароджених (NNCM), дорослих кардіоміоцитів (ACM) або фібробластів щурів (rFbs) у зазначених вікових групах. Сюди входять qRT-PCR (F344, W та F/N щури), аналізи білка (F344 і F/N щури) або імуногістохімія (F/N), як описано в тексті.
Визначальною особливістю всіх 252 розшифровок, визначених ПАМ як функція групи смертності, була синхронізована форма (рис. 2С). Графічно, розшифровки у групі тварин, що живуть із смертністю 80% у кожному відповідному штамі (табл. 1), мали достаток, який був рівним або більшим, ніж виявлений у когортах при відносній смертності 4% (тобто, коли смертність по суті відсутня). Для групи відносної смертності 8%, коли передбачається виживання 92% когорти, розшифровки були менш рясними, ніж ті, що були виявлені в групі відносної смертності 4%, але лише 30 з 252 розшифровок значно зменшились (перший штам щурів (Fisher × Коричневі норвезькі (F/N) щури), які мають
На 50% більше тривалості життя, ніж у щурів F344 або Wistar (рис. 1 та S1B). Зокрема, ми використовували PAM для визначення ступеня подібності серед 36-місячних сердець F/N щурів (80% відносна смертність) та раніше змодельованих наборів мікрочипів щурів F344 та Wistar. Ми постулювали, що якщо центроїд набору генів "виживання" був стабільним у зразках того ж класу щурів Wistar та F344 (тобто незалежно від штаму та випадкової мінливості), тоді аналіз повинен правильно прогнозувати групу виживання третього штаму на основі повністю на збереженому профілі експресії тестового зразка. Результати цього аналізу показали, що схема експресії набору генів виживання 252, виявлена у щурів F344 та Wistar, насправді могла точно передбачити (із задньою ймовірністю, рівною одиниці, тобто 100% точною) 80% відносної смертності в 3 з 4 тесту групи щурів F/N, що відповідає 82% точності прогнозування, визначеної на основі тестів PAM (рис. 2B). Ці дані приводять нас до висновку, що цей набір генів насправді передбачає відносну смертність (тобто виживання) у серцях щурів, незалежно від штаму та випадкової мінливості.
Визначення загальних цис-елементів та трансрегулюючих факторів
Збережені профілі експресії генів «виживання» серед штамів дозволяють припустити, що генетичні компоненти (тобто цис-елементи та трансрегуляторні фактори) пояснюють унікальну схему експресії, що відображається цим прогностичним набором генів. Тому ми виявили передбачувані сайти зв'язування TF (тобто цис-регуляторні елементи) у відповідних промоторах генів гризунів (Dohr et al., 2005). Після тесту Gap та кластеризації K-засобів для сортування прогностичних транскриптів генів на 3 групи генів (рис. 1, таблиці S3 та S4) ми виявили загальні сімейства цис-елементів принаймні у 80% проксимальних промоторних областей (-500 до +100 щодо місця початку транскрипції) у кожному кластері (таблиця S5, рис. 2D). У кластері 1 80% генів містили сайти, що зв'язують TF, для членів сім'ї Ets, Creb, Nkx/Dlx, E-box та Irf. У кластері 2 збережені цис-елементи для сімейств Stat-, Ets- та Egr-TF були виявлені в 90% генів; а в кластері 3 місця поширення сайтів транскрипції сімейства Creb та Ets. Серед усіх трьох скупчень були збережені лише члени сім'ї Ets.
Коли ці аналізи поширили на щурів F/N, що відповідають тим самим групам смертності (табл. 1), 6 з 24 передбачуваних трансрегуляторних факторів продемонстрували значні зміни в ряді транскриптів, але лише чотири з цих мРНК (Ets2, Erg, Max та Msx2 ) суттєво змінила експресію у всіх 3 штамах (таблиця S6). З них лише Ets2 продемонстрував значну кореляцію (як зворотну залежність) з кожним кластером генів від кожної групи смертності для всіх трьох штамів щурів (рис. 2Е). Порівняно з групою відносної смертності 4%, кількість стенограм Ets2 завжди була вищою у 8%, але нижчою у групах відносної смертності 30 та 80%. Статистично цей профіль не відрізнявся (p = 0,7) від зворотної експресії Ets2 для будь-якої з 252 прогностичних транскриптів генів. Інші три TF позитивно корелювали з експресією генів в одному або двох штамах щурів, але не у всіх трьох (рис. S1D).
ETS2 у F344 та F/N Щурячі серця зі старінням
(A) Імуноблот та аналіз даних для ETS1 та ETS2 у серці щурів F344 з кожної групи відносної смертності (4, 8, 30 та 80%). (B) ETS2 імунозабарвлення тканин серця від F/N щурів у віці а) 2, b) 16, c) 24 та d) 32 місяців. ETS2 (коричневий) та TUNEL (фіолетовий), супутні фарбування серця у 16-місячних тварин, показані в e – g, а збільшення - у f та h. Темно-коричневе забарвлення в е ілюструє високий рівень ETS2, що спостерігається у вибраних регіонах міокарда. Стрілки позначають позитивні CM TUNEL (f). g та h показують позитивні несумісні позиції TUNEL без CM, які не мають сильного фарбування ETS2. (C) Імуноблот та аналіз даних щодо рівня чисельності білка ETS1 та ETS2 у rFB, NNCM та дорослих кардіоміоцитах лівого шлуночка (AdCM), p Рис. 3C). Більше того, фармакологічні агоністи, які, як відомо, впливають на ріст та функціонування КМ, тимчасово змінюють чисельність та експресію ETS2 виключно у NNCM. Фенілефрин (PE), ізопротеренол (ISO) та меншою мірою ангіотензин II (AngII) спричинили специфічні морфологічні зміни NNCM, але лише PE та ISO спричинили збільшення частоти биття клітин, що покриті покриттям. У цих самих клітинах кількість ETS2 значно зросла у 3 та 1,6 рази у відповідь на ISO (ANOVA, p = 0,006, n = 5) та PE (ANOVA, p = 0,004, n = 5) відповідно щодо загального білка протягом 24 годин після лікування (рис. 3D). Суттєвих змін у ETS2 не спостерігалось у СМ після лікування AngII. Подібним чином, жодних із цих агоністів у будь-який досліджуваний момент часу неможливо продемонструвати значних змін ні в мРНК Ets1, ні в Ets2 мРНК, ні в білку. Ці дані демонструють, що підвищення рівня регуляції ETS2 спостерігалося в СМ, але не в FB у відповідь на симпатичні агоністи, і що це вираження є більш поширеним у дорослих СМ, ніж у NNCM.
Підвищений рівень ETS2 сприяє загибелі клітин кардіоміоцитів
Програмований некроз, викликаний ETS2
Незалежні від каспази форми загибелі клітин можуть бути викликані ендонуклеазою G (Endo G), фактором, що індукує апоптоз (AIF), або білком А2 з високою температурою (HtrA2/Omi) (Bae et al., 2008; Siu et al. ., 2007). Всі три білки були виявлені в інфікованих NNCM; однак, неможливо продемонструвати жодної суттєвої зміни чисельності для будь-якого з цих факторів після надмірної експресії ETS2 (рис. S1F, p> 0,05). Несподівано як активні (57kDa), так і неактивні форми AIF (67kDa) спостерігались у заражених аденовірусом NNCM (рис. 5A), а підвищений рівень ETS2, зокрема, призвів до того, що AIF переміщувався з мітохондріальної фракції (неактивної) в цитоплазматичну та ядерну фракції (активний) (Рис. 5B, див. стрілки). Транслокацій Endo G або HtrA2 з мітохондріального в цитозольний або ядерний відсіки не спостерігалося (не показано). Кількісно вміст AIF збільшився на
У 2 рази в ядерній фракції NNCM, інфікованої Ad-ETS2, порівняно з контролем (p = 0,02, n = 4), і активний AIF легко спостерігався в цитоплазмі та ядрах цих клітин (рис. 5B, C). Таким чином, AIF, але не інші активатори незалежних від каспази форм клітинної загибелі, активується у відповідь на надмірну експресію ETS2 в NNCM.
Обговорення
У цьому дослідженні використані дані експресії генів та PAM для ідентифікації транскриптів генів, що передбачають відносну тривалість життя. Визначений тут набір генів показав «стабільну» експресію з унікальним профілем, який мав позитивний нахил у когортах тварин від 8% до 80% смертності. Теоретично цього профілю можна досягти за допомогою транскрипційних або посттранскрипційних механізмів. Щоб розрізнити ці можливості, ми використали компонент ПАМ для «тестування» (тобто прогнозування) групи смертності 80% 36-місячних щурів F/N на основі сукупного транскриптомного аналізу щурів Wistar та F344. Три "тести" PAM показали, що профіль експресії 252 прогностичного гена, встановленого у щурів F/N, суттєво корелював із групою смертності 80% інших двох штамів щурів (із задньою ймовірністю, рівною одиниці). Той факт, що це визначення на основі транскриптоміки могло ідентифікувати групу у штаму третьої щури з більш тривалим терміном життя, демонструє, що нормальні коливання кількості транскриптів серед зразків міокарда менш важливі, ніж збережені біологічні механізми, відповідальні за контроль змін у експресії генів, які відбуваються як функція тривалості життя, а не лише абсолютного віку.
Хоча ця інтерпретація потенційно заплутана мінливістю клітинного типу, різницею між РНК та вмістом білка та механізмами регуляції після транскрипції, ми виявили принаймні один TF (ETS2), експресія якого була сильно, але обернено корельована з 252 "стабільним" набором генів. Ми показуємо, що ETS2, який в основному експресується в СМ, демонструє вікові моделі вираження, реагує на симпатичні (PE та ISO) подразники та функціонально сприяє запрограмованому некрозу СМ. У дорослих серцях із 8% груп смертності з 3 штамів щурів ETS2 демонструє значну мінливість від клітини до клітини, а при високому рівні спостерігається спільне фарбування TUNEL. Такої кореляції не спостерігалося в жодній іншій дослідженій групі смертності. Механічно, опосередкована ETS2 втрата СМ включає активацію осі PARP1-AIF для активації запрограмованого клітинного некрозу і, можливо, вторинну активацію апоптозу. Оскільки вісь PARP1-AIF нерозривно пов'язана з некротичною сигналізацією, ми прийшли до висновку, що ETS2 спеціально активує цей сигнальний шлях у СМ для сприяння загибелі клітин in vitro та in vivo (Hong et al., 2004; Kung et al., 2011). З огляду на це, аденовірусна система, яку ми використовували для надмірного вираження ETS1 та ETS2, призвела до дуже високих рівнів (
50–100-кратний) виразу. Це призводить до питань про те, чи зміни в поведінці клітин мають відношення до дії білка на більш фізіологічних рівнях in vivo, і при інтерпретації цих даних слід дотримуватися певної обережності. Для вирішення цієї проблеми знадобляться майбутні експерименти з більш регламентованою системою. Незважаючи на ці обмеження, наші результати дають часткове пояснення, чому втрата СМ та клітин-попередників відбувається у молодих дорослих до 12-місячного віку (Anversa et al., 1990; Chimenti et al., 2003), до того, як смертність щурів зростає експоненціально.
- Доставка генів in vivo до легенів з використанням дентимерів поліетиленіміну та переломів поліамідоаміну -
- Як 5 хвилин на день можуть покращити ваше здоров’я та збільшити тривалість життя HuffPost
- Мезомасштабне моделювання виявляє ієрархічну циклічність хроматинових волокон поблизу генних регуляторних елементів
- Mod The Sims - ген жиру sims 3
- Експресія нікотинового рецептора під контролем MafA є важливою для секреції інсуліну та погіршується в