Зміни метаболізму глюкози після дистальної панкреатектомії: дослідження загальнодержавної бази даних
Цзінь-Мін Ву
1 кафедра хірургії, Національна лікарня Тайванського університету та Національний медичний коледж Тайванського університету, Тайбей, Тайвань, РПЦ
Те-Вей Хо
1 кафедра хірургії, Національна лікарня Тайванського університету та Національний медичний коледж Тайванського університету, Тайбей, Тайвань, РПЦ
Чін-Яо Ян
1 кафедра хірургії, Національна лікарня Тайванського університету та Національний медичний коледж Тайванського університету, Тайбей, Тайвань, РПЦ
По-Хуанг Лі
1 кафедра хірургії, Національна лікарня Тайванського університету та Національний медичний коледж Тайванського університету, Тайбей, Тайвань, РПЦ
Ю-Вень Тянь
1 кафедра хірургії, Національна лікарня Тайванського університету та Національний медичний коледж Тайванського університету, Тайбей, Тайвань, РПЦ
Анотація
Передумови
Це популяційне дослідження оцінювало зміни метаболізму глюкози після дистальної панкреатектомії (ДП).
Методи
Дані Тайванської національної бази даних досліджень медичного страхування збиралися з 2001 по 2010 рік. З 1980 пацієнтів, які перенесли ДП, 507 страждали на цукровий діабет, а 1410 не хворіли.
Результати
З 1410 пацієнтів, які не хворіли на цукровий діабет до ДП, у 312 (22,1%) після ДП розвинувся вперше діагностований діабет. Багаторазовий логістичний регресійний аналіз показав, що дисліпідемія [коефіцієнт ризику = 1,940; 95% довірчий інтервал = 1,362–2,763; Ключові слова: дистальна панкреатектомія, хронічний панкреатит, дисліпідемія, метаболізм глюкози, загальнодержавна база даних
ВСТУП
Дистальна панкреатектомія (ДП) - це стандартна хірургічна процедура резекції новоутворених та непухлинних уражень тіла підшлункової залози та хвоста [1]. Кількість процедур ДП останнім часом зросла через покращення у виявленні кістозних та прикордонних новоутворень підшлункової залози (більшість розвивається в дистальній частині підшлункової залози) [2, 3] та збільшення показників операцій на підшлунковій залозі при доброякісних або низькоякісних злоякісних пухлинах [4]. Крім того, ДП може полегшити біль від хронічного панкреатиту (ХП) в лівій підшлунковій залозі і, таким чином, поліпшити якість життя [5].
Підшлункова залоза відіграє важливу роль в метаболізмі глюкози за допомогою ендокринних гормонів і виділяє різні травні соки в дванадцятипалу кишку як екзокринна залоза [6]. Як такий, ДП може призвести до погіршення гомеостазу глюкози та екзокринної недостатності підшлункової залози (ЕПІ) через втрату паренхіми підшлункової залози. Панкреатектомія, асоційований із цукровим діабетом (СД), визначається як початок СД після панкреатектомії (панкреатогенної СД). Американська діабетична асоціація класифікує цей тип СД як "інший специфічний тип цукрового діабету" [7]. Частота панкреатогенної (тип 3c) СД коливається від 9% до 39%, залежно від ступеня ДП, а також основного захворювання [1, 8]. Більше того, асоційований ЕПІ після панкреатектомії може призвести до погіршення харчового статусу, що в свою чергу погіршує метаболізм глюкози [9].
Захворюваність на ендокринну недостатність підшлункової залози після ДП може зростати, оскільки період спостереження після операції стає довшим, і все більше ДП проводять для не злоякісних захворювань у молодих пацієнтів, які мають тривалу тривалість життя. Крім того, ДП, проведене при ХП, може бути пов’язане з більшою частотою розвитку недостатності підшлункової залози через втрату тканин підшлункової залози та попереднє/постійне пошкодження залишкової паренхіми підшлункової залози [10]. Однак деякі повідомлення вказують на те, що у багатьох пацієнтів нормальний рівень глюкози в крові натощак після операції після ДП є незначним і впливає на екзокринну функцію підшлункової залози [5, 11]. Крім того, у пацієнтів із СД перед ДП може спостерігатися погіршення метаболізму глюкози після ДП через втрату паренхіми підшлункової залози. На сьогоднішній день мало досліджень вивчали частоту розвитку панкреатогенного СД після ДП після резекції доброякісних або злоякісних захворювань підшлункової залози з тривалим періодом спостереження.
Метою цього дослідження було ретроспективно вивчити довгострокові зміни ендокринної функції підшлункової залози після ДП, використовуючи дані Тайванської національної бази досліджень медичного страхування (NHIRD).
РЕЗУЛЬТАТИ
Захворюваність на ендокринну недостатність підшлункової залози у суб’єктів, які не страждають СД після ДП
Таблиця 1
ОБГОВОРЕННЯ
Це дослідження показало, що у 22,1% пацієнтів, які перенесли ДП, розвинулася СД. ХП та дисліпідемія є двома важливими факторами, що сприяють розвитку ендокринної недостатності підшлункової залози після ДП. ХП - це захворювання, що характеризується прогресуючим запаленням підшлункової залози та фіброзною травмою, що спричинює незворотні пошкодження паренхіми та призводить до втрати ендокринної та екзокринної функцій [14]. Крім того, резекція підшлункової залози при ХП ще більше погіршує метаболізм глюкози, що чітко пов’язано із ступенем резекції паренхіми, а також з прогресуванням основного панкреатиту [15]. Порівняно з ДП для ХП, резекція пухлин підшлункової залози, мабуть, асоціюється з меншою частотою ендокринної дисфункції. Частота нової СД після ДП у пацієнтів без панкреатиту є відносно низькою, приблизно від 5% до 9% [1, 11, 16]. Для пацієнтів із ХП повідомлений ризик розвитку СД після ДП становить близько 22% –50%, що аналогічно нашим висновкам [5, 17–19].
Крім того, результати цього дослідження показали, що дисліпідемія є фактором ризику розвитку ДМ після ДП. Дисліпідемія є фактором ризику розвитку неалкогольної хвороби жирної підшлункової залози, яка може зменшити функцію β-клітин, ймовірно, через ліпотоксичність [20]. Деякі клінічні дослідження підтверджують зв'язок між жировою підшлунковою залозою та підвищеним ризиком розвитку СД [21, 22]. На відміну від цього, інші дослідження, в яких комп’ютерна томографія використовувалась для оцінки тяжкості жирової підшлункової залози, не підтверджують зв’язок між жировою підшлунковою залозою та СД [23, 24]. Ці суперечливі висновки можуть бути пов'язані з визначенням жирової підшлункової залози на основі методу візуалізації, раси, тривалості спостереження та пов'язаних метаболічних синдромів [25].
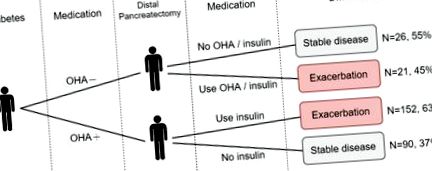
Крім того, були проаналізовані зміни метаболізму глюкози перед ДП ДМ без використання інсуліну, що показало погіршення обміну глюкози у 59,9% пацієнтів після ДП. Незважаючи на те, що, як очікувалося, такі випадки мали відносну дисфункцію метаболізму глюкози до ДП, погіршення метаболізму глюкози було клінічно значущим згодом, тому клініцисти повинні інформувати пацієнтів про цю інформацію, уважно контролювати параметри цукру в крові та належним чином коригувати антигіперглікемічні стратегії.
З розвитком обчислювальних та технічних методів у метаболомі як метаболіти амінокислот/похідних жирних кислот були затверджені як пов'язані з патогенезом діабету та пов'язаними з ними факторами ризику [28]. Підвищення рівня плазмових та ароматичних амінокислот у плазмі розглядалося не лише як маркер інсулінорезистентності, але й як прогностичний ризик розвитку діабету 2 типу [29, 30]. І навпаки, рівень гліцину та глутаміну у плазмі крові знижувався у пацієнтів з резистентністю до інсуліну [31, 32]. Серед метаболомів ліпідів довголанцюгові жирні кислоти та короткі та непарні ланцюги ацилкарнітинів сприяли патофізіологічним порушенням метаболізму глюкози [33, 34]. З клінічної точки зору, будуть потрібні подальші дослідження для повної інтеграції цих результатів у виявленні патофізіології діабету у хворих на ДП.
Заходи результату
Результатами цього дослідження були ендокринна недостатність підшлункової залози випадків, що не переносять ДМ, і погіршення метаболізму глюкози у випадків СД перед ДП без використання інсуліну. Ендокринна недостатність була визначена як новий діагноз СД після ДП. Для цілей цього дослідження СД визначали як два або більше відвідувань амбулаторних клінік або один прийом з діагностичним кодом СД (код МКБ-9-СМ 250) [42]. Це визначення ДМ було підтверджено в попередньому дослідженні NHIRD, в якому чутливість становила 93,2%, а позитивне прогнозне значення - 92,3% [44]. Застосування пероральних антигіперглікемічних засобів (ОГА) та інсуліну також вивчали з бази даних аптечних рецептів. Погіршення метаболізму глюкози визначали як ДМ перед ДП, що лікувався пероральним гіпоглікемічним препаратом, але без використання антигіперглікемічного препарату (АГМ; ОГА або інсулін), так і перед ДП, що лікувався ОГА та інсуліном після ДП.
Коваріати
Також були зібрані дані про супутню патологію пацієнтів до ДП. Супутні захворювання визначали за такими кодами ICD-9-CM: супутня спленектомія під час ДП (41,5), виразкова хвороба шлунка (531–535), дисліпідемія (272,0–272,2), ХП (577,1), ниркова недостатність (584.x – 586 .x), гіпертонія (401.x – 405.x) та рак підшлункової залози (157.0–157.9). Діагностичну точність раку підтвердила Реєстрація баз даних пацієнтів із катастрофічними захворюваннями, підрозділ NHIRD [42]. Індекс коморбідності Чарльсона розраховували для оцінки тяжкості супутніх захворювань для кожного пацієнта [45]. Досліджуваними демографічними характеристиками були стать, вік (≤49, 50-64 та ≥65 років) та щомісячний дохід (новий тайваньський долар ≤22 798 або> 22 798).
- Змінений метаболізм моноамінів при нервово-психічних змінах, спричинених дієтою з високим вмістом жиру, у щурів OMICS
- Вуглеводи в харчуванні риб впливають на ріст, метаболізм глюкози та печінкові ферменти - HEMRE
- Оцінка впливу гречаного напою на метаболізм глюкози після їжі на здоровий та T2D
- Нове дослідження виявляє, що сир може знизити рівень холестерину
- Використання анісу, переваги; Побічні ефекти - трав'яна база даних