Вживання безалкогольних напоїв та неалкогольна жирова хвороба печінки
Листування: Німер Ассі, доктор медичних наук, відділення печінки, медичний центр Ziv, поштова скринька 1008, Safed, 13100, Ізраїль. [email protected]
Телефон: + 972-4-6828441 Факс: + 972-4-6828442
Анотація
ВСТУП
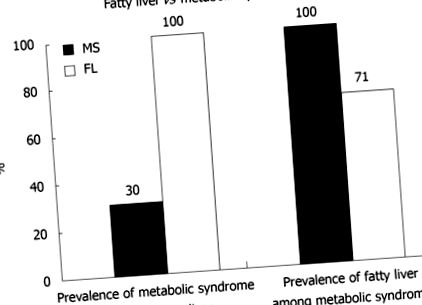
Безалкогольна жирова хвороба печінки (НАЖХП) є значною проблемою здоров'я, яка зачіпає 20% -30% дорослого населення [1]. НАЖХП може перерости в неалкогольний стеатогепатит (НАСГ), жирову печінку з гепатитом. Ця форма пошкодження печінки несе 20% -50% ризику прогресуючого фіброзу, 30% ризику цирозу та 5% ризику гепатоцелюлярної карциноми [2-4]. Хоча механізми, що лежать в основі прогресування захворювання, залишаються незрозумілими, вважається, що інсулінорезистентність та пов'язане з ожирінням запалення відіграють ключову роль, поряд з можливими генетичними, дієтичними та факторами життя. Зростаюча частота ожиріння у сучасних поколінь пов’язана з багатьма ускладненнями здоров’я на додаток до НАЖХП [5,6]. Сюди входять серцево-судинні захворювання, діабет, гіперліпідемія та гіпертонія. Це сузір’я визнано метаболічним синдромом. 70% пацієнтів з жировою печінкою мають метаболічний синдром, а 30% пацієнтів з метаболічним синдромом мають жирову печінку [7] (Рисунок (Малюнок1 1).
Таблиця 2
Вміст калорій та цукру в різних безалкогольних напоях
| Безалкогольні напої: вміст калорій (кількість калорій) | Безалкогольні напої: вміст цукру (кількість чайних ложок цукру) | ||||||
| 12- унція Можна | 20 унцій Пляшка | 64 унції Велика чашка | 12- унція Можна | 20 унцій Пляшка | 64 унції Велика чашка | ||
| Сункіст | 190 | 325 | 1040 | Скибочка апельсина | 11.9 | 19.8 | 63,5 |
| Mountain Dew | 165 | 275 | 880 | Монетний двір помаранчева сода | 11.2 | 18.7 | 59.7 |
| Доктор Перець | 160 | 250 | 800 | Mountain Dew | 11,0 | 18.3 | 58,7 |
| Пепсі | 150 | 250 | 800 | Корінь пива Barq | 10.7 | 17.8 | 57.1 |
| Кока-класика | 140 | 250 | 800 | Пепсі | 9.8 | 16.3 | 52.3 |
| Спрайт | 140 | 250 | 800 | Сквирт | 9.5 | 15.8 | 50,7 |
| 7-вгору | 140 | 250 | 800 | Доктор Перець | 9.5 | 15.8 | 50,7 |
| 7-вгору | 9.3 | 15.5 | 49.6 | ||||
| Кока-класика | 9.3 | 15.5 | 49.6 | ||||
| Спрайт | 9,0 | 15,0 | 48,0 | ||||
Додані підсолоджувачі в звичайних СД є важливою складовою нашого раціону, представляючи 318 ккал дієтичного споживання, або 16% від усього споживання калорій [17]. HFCS, отриманий ферментативною ізомеризацією глюкози до фруктози, був представлений як HFCS-42 (42% фруктози) та HFCS-55 (55% фруктози) відповідно в 1967 та 1977 роках, і відкрив нові межі для промисловості підсолоджувачів та SD.
Аспартам та карамель (барвник) також використовуються як підсолоджувачі у виробництві напоїв, головним чином у дієтичному SD [18]. Аспартам - це амінокислотна сполука, яка в 160 разів солодша за цукор. Аспартам всмоктується з кишечника і метаболізується печінкою з утворенням фенілаланіну, аспарагінової кислоти та метанолу. Аспартам може сприяти збільшенню ваги, ожирінню, резистентності до інсуліну та цукровому діабету 2 типу [18]. Нещодавно Браун та ін. [19] показали, що штучні підсолоджувачі можуть викликати секрецію шлунково-кишкового тракту глюкагоноподібного пептиду (GLP) -1, тим самим стримуючи апетит та споживання калорій.
Карамель виготовляється шляхом ретельно контрольованої термічної обробки вуглеводів, як правило, у присутності кислот і лугів, в процесі, який називається карамелізацією. Безалкогольні напої містять карамельний барвник, який багатий на вдосконалені кінцеві продукти глікування, що підвищують резистентність до інсуліну та запалення [9,10]. FDA встановила 200 мг карамелі на кг маси тіла як прийнятне щоденне споживання.
Дієта з високим вмістом фруктози спричинила жирову печінку у щурів та качок [20]. Такі дієти також спричинили збільшення перекисного окислення ліпідів у печінці та активацію запальних шляхів у печінці щурів [21]. Вроджена помилка метаболізму, відома як спадкова непереносимість фруктози, рідкісне захворювання, яке виникає внаслідок дефіциту ферменту, що метаболізує фруктозу, альдолази В, продемонструвало, що вживання фруктози може спричинити прогресуючі захворювання печінки у людей [22].
Всмоктуванню фруктози з кишечника в портальну кров сприяє транспортер глюкози-5 на межі кисті та базолатеральні оболонки тонкої кишки. Цей шлях всмоктування призводить до масивного поглинання фруктози печінкою. Фруктоза фосфорилюється фруктокіназою, утворюючи фруктозо-1-фосфат, який потім може бути перетворений у кілька молекул з трьох вуглецю, включаючи гліцеральдегіди, дигідроксиацетонфосфат та гліцеральдегід-3-фосфат (рисунок (рис.3). 3). Деякі з цих 3 молекул вуглецю можна перетворити в глюкозу за допомогою глюконеогенезу, або вони можуть бути використані для отримання інших продуктів, таких як тригліцериди (TG).
Обмін фруктози в печінці. Метаболізм фруктози в печінці починається з фосфорилювання фруктокінази. Вуглець фруктози надходить у гліколітичний шлях на рівні триозного фосфату. Таким чином, фруктоза обходить головний контрольний пункт, через який вуглець глюкоза потрапляє в гліколіз. Це дозволяє фруктозі служити нерегульованим джерелом гліцерин-3-фосфату та ацетил-КоА для печінкового ліпогенезу.
Другий метаболізм фруктози, тобто позапечінковий метаболізм, який обходить фруктокіназу, дозволяє вуглецю з фруктози потрапляти в гліколіз нижче за цим ферментом. 3 молекули вуглецю з часом можуть бути використані для синтезу гліцерину та жирних кислот, які завдяки етерифікації можуть утворювати TG.
ПАТОФІЗІОЛОГІЯ НАФЛД
Гіпотеза "двох ударів", запропонована Дей та ін. [26], залишається переважаючою патофізіологічною теорією. На думку авторів, перший "удар" описує чисте утримання ліпідів у гепатоцитах, переважно у формі TG, і є передумовою розвитку НАЖХП. Постійна доставка вільних жирних кислот до печінки внаслідок спланхнічного ліполізу вісцерального жиру (60%) або посиленого прийому жирної їжі (10%) у поєднанні з периферичною резистентністю до інсуліну та ліпогенезом de novo (30%) призводить до надмірного вмісту жиру накопичення та підвищена концентрація ефірів TG та холестерину в печінці. Висока концентрація ТГ у крові у вигляді ліпопротеїдів дуже низької щільності (ЛПНЩ) має тенденцію супроводжувати цей стан і індукує активність білка, що переносить ефір холестерину, що призводить до збільшення передачі ТГ від ЛПНЩ до ліпопротеїдів високої щільності (ЛПВЩ) і подальшого збільшення ЛПВЩ кліренс і зниження концентрації ЛПВЩ, що в підсумку призводить до стеатозу печінки [27].
Прогресування стеатозу до стеатогепатиту (НАСГ) пов’язане з іншими факторами (“другий удар”), такими як ліпотоксичність, запалення, окислювальний стрес та резистентність до інсуліну [26]. Споживання СД може виступати як першим, так і другим випадком у патогенезі НАЖХП. Нещодавно було висловлено припущення, що метаболізм холестерину може відігравати роль у накопиченні жиру в печінці, і що запалення може бути першим ударом, а потім накопиченням ТГ як другим ударом (www.easl.eu/bologna 2009).
СТІЙКІСТЬ ФРУКТОЗІ І ІНСУЛІНУ
Вживання фруктози збільшує концентрацію ТГ після їжі протягом 24 годин [28,29], що свідчить про те, що гіпертригліцеридемія після їжі є найранішим метаболічним збуренням, пов’язаним із споживанням фруктози. Найбільш вірогідним механізмом гіпертригліцеридемії після їжі є посилений печінковий ліпогенез de-novo (DNL), який, в свою чергу, підвищує рівень вироблення та секрецію ЛПНЩ [30].
Вживання фруктози може сприяти печінковому ліпогенезу насамперед тому, що печінка є основною ланкою метаболізму фруктози; по-друге, потрапляння фруктози в гліколіз через фруктозо-1-фосфат обходить основну стадію контролю швидкості гліколізу, каталізованого фосфофруктокіназою, забезпечуючи тим самим нерегульовані кількості ліпогенних субстратів ацетил-КоА та гліцерол-3-фосфату [30]; по-третє, фруктоза може активувати рецептор стеролу, що зв’язує білок-1c (SREBP-1c), незалежно від інсуліну, який потім активує гени жиру, що беруть участь у DNL [31,32].
Нещодавно Stanphone продемонстрував, що вживання напоїв, підсолоджених фруктозою, а не підсолоджених глюкозою, збільшує DNL, сприяє дисліпідемії, знижує чутливість до інсуліну та збільшує ожиріння вісцеральної системи у дорослих із надмірною вагою та ожирінням [33,34] (Рисунок (Рисунок 4 4).
Механізми згубного впливу фруктози.
Ouyang та співавт. [67] виявили, що пацієнти з НАЖХП мають істотно більше споживання підсолоджених напоїв в анамнезі, що становить у 2 рази більше споживання, ніж середнє споживання як в контролі, так і в популяційних дослідженнях. Другий їх висновок полягав у тому, що ключовий ініціюючий фермент у метаболізмі фруктози, KHK (кетогексокіназа), також був збільшений у 2 рази в біопсіях печінки цих пацієнтів порівняно з контролем [67]. Збільшення рівня KHK узгоджується з відомим ефектом фруктози на підвищення регуляції KHK у печінці щурів [68,69].
Пацієнти на дієті з високим вмістом фруктози або сахарози демонструють більшу реакцію сечової кислоти на болюс фруктози [70,71], що відповідає підвищенню активності KHK. Нарешті, рівень сечової кислоти може передбачити розвиток НАЖХП [72]. Існує також все більше доказів того, що підвищення рівня сечової кислоти може також мати потенційну роль у спричиненні особливостей метаболічного синдрому [73], зокрема завдяки здатності сечової кислоти руйнувати рівень ендотеліального оксиду азоту [74] та активуючи адипоцити [ 68]. Що стає фруктозою в нашій печінці? Фруктоза стає вільними жирними кислотами (будівельними елементами всіх ліпідів), перетворюється на ліпопротеїни ЛПНЩ і ТГ (найприємніші ліпіди, найбільш пов’язані із серцево-судинними захворюваннями) і перетворюється на сечову кислоту (окислювальний стрес, запалення судин, рис. 5).
ФРУКТОЗНИЙ І МЕТАБОЛІЧНИЙ СИНДРОМ
Рівен зазначав, що кілька факторів ризику (наприклад, дисліпідемія, гіпертонія та гіперглікемія) зазвичай об'єднуються у групи [75]. Це скупчення він назвав синдромом X, і він визнав його мультиплексним фактором ризику серцево-судинних захворювань (ССЗ). Інші дослідники використовують термін метаболічний синдром для цієї групи метаболічних факторів ризику. ATP III використовував цей альтернативний термін [76]. Окрім ССЗ та діабету 2 типу, люди з метаболічним синдромом сприйнятливі до інших захворювань, зокрема, до синдрому полікістозних яєчників, жирової печінки, холестеринових каменів у жовчному міхурі, астми, порушень сну, деяких форм раку, і пов’язано з прозапальним/протромботичним станом, який включає підвищений рівень рівні С-реактивного білка, ендотеліальна дисфункція, гіперфібриногенемія, підвищена агрегація тромбоцитів, підвищений рівень активатора плазміногену, підвищений рівень сечової кислоти, мікроальбумінурія та зсув у бік дрібних, щільних частинок ліпопротеїдів низької щільності [77].
Основні характеристики метаболічного синдрому включають інсулінорезистентність, абдомінальне ожиріння, підвищений артеріальний тиск та порушення ліпідів (тобто підвищений рівень TG та низький рівень холестерину ЛПВЩ).
Роль фруктози в інсулінорезистентності, гіперглікемії та ожирінні, які становлять важливі елементи метаболічного синдрому, обговорювались вище [77].
Вісцеральна жирова тканина та дисліпідемія, спричинені споживанням фруктози/сахарози, відіграють важливу роль у розвитку та прогресуванні метаболічного синдрому. Основна роль жирової тканини полягає в тому, щоб засвоювати надлишки жирних кислот, які забезпечуються раціоном, і зберігати їх у вигляді ТГ, які будуть використовуватися як запас енергії для організму в період голоду, однак жирова тканина має обмежену здатність запасати жир. Ця максимальна здатність може бути досягнута в станах ожиріння, що призводить до порушення здатності жирової тканини засвоювати дієтичні жирні кислоти і, отже, підвищений рівень жирних кислот виявляється в кровообігу [77].
Сигналізація про порушення в адипоцитах може також спровокувати ліполіз запасів ТГ і витік жирних кислот у кров, посилюючи проблему. Запропоновано присутність високих рівнів НЕФА у крові як ключовий механістичний зв'язок між ожирінням та резистентністю до інсуліну, діабетом 2 типу та метаболічною дисліпідемією. Зрештою, ці НЕФА можуть бути позачергово зайняті нежировими тканинами, такими як печінка та скелетні м’язи, де вони можуть зберігатися у вигляді ТГ або діацилгліцерину та впливати на метаболічні шляхи, такі як реакція на інсулін, сприяючи інсулінорезистентності та метаболізму. синдром [78].
Існують відмінності в метаболічних властивостях різних ділянок жирової тканини. Вважається, що вісцеральні або черевні запаси жиру становлять більший ризик для розвитку інсулінорезистентності та метаболічного синдрому, ніж запаси підшкірної жирової клітковини. Причини цього включають зниження чутливості вісцерального жиру до антиліполітичних ефектів інсуліну (через нижчу експресію та активність гормоночутливої ліпази, знижене фосфорилювання тирозину рецептора інсуліну, зниження експресії IRS-1 та підвищення активності PTP-1B); більша чутливість вісцерального жиру до ефектів катехоламінів, що викликають ліполіз; і зниження поглинання та ацилювання жирних кислот порівняно з підшкірним жиром, що призводить до посилення рівня NEFA в крові [79]. Вісцеральний жир також зручно розташований для цих НЕФА, щоб вони потрапили в портальний кровообіг для прямої доставки до печінки, де вони створюють ризик для реакції печінкового інсуліну.
Вживання фруктози може спричинити збурення в клітинних сигнальних та запальних каскадах у чутливих до інсуліну тканинах [25]. Внесок фруктози/сахарози у дисліпідемію обговорювався вище. Споживання такої великої кількості фруктози/сахарози може призвести до розвитку повного метаболічного синдрому, збільшуючи плазмові ТГ і змінюючи гомеостаз печінкової глюкози, набираючи вагу та знижуючи чутливість до інсуліну.
ВИСНОВОК
Застосування підсолоджувачів значно зросло у всьому світі, і безалкогольні напої, здається, є основним фактором ожиріння, цукрового діабету, гіперліпідемії, резистентності до інсуліну, гіпертонії, метаболічного синдрому та серцево-судинних захворювань. У цьому огляді ми прагнули зосередити увагу на впливі безалкогольних напоїв на накопичення жиру в печінці. Це має значні клінічні наслідки, оскільки наявність НАЖХП сильно корелює з діабетом, серцево-судинними захворюваннями та дифузним атеросклерозом.
Виноски
Рецензенти: д-р Венс Метьюз, доктор філософії, доктор біологічних наук, лабораторія клітинного та молекулярного метаболізму, Технічне відділення університету Бейкера, IDI, поштова скринька 6492, St Kilda Road Central, VIC 8008, Мельбурн, Австралія; Доктор Санг Геон Кім, доктор філософії, доктор філософії, професор, професор, голова фармацевтичного коледжу Сеульського національного університету, Сілімон-донг, Кванак-гу, Сеул 151-742, Південна Корея; Д-р Хуан Карлос Лагуна Егеа, Катедратична Фармакологія/професор фармакології, Unitat de Farmacologia/Фармакологічна лабораторія, Facultat de Farmàcia/Фармацевтична школа, Університет Барселони/Університет Барселони, Avda Diagonal 643, Барселона 08028, Іспанія; Фабріціо Монтекукко, доктор медичних наук, асистент відділення кардіології відділення внутрішніх хвороб Женевського університету, Avenue de la Roseraie 64, 1211, Женева, Швейцарія
S- Редактор Wang YR L- Редактор Webster JR E- Редактор Ma WH
- Ожиріння та неалкогольна жирова хвороба печінки Біохімічні, метаболічні та клінічні наслідки -
- Безалкогольна жирова хвороба печінки та серцева недостатність Чи є зв’язок
- Природна історія наслідків неалкогольної жирної хвороби печінки для клінічної практики та
- Безалкогольна жирова хвороба печінки Каліфорнійський чоловік діагностував дихальну недостатність і потрапив у
- Безалкогольні жирові захворювання печінки Аннали внутрішньої медицини