Вроджені лімфоїдні клітини на межі розділу між ожирінням та астмою
Летиція Евераере
1 Національний інститут сантезу та дослідницького медикалу, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
Саліха Айт Яхія
1 Національний інститут сантезу та дослідницького медикалу, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
Мелоді Буте
1 Національний інститут сантезу та дослідницького медикалу, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
Каміль Одуссе
1 Національний інститут сантезу та дослідницького медикалу, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
5 Clinique des Maladies Respiratoires et Center Hospitalier Régional et Universitaire de Lille, Лілль, Франція,
Сесіль Шенівес
1 Національний інститут сантезу та дослідницького медикалу, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
5 Clinique des Maladies Respiratoires et Center Hospitalier Régional et Universitaire de Lille, Лілль, Франція,
Енн Цикопулос
1 Національний інститут сантезу та наукового дослідження Медикале, Лілль, Франція,
2 CNRS, UMR 8204, Центр інфекції та імунітету м. Лілль, м. Лілль, Франція,
3 Інститут Пастера де Лілля, Лілль, Франція,
4 Університет Лілля, Лілль, Франція,
5 Clinique des Maladies Respiratoires et Center Hospitalier Régional et Universitaire de Lille, Лілль, Франція,
Резюме
Скорочення
Ожиріння та астма
Внесок адаптивних реакцій, викликаних метаболічними змінами, у подальшому розвитку експериментальної астми залишається суперечливим. Відповідь Th17 спостерігається при обох захворюваннях, 37, 38, 39, тоді як відповідь Th2 дорівнює 40, 41, 42 або не 43,44, виявлена при астмі, викликаній алергенами, що посилюється ожирінням, спричиненим дієтою. Тим не менше, інтерлейкін-33 (IL-33) та IL-25, два цитокіни pro-Th2, що продукуються як AT 45, 46, так і клітинами епітелію легенів 47, 48, можуть активувати вроджені лімфоїдні клітини групи 2 (ILC2). 49
Вроджені лімфоїдні клітини
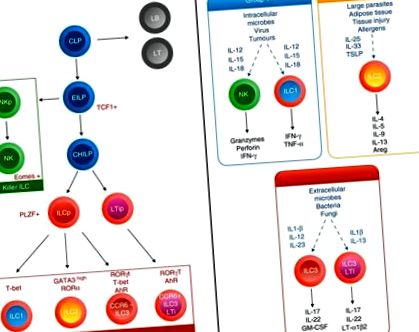
Вроджені лімфоїдні клітини були предметом інтенсивного дослідження протягом останніх 5 років і стали ключовими гравцями імунної відповіді в різних тканинах, включаючи вісцеральну АТ та легені. На даний момент 50, 51, 52 ВМК поділяються на три групи, які визначаються їх виробленням цитокінів та їх вираженням головного фактора транскрипції, у різкій кореляції з аналогами Т-хелперів 49 (рис. (Рис. 1). 1). Однак, на відміну від Т-хелперних клітин, ILC не експресують антиген-специфічні рецептори і не мають загальних маркерів клітинного походження, але реагують на викликані пошкодженнями сигнали, такі як тривоги та цитокіни, і можуть формувати адаптивну імунну відповідь.
Онтогенез та функції лімфоїдних ліній. Нижче за загальним лімфоїдним попередником (CLP) ранній вроджений лімфоїдний клітин (ILC) Родоначальник (EILP) ініціює експресію TCF 1 і може диференціюватися або в клітини природних кілерів (NK), або в високопоширений ILC-попередник Id2 (CHILP) ). Відповідно до вираження PLZF чи ні, це призведе або до всіх допоміжних підмножин ILC, включаючи CCR 6 + ILC 3, або до ILC 1, ILC 2 і CCR 6 - ILC 3. Екологічні цитокіни, а також диференціальна транскрипція ILC фактори програмують їх продукцію та функцію цитокінів.
ILC групи 1 (ILC1) включає підгрупу клітин природних кілерів (NK) та неклітинних клітин ILC1, що відрізняються комбінацією маркерів, включаючи відсутність експресії CD127 та експресії еом для зрілих NK-клітин. 53 Вони продукують цитокіни інтерферон-γ (IFN-γ) та фактор некрозу пухлини-α, експресують фактор транскрипції T-bet та опосередковують імунну реакцію на патогени та пухлини у відповідь на IL-12, IL-15 та IL-18. 54
ILC групи 2 (ILC2) виробляють IL-4, IL-5, IL-13, IL-9 та амфірегулін, експресують фактори транскрипції GATA3 та RAR-пов'язаний рецептор-сироту α та опосередковують реакції на паразитів та алергени у відповідь на IL-33., IL ‐ 25 та тимусний стромальний лімфопоетин (TSLP). 52
ILC групи 3 (ILC3) охоплюють різні підгрупи клітин, включаючи мишей, індуктори лімфоїдної тканини CCR6 + (LTi) та дорослі LTi-подібні клітини, а CCR6 - природний цитотоксичний рецептор (NCR) + або NCR - ILC3. У людини CCR6 + ILC3 поділяються відповідно до їх експресії NKp44. Вони продукують цитокіни IL-17 та/або IL-22, експресують фактор транскрипції, пов'язаний з ретиноїдами сировинний рецептор γt та арилвуглеводневий рецептор, і опосередковують імунітет слизової оболонки проти бактеріальних та грибкових інфекцій, зокрема на рівні кишечника, у відповідь на IL‐ 1β та IL-23. 55
Усі підмножини ILC залежать від сигналізації загального γ-ланцюгового рецептора і розвиваються із загального лімфоїдного попередника, знайденого в печінці плода та в кістковому мозку, що дасть початок ранньому попереднику ILC, здатному диференціюватись або в NK-клітинах, або через висхідні регуляція інгібітора фактора транскрипції ДНК-зв’язуючого білка 2 (Id2) у загальний хелпер-попередник ILC (CHILP) (рис. (рис. 1). 1). Прихильність до подальшого перебігу ILC досягається завдяки широкому діапазону факторів транскрипції, включаючи Т-клітинний фактор-1 (TCF-1), ядерний фактор IL-3 (NFIL-3), асоційований із виділенням тимоцитів HMG-бокс-білок (TOX), GATA ‐3 56, 57, 58, 59, 60, що спричиняє або промієлоцитарний лейкоз цинковий палець (PLZF), що експресує попередник ILC (ILCP), 61, або попередник LTi. ILCP генерує всі підгрупи ILC, крім LTi-подібного ILC3 (рис. (Рис. 1). 1). Цікаво, що ILCP, здатний породити всі підмножини ILC, крім IL ‐ 17 + ILC3, нещодавно були описані в периферичній крові у людей, підтримуючи модель диференціації тканин у відповідь на місцеві екологічні сигнали. 62
Нещодавні транскриптомічні дослідження показали, що підмножини ILC демонструють певний ступінь неоднорідності 63, 64, 65 та пластичності, що дозволяє переключатися між підмножинами залежно головним чином від місцевого середовища цитокінів. Наприклад, ILC1 може еволюціонувати до ILC3 у присутності IL-2, IL-23 та IL-1β, а дендритні клітини CD14 + (DC) можуть диференціювати ILC3 у ILC1. 66 Також показано, що ILC2 піднімається до ILC1-подібного продуценту IFN-γ у присутності IL-1, IL-12 та IL-18, 67, 68, 69, а ILC1 може повернутися до ILC2 у присутності IL-4 . 70 Крім того, повідомляється, що потенційний попередник ILC2, індукований IL-25, спричинює виникнення IL-17-продукуючих ILC3-подібних клітин. 71
Регуляторні шляхи також відіграють роль у контролі активації ILC2. IFN типу I та II, а також IL-27 здатні блокувати активацію ILC2 у відповідь на IL-2, IL-25 та IL-33 через перетворювач сигналу та активацію шляху, що залежить від транскрипції 1 (STAT1), 72, 73 відкриваючи нові шляхи для конкретної цільової терапії.
Лімфоїдні клітини при ожирінні
Вроджені лімфоїдні клітини (ВМК) у вісцеральній жировій тканині. В умовах гомеостазу вісцеральна жирова тканина інфільтрується ILC 2 у відповідь на місцевий інтерлейкін-33 (IL-33) та IL-25. Виробляючи IL-5 і IL-13, вони активують, з одного боку, еозинофіли, а з іншого боку по черзі активують макрофаги типу М2, що призводить до зародження адипоцитів. Природні Т-клітини-вбивці також беруть участь у гомеостазі завдяки активації еозинофілів та Т-регуляторних клітин. ILC 1 і ILC 3 також присутні, хоча їх функція на початковому рівні незрозуміла. При ожирінні ILC 2 та потенційно ILC 3 зменшуються, тоді як ILC 1 збільшуються у відповідь на місцевий IL-12. ILC 1 активує класично активовані макрофаги типу M1, що сприяють підвищенню стійкості до інсуліну, пов’язаному з ожирінням. Можливо, зменшення кількості ILC 2 може відбуватися внаслідок перетворення ILC 2 в ILC 1 або інгібування ILC 2 ILC 1 та природних клітин-кілерів через їх вироблення інтерферону-γ.
Лімфоїдні клітини при астмі
Погоджуючись з роллю ILC2 у відповідях типу 2, 74, 91, 92 ILC2 сприяють експериментальній астмі на такі алергени, як папаїн, альтернаріоза або кліщ домашнього пилу, індукуючи еозинофілію легенів, вироблення слизу та AHR через їх швидку продукцію IL ‐13 та IL-5, при стимуляції IL-33, IL-25 або TSLP, в основному отримані з епітеліальних клітин. 93, 94, 95, 96 На моделях персистенції хронічної астми (більше 6 місяців) лише виснаження ILC2, але не Т-клітин CD4, зменшує стійкість до AHR. 97 Більше того, у моделі кортикорезистентного запалення дихальних шляхів кортикостероїди можуть пригнічувати клітини Th2, але не ILC2, кортикоїдна стійкість ILC2 індукується TSLP. 98
Ці спостереження були підтверджені при астмі у людей. ILC2 збільшується в периферичній крові у пацієнтів з астмою, 99, 100, 101, 102, а також у мокроті, 102 та бронхоальвеолярних промиваннях, 97, 103 порівняно з контрольними суб'єктами. Крім того, частота ILC2 у крові 100 у хворих на астму була обернено корельована з тестами функції легенів, вказуючи на функціональний зв'язок між ILC2 та тяжкістю астми. ILC2 також бере участь у стійкій до стероїдів астмі. Кількість ILC2, що виробляє цитокіни ILC2, та типу 2, значно збільшується у периферичній крові та мокроті системних стероїдно-залежних пацієнтів із важкою астмою порівняно з тими, хто має легку астму. 102 На відміну від цього, кількість CD4, що продукує цитокіни типу 2, є подібною між двома групами, що свідчить про те, що ILC2, а не CD4 Т-клітини, відіграють значну роль у стійкій до стероїдів астмі.
Примітно, що ганчірка -/- (без клітин Т і В), але не ганчірка -/- IL2rg -/- (відсутність Т, В та КМП) або ганчірка -/-, виснажені у ВМК, мають астматичні симптоми, спричинені папаїном, 95 припускаючи, що адаптивний імунітет не є важливим для розвитку алергічного запалення.
Можливо, що ILC діють як раннє джерело цитокінів, що дозволяє розвивати адаптивний імунітет, як пропонують дослідження, що показують знижену сенсибілізацію та диференціацію клітин Th2 за відсутності ILC2 на моделях алергічного запалення дихальних шляхів. 104 Основні наслідки виснаження ILC2 можуть також виникати внаслідок виявлених властивостей MHC-II-обмеженого представлення антигену та подальшого продукування IL-2 Т-клітинами, що призводить до взаємного збільшення продукції цитокінів типу 2. 105, 106 Відповідно до цього, при індукції алергічного запалення дихальних шляхів відсутність ILC2 у химерних мишей Rorα sg/sg кісткового мозку призводить до сильного зменшення кількості еозинофілів бронхоальвеолярного промивання, експресії легенів IL-13, а також рівня IgE . 107 Адоптивний перенос обох ILC2 і CD4 + Т-клітин, але не кожної окремої популяції, у мишей Il7ra -/-, яким не вистачає як Т-клітин, так і ILC2, призводить до стійкої антигенспецифічної відповіді цитокінів Th2 та запалення дихальних шляхів. 108 Крім того, вироблення IL-13 за допомогою ILC2 під час відповіді на виклик викликає інтерферон-регулюючий фактор-4-експресуючі DC в легені, здатний стимулювати накопичення клітин Th2 клітин. 109
ILC2 можна регулювати під час алергічного запалення легенів позитивним чи негативним чином. Наприклад, IL-4, що походить від базофілів, активує ILC2 легенів, 110, тоді як активовані IL-33 тучні клітини розширюють регуляторні Т-клітини, які пригнічують активацію ILC2. 111 При запаленні легенів, спричиненому альтернаріозами, IL-27 може інгібувати клітини ILC2, що перебувають у тканинах, але не клітини Th2. 73 Нарешті, ліпідні медіатори, такі як цистеїніллейкотрієни, простагландини та ліпоксини, також можуть відповідно активувати або інгібувати ILC2. 112, 113, 114
Окрім ILC2, недавня робота показала, що NCR - ILC3 також індукується в легенях мишей із запаленням дихальних шляхів, викликаним кліщем домашнього пилу. 42 У людей у пацієнтів з астмою у бронхоальвеолярній промивній рідині виявлено IL-17, що продукує ILC3. 115 Для ILC1 жодна робота ще не оцінила їх потенційну роль у астмі, за винятком NK-клітин, основне призначення яких досі незрозуміле.
В цілому, ILC2 легенів та, мабуть, ILC3 відіграють ключову роль у ініціюванні, загостренні та хронізації астми (рис. (Рис. 3), 3), на відміну від ожиріння, де AT ILC2 є корисним для метаболічного гомеостазу. Однак ожиріння асоціюється із збільшенням ризику та тяжкості астми.
Вроджені лімфоїдні клітини (ВМК) при алергічному запаленні дихальних шляхів. У відповідь на алергени протеазного типу епітеліальні клітини дихальних шляхів виділяють цитокіни, такі як інтерлейкін-25 (IL-25), IL 33, тимусний стромальний лімфопоетин (TSLP) та IL-1β, які всі активують ILC 2. Активована ILC 2 виробляє тип 2 цитокіни, такі як IL-4, IL-5, IL-9 та IL-13. Потім вони активують клітини Т-хелперів типу 2 (Th2) або безпосередньо, через експресію MHCII, або через дендритні клітини. В цілому вивільнені цитокіни сприяють різним особливостям астми, включаючи гіперчутливість дихальних шляхів, накопичення еозинофілів та вироблення IgE. IL-1β, що продукується епітеліальними клітинами або альвеолярними макрофагами, також може активувати ILC 3, що призводить до продукції IL-17, сприяючи рекрутингу нейтрофілів. ILC 3 може також потенційно активувати клітини Th17.
Лімфоїдна клітина: зв’язок між ожирінням та астмою?
Деякі дані свідчать про те, що ІМК також беруть участь у алергічному запаленні дихальних шляхів, пов’язаному з ожирінням. У легенях ожирілих мишей, які харчувались жирною дієтою, було виявлено підвищену кількість ILC3 у порівнянні з нежирними мишами. 119 У цих мишей з ожирінням виявляли AHR за відсутності алергенної реакції, яка не залежала від адаптивного імунітету, але у зв'язку з IL-17, що походить від ILC3. Дійсно, AHR, спричинений ожирінням, зменшувався у IL-17 -/- мишей або ганчірок -/- мишей, виснажених в ILC, і відновлювався шляхом передачі ILC3. Продукція інтерлейкіну-17 методом ILC3 залежала від запалення Nlrp3, стимульованого IL-1β, що походить від макрофагів. 115 Також було показано, що вплив озону призводить до збільшення рівня AHR у мишей із ожирінням порівняно з худими мишами. Цей ефект був викликаний збільшенням IL-33 та індукцією IL-13-продукуючої ILC2. 116
Перерозподіл вроджених лімфоїдних клітин (ILC) при ожирінні: зв’язок з астмою? Гіпотетичний механізм. На початковому рівні ILC 2 і ILC 3 знижуються в жировій тканині (AT), але присутні в легеневій тканині від ожирілих мишей, потенційно через перерозподіл ILC з AT в легені під впливом інтерлейкіну-1β (IL-1β). Це призводить до невеликої інфільтрації еозинофілів у легеневій тканині мишей із ожирінням. В контексті алергічного запалення дихальних шляхів спостерігається подальше збільшення ILC 2 і ILC 3 на рівні легенів, що може походити частково з жирової тканини, але також, ймовірно, з кісткового мозку та циркулюючих родоначальників, залучених продукцією IL - 33 та IL-1β, індуковані алергенною атакою. Це збільшення зумовлює подальше накопичення еозинофілів, активацію клітин Th2 і Th17, потенційно через презентацію антигену, та посилення особливостей астми.
В інших експериментальних дослідженнях ожиріння з подальшим викликом алергену, підвищеною еозинофілією кісткового мозку та змінами в торгівлі еозинофілами в дихальні шляхи при дієті з високим вмістом жиру та генетичними моделями ожиріння 40, 125 спостерігається припущення, що така змінена торгівля може брати участь при розвитку астми. В умовах стимуляції алергеном, яка запускає продукцію IL-33 в легені, в легені можуть бути залучені додаткові джерела ІЛЦ, такі як циркулюючі предки ІЛЦ, нещодавно описані у людей, 62 або родоначальників кісткового мозку (рис. (Рис. 4). 4). Взагалі, базальна інфільтрація ILC2 та ILC3 в легенях ожирілих мишей створила б основу для загострення астми під впливом алергену.
Хоча міграційна гіпотеза очікує подальших досліджень, вона може сприяти розвитку нових терапевтичних стратегій, таких як перенаправлення ILC2 на AT. Дійсно, відмітною ознакою ILC є швидка та антигеннезалежна активація, що встановлює їх як передбачуваних оркестраторів адаптивних реакцій, і як такі є цікавими терапевтичними цілями.
Розкриття інформації
Автори заявляють, що не мають конкуруючих інтересів.
- Вроджені лімфоїдні клітини в індукції ожиріння - ScienceDirect
- Порушення обміну речовин може посилити астму у дорослих із ожирінням
- Чи є епідемія ожиріння Самоа передвісником для інших країн, що розвиваються, НПР солі
- Наскільки погане дитяче ожиріння Невідкладна допомога AFC
- Як ваша особистість впливає на ваш ризик ожиріння