Вплив модифікованого короткочасного голодування та його поєднання з дієтою, яка підтримує голодування під час хіміотерапії, на частоту та тяжкість токсичності, спричиненої хіміотерапією, у хворих на рак - контрольоване перехресне пілотне дослідження
Анотація
Передумови
Це пілотне випробування мало на меті дослідити, чи зменшує короткочасне голодування (mSTF) частоту токсичності, спричиненої хіміотерапією, і чи зменшує початкова кетогенна дієта (КД) як дієту, яка підтримує голодування, дискомфорт, пов’язаний з голодуванням, та покращує відповідність.
Методи
У цьому контрольованому перехресному дослідженні пацієнти з гінекологічним онкологічним захворюванням, які проходили хіміотерапію з мінімум 4 циклами, голодували протягом 96 годин протягом половини своїх хіміотерапевтичних циклів і споживали нормокалорійну дієту під час інших циклів хіміотерапії. Споживання калорій під час mSTF було обмежено до 25% від щоденної потреби кожного пацієнта. Крім того, половина пацієнтів повинна їсти 6-денний нормокалорійний KD перед кожним періодом mSTF, щоб дослідити ефект придушення голоду KD. При кожній хіміотерапії оцінювали токсичність, спричинену хіміотерапією, дискомфорт, пов’язаний з голодуванням, склад тіла, якість життя, лабораторні показники та відповідність.
Результати
Тридцять пацієнтів у віці 30–74 років (медіана 54 роки) завершили дослідження. Під час mSTF показник частоти та ступеня тяжкості стоматиту [- 0,16 ± 0,06; 95% ДІ -0,28 - (- 0,03); P = 0,013], головні болі [- 1,80 ± 0,55; 95% ДІ -2,89 - (- 0,71); P = 0,002], слабкість [- 1,99 ± 0,87; 95% ДІ -3,72 - (- 0,26); P = 0,024], а загальний показник токсичності значно знизився [- 10,36 ± 4,44; 95% ДІ -19,22 - (- 1,50); P = 0,023]. Ми також спостерігали значно менше перенесення хіміотерапії після mSTF, що відображає покращену толерантність до хіміотерапії [- 0,80 ± 0,37; 95% ДІ -1,53 - (- 0,06); P = 0,034]. Значне зменшення середньої маси тіла на - 0,79 ± 1,47 кг під час mSTF не було компенсовано і залишалося до завершення дослідження (P
Передумови
Періоди навмисного посту практикуються у всьому світі, як правило, з традиційних, культурних чи релігійних причин. Голодування визначається як часткове або повне припинення прийому їжі на певний період. Існує безліч емпіричних та спостережливих доказів того, що модифіковане голодування під наглядом лікаря, яке триває від одного до 3 тижнів, ефективно для лікування ряду хронічних та гострих захворювань, наприклад, ревматизму, гіпертонії та метаболічного синдрому [1]. Недавні експерименти на тваринах показали, що короткочасне голодування (STF) перед хіміотерапією високими дозами різко зменшує токсичність, спричинену хіміотерапією, не послаблюючи терапевтичний ефект [2]. Гостра токсичність, спричинена хіміотерапією, може спричинити передчасне припинення лікування та зменшення дози хіміотерапії, і обидва вони є факторами ризику для гіршого терапевтичного результату. Ад'ювантні метаболічні дієтичні терапії під час лікування раку, такі як STF або кетогенна дієта (KD), нещодавно обговорювались і просувалися у великих газетах, телепередачах та Інтернеті, що робить його популярною темою.
У 2012 році Сафді та ін. [3] продемонстрували, що голодування протягом 48 годин сенсибілізувало клітини мишей, щурів та людської гліоми, але не первинні змішані клітини глії, до хіміотерапії. Того ж року Lee et al. [4] продемонстрували, що лікування в умовах голодування призвело до сенсибілізації 15 із 17 клітинних ліній раку ссавців до хіміотерапевтичних засобів і було настільки ж ефективним, як і хіміотерапевтичні засоби, затримуючи прогресування різних пухлин. У моделях нейробластоми на мишах цикли голодування та препарати хіміотерапії - але не лише лікування - призвели до довготривалого виживання без раку [3]. Нещодавня стаття Брандхорста та ін. [2] описав стресостійкість у мишей, яких годували стандартною дієтою або обмеженими харчовими обмеженнями протягом 3 днів або 60 годин натще до лікування високими дозами доксорубіцину. На відміну від мишей, що харчуються ad libitum, переважна більшість мишей натще (60 годин) вижили до 25 дня після хіміотерапії (16% проти 89%) і не виявляли видимих ознак стресу або болю, таких як знижена рухливість, розтріпане волосся, і згорблена поза. Раффагелло та ін. [5] показав подібні результати, а саме, що голодування протягом 48–60 год перед лікуванням етопозидом підвищує стійкість мишей.
Голодування викликає широкомасштабні зміни в метаболічних шляхах та клітинних процесах, включаючи зменшення інсуліноподібного фактора росту-1 (IGF-1) та глюкози. Це впливає на різні онкогени, включаючи RAS та AKT-сигнальний шлях, і призводить до зниження регуляції проліферації та росту клітин [6]. Експерименти на клітинних культурах показали, що здорові клітини захищені від токсичності лікування, тоді як пухлинні клітини стають більш вразливими до хіміотерапії під час короткочасного голодування. Це явище описується як диференціальна стійкість до напруг. Нормальні клітини переходять у альтернативний стан, що характеризується зниженим або відсутністю поділу клітин та стійкістю до множинних стресів, підвищенням рівня регулювання відновлення ДНК та індукованою аутофагією. Клітини пухлини не здатні активувати захисну реакцію, а шляхи росту залишаються постійно надмірно активованими. Таким чином, пухлинні клітини більш чутливі до хіміотерапії [4,5,6,7].
Міхалсен та ін. [12] продемонстрував у нерандомізованому дослідженні 209 пацієнтів, які страждають на хронічний біль, що STF не має серйозних побічних ефектів. Типові скарги, про які повідомлялося у початковий період голодування на рівні, який не заважав повсякденній діяльності, включають голод, втома, дратівливість, головний біль та запаморочення [8, 12, 13]. Дискомфорт, пов’язаний з голодуванням, спостерігався особливо у дні 2 та 3 голодування, коли метаболізм переходить у фізіологічний кетоз [13]. Голодування призводить до сильних нейроендокринних адаптацій, які нагадують метаболічні реакції на КД [14]. KD передбачає прийом режиму з високим вмістом жиру, адекватним вмістом білка та дуже низьким вмістом вуглеводів (
Методи
Навчання населення
Ми набрали дорослих жінок з першим діагнозом або першим рецидивом гістологічно підтвердженого гінекологічного раку на всіх стадіях та проходили неоад'ювантну або ад'ювантну хіміотерапію з мінімум 4 циклами того самого протоколу хіміотерапії з інтервалом від 3 до 4 тижнів, введених протягом 24 годин. Нашими критеріями виключення були: поточний стан недоїдання (скринінг харчових ризиків> 3, втрата ваги> 5% за останні 3 місяці, індекс маси тіла 2), порушення харчування, цукровий діабет, що проходить медикаментозну терапію, подагра, важкі серцево-судинні захворювання, вагітність або лактація, парентеральне харчування, введення стероїдів або блокаторів IGF-1-рецепторів. Пацієнти були зараховані в період з березня 2017 року по грудень 2017 року на кафедру гінекології та гінекологічної онкології Університетського медичного центру Фрайбург працівниками кафедри харчової медицини та дієтології. Усі учасники дослідження дали свою письмову інформовану згоду. Протокол дослідження був розглянутий та затверджений Комітетом з етики Університету Альберта-Людвіга у Фрайбурзі (313/16), і дослідження було зареєстровано на germanctr.de як DRKS00011610.
Дизайн дослідження та втручання
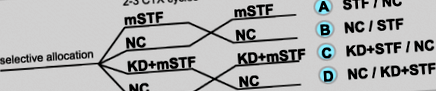
Дизайн перехресного дослідження для перевірки ефекту модифікованого короткочасного голодування (mSTF) протягом 2 або 3 циклів хіміотерапії (CTX) залежно від режиму CTX на токсичності, викликані CTX, порівняно з нормокалорійною дієтою (NC) протягом 2 або 3 циклів CTX в якості контролю та для перевірки впливу нормокалорійної кетогенної дієти (КД) з подальшим використанням mSTF на дискомфорт, пов’язаний з голодуванням, порівняно з лише mSTF
У той час як пацієнти в досліджуваних групах A і B отримували лише mSTF, пацієнти в досліджуваних групах C і D додатково отримували 6-денну нормокалорійну дозу перед кожним періодом mSTF. Як натщесерце, так і нормокалорійний КД призводять до подібних метаболічних змін [21], включаючи стан кетозу, який може придушити голод [16,17,18]. Відповідно, метаболізм натще індукували через КД перед кожним 4-денним періодом mSTF. Пацієнти у досліджуваних групах C та D отримували поради та рецепти дотримуватися KD ad libitum відповідно до власних харчових уподобань. Пацієнтам пропонувалось обмежити споживання вуглеводів максимум 20–40 г/день і отримувати щонайменше 75% загальної споживаної енергії з жиру. Вміст макроелементів протягом КД був таким самим, як і протягом періоду mSTF, за винятком вмісту енергії.
Оцінка результатів
Наші заходи безпеки спиралися на рекомендації, опубліковані 2013 р. Оновленням Експертної групи Консенсусних рекомендацій 2002 року щодо терапії натще [26]; вони включають лабораторні показники електролітів (натрій, калій, кальцій, магній), нирок (креатинін, азот сечовини, сечова кислота) та функції печінки (білірубін, аланінамінотрансфераза [ALT], аспартатамінотрансфераза [AST], лужна фосфатаза [ALP], і гамма-глутамілтрансфераза [GGT]). Щоб задокументувати відповідність режиму mSTF та переконатися, що контрольна група не голодувала, пацієнти були зобов'язані реєструвати щоденне споживання їжі та контролювати стан свого кетозу, фіксуючи щоденні вимірювання кетонів у сечі за допомогою смужок для самотестування (Ketostix®, Bayer AG, Швейцарія) протягом кожного циклу посту. Рівні кетонів у крові також перевіряли під час кожної хіміотерапії за допомогою тестового приладу, що називається FreeStyle Precision Neo Neu глюкози та кетону в системі контролю за допомогою β-кетонових тест-смужок крові (Abbott GmbH & Co. KG, Німеччина). Напівкількісні записи продуктів харчування аналізували за допомогою професійного програмного забезпечення (PRODI®expert v6.5, Nuri-Science GmbH, Німеччина). Під час наступного візиту було роздано спеціально розроблену анкету для оцінки суб’єктивних почуттів пацієнтів та доцільності цього пілотного дослідження.
Розрахунок обсягу вибірки та статистика
Оскільки це пілотне випробування, точного розрахунку обсягу вибірки зробити не можна. Однак наступні міркування щодо його корисності можуть виправдати вибір 40 пацієнтів у перехресній схемі з двома групами (NC проти mSTF або mSTF + KD) та бінарним результатом: ймовірність побічних ефектів III ступеня або вище. Ми припускаємо ймовірність побічних явищ 3 або вище ступеня 0,60 (джерело даних: дослідження GOIM 9902 [27]) з NC та 0,30 при голодуванні, тобто різниця у пропорціях 0,30. Далі ми припускаємо, що частка пацієнтів з різними результатами між NC та mSTF або mSTF + KD становила б 0,40 (суперечливі пари). Розмір вибірки 30 пар мав би 80% потужності для виявлення різниці пропорцій 0,30, коли частка суперечливих пар очікується 0,40, а метод аналізу - це тест Макнемара на рівність парних пропорцій з 0,05 двостороннім рівень значущості. Враховуючи можливість відсіву, нам знадобилося б 40 пацієнтів, щоб забезпечити достатню потужність.
Всі змінні були протестовані на нормальний розподіл (тест Колмогорова-Смірнова). Звичайно розподілені змінні представлені як середнє значення ± стандартне відхилення та порівнюються за допомогою двох вибірок т-тест на відмінності між групами втручання або парними т-тести на відмінності між базовим рівнем (T0) та подальшим спостереженням (FU). Незвично розподілені змінні відображаються як медіана (мінімум - максимум). Для незалежних груп використовували тест Манна-Уітні, а для парних груп - тест Уілкоксона.
Нашою головною метою було оцінити вплив модифікованого короткочасного голодування (mSTF) на токсичність, спричинену хіміотерапією, на основі ймовірності побічних явищ ІІІ ступеня та вище. Несподівано ми спостерігали лише дуже низький рівень захворюваності на CTCAE ступеня ≥ III протягом досліджуваного періоду, тому ми вирішили проаналізувати ймовірність токсичності ступеня I або II як бінарну змінну. Крім того, ми проаналізували ймовірність самостійних повідомлень про несприятливі події як безперервну змінну на основі системи бальних балів. Змінні, виміряні в декілька моментів часу (токсичність, спричинена хіміотерапією, склад тіла, перевірені анкети, параметри безпеки та відповідності), аналізували як результати за допомогою лінійної змішаної моделі, що відповідає схемі перехресної терапії, коли лікування (NC проти голодування) період і послідовність трактувались як фіксовані ефекти, а пацієнти - як випадкові ефекти. Ми також скоригували аналіз для призначення групи та хіміотерапевтичних засобів. Результати представлені у вигляді оцінок параметрів (PE), стандартних помилок (SD) та 95% довірчих інтервалів. PE представляє різницю для кожної змінної між циклами NC та циклами mSTF. Кількість циклів хіміотерапії моделювали як постійну змінну. Статистичне значення було встановлене P
Результати
Характеристика пацієнта
Блок-схема учасників дослідження від скринінгу критеріїв прийнятності до завершення дослідження
Комплаєнс та дієтичні склади
Фізіологічний кетоз крові (рівень кетонів у крові ≥ 0,6 ммоль/л) був виявлений у 71,4% (n = 40) з 56 циклів хіміотерапії. Стан кетозу суттєво відрізнявся між mSTF та NC (mSTF 1,27 ± 1,18 ммоль/л, NC 0,21 ± 1,98 ммоль/л; P Таблиця 2 Токсичність, пов’язана з хіміотерапією, згідно CTCAE (ступінь I/II), порівнюючи цикли mSTF (n = 56) з циклами NC (n = 62)
На додаток до частоти зафіксованих CTCAE побічних ефектів лікарями, пацієнти повідомляли про свої побічні ефекти, спричинені хіміотерапією, протягом тижня після хіміотерапії (Таблиця 3). Крім того, нижчі показники частоти та ступеня тяжкості головних болів, про які повідомили самі [- 1,80 ± 0,55; 95% ДІ -2,89 - (- 0,71); P = 0,002], показник частоти та тяжкості самопочуття слабкого відчуття значно зменшився протягом циклів mSTF порівняно з показниками NC [- 1,99 ± 0,87; 95% ДІ -3,72 - (- 0,26); P = 0,024]. Крім того, показник частоти та тяжкості загальної токсичності, про яку повідомляли самі, значно знизився протягом циклів mSTF порівняно з циклами NC [- 10,36 ± 4,44; 95% ДІ -19,22 - (- 1,50); Р = 0,023]. Ми не виявили суттєвих відмінностей у частоті та тяжкості побічних явищ між mSTF як окремо, так і в поєднанні з попередньою КД, як у задокументованих CTCAE, так і у токсикозах, викликаних хіміотерапією.
Незважаючи на той факт, що mSTF був безпечним, пацієнти повідомляли про побічні ефекти, пов'язані з голодуванням низького рівня. Загалом, найпоширеніші побічні ефекти, пов’язані з голодуванням, включали голод (n = 8), запаморочення (n = 5), слабкість (n = 4), і головний біль (n = 4).
На жаль, індукована хіміотерапією токсичність часто змушує пацієнтів відкладати хіміотерапію - додатковий і надзвичайно обтяжливий фактор стресу для пацієнтів. Ми порівняли кількість днів відстрочок під час циклів mSTF з циклами NC. Пацієнти відчували значно менше відстрочок хіміотерапії під час циклів mSTF [- 0,80 ± 0,37; 95% ДІ -1,53 - (- 0,06); P = 0,034], що відображає кращу толерантність до хіміотерапії.
Вага та склад тіла
Порівнюючи цикли mSTF з циклами NC, ми спостерігали значну втрату середньої маси жиру BIA [- 0,63 ± 0,23; 95% ДІ -1,09 - (- 0,17); P = 0,008], що призводить до значної втрати ваги під час mSTF [- 0,84 ± 0,26; 95% ДІ -1,35 - (- 0,33); P = 0,002]. Окрім жирової маси BIA, склад тіла залишався в середньому постійним. На відміну від наших базових показників, втрата маси тіла та маси жиру під час mSTF не врівноважувалась і залишалася суттєво зменшеною в кінці дослідження (P Таблиця 4 Параметри крові циклів хіміотерапії з короткочасним голодуванням або нормокалорійною дієтою, порівнюючи цикли mSTF (n = 56) з циклами NC (n = 62)
Хоча середній рівень натрію в крові був значно нижчим під час циклів mSTF, ніж під час циклів NC [- 1,17 ± 0,42; 95% ДІ -2,0 - (- 0,33); P = 0,007], середній рівень натрію залишався в межах контрольного діапазону. Всі інші електроліти залишалися незмінними протягом усього втручання. Монітуючи функцію нирок, ми виявили значно підвищений середній рівень сечової кислоти, що перевищує контрольне значення, під час mSTF [1,35 ± 0,17; 95% ДІ 1,01–1,68; P
Обговорення
Основною метою цього клінічного дослідження було оцінити вплив 4-денного mSTF з кетогенним складом макроелементів на токсичність, спричинену хіміотерапією, CTCAE III ступеня та вище у пацієнтів з гінекологічним раком. Вторинними цілями були оцінка токсичності CTCAE I/II, токсичності, про яку повідомляли самі, склад тіла, параметри крові та суб'єктивне благополуччя (QoL, CIPN та втома). Це перше клінічне випробування, яке вивчало вплив 6-денної нормокалорійної КД до mSTF як дієти, що підтримує голодування, на дискомфорт, пов’язаний з голодуванням.
Відповідно до попередніх досліджень натще у здорових дорослих, ми спостерігали легку втрату ваги (
Висновок
Підводячи підсумок, наші результати показують, що mSTF є безпечним та здійсненним для гінекологічних хворих на рак, однак це втручання вимагає високої мотивації. Більше того, mSTF під час хіміотерапії може зменшити токсичність, спричинену хіміотерапією, і поліпшити переносимість хіміотерапії. MSTF позитивно впливав на різні параметри крові та метаболічні параметри, зокрема IGF-1 та інсулін. 6-денний нормокалорійний КД до mSTF не виявив сприятливого впливу ні на токсичність, спричинену хіміотерапією, ні на дискомфорт та відповідність, пов'язані з голодуванням. Очевидно, що існує потреба у більших рандомізованих контрольованих дослідженнях, зосереджених на підтвердженні ефективності mSTF, що супроводжує хіміотерапію, як інноваційного, підтримуючого підходу.
Наявність даних та матеріалів
Набори даних, сформовані та проаналізовані під час дослідження, можна отримати у відповідного автора за обґрунтованим запитом.
- Звіт про вплив харчування, дієти та здоров’я на 2017 рік - Алабамаська кооперативна система розширення
- Стратегії прийому їжі можуть допомогти вам схуднути Постійні дієти під час посту - NDTV Food
- Плани здорової дієти, які найкраще підходять для періодичного голодування
- На скільки достатньо посту; Дієта натще; працювати Новини здоров'я споживачів HealthDay
- Дієта Дженніфер Еністон Ось як колишній Бред Пітт слідує періодичному голодуванню - Мікі Новини