Вплив харчових волокон та пребіотиків на регулювання ожиріння за допомогою модуляції мікробіоти кишечника
Анотація
Мікробіота незамінна для здоров'я людини та регулювання різних функцій організму, включаючи енергетичний обмін. Гармонічний перехресний зв’язок між мікробіотою та кишковим епітеліальним бар’єром визначає гомеостаз кишечника та стан здоров’я здорового суб’єкта. Ризик ожиріння та діабету 2 типу певною мірою пояснюється змінами мікробіоти. Оскільки останні дані вказують на те, що популяція кишкових мікроорганізмів може впливати на засвоєння поживних речовин та накопичення енергії, отже, поширеність ожиріння та метаболічних розладів. Більше того, метаболічні захворювання, такі як ожиріння, можуть стимулюватися генетичними факторами, факторами навколишнього середовища та шляхами, що зв’язують метаболізм з імунною системою. На підставі вищезазначених міркувань, цей огляд узагальнює поточні результати, отримані в останніх дослідженнях, що вказують на внесок мікробіоти кишечника у розвиток ожиріння.
Вступ
Поширеність ожиріння та діабету в розвинених суспільствах залишається однією з головних проблем охорони здоров'я у всьому світі, і частота його поширення значно зростає. Ожиріння виникає внаслідок накопичення надлишку жирової тканини; однак його етіологія складна, а симптоми неоднорідні через високу супутню патологію метаболізму, включаючи діабет 2 типу, що є супутньою патологією. Було припущено, що дієта має важливе значення в енергетичному балансі, а також відіграє фундаментальну роль у підтримці різноманітності та правильного функціонування нашої мікробіоти кишечника. Таким чином, відповідне дієтичне втручання, таке як дієта з високим вмістом клітковини, може покращити стан здоров'я завдяки регуляції мікробіоти у людей [1]. У цьому контексті маніпулювання мікробіоти пребіотиками стає можливим модифікатором мікробного профілю та може покращити стан здоров’я господаря, викликаючи корисні системні реакції та зменшуючи ожиріння [2].
Склад мікробіоти в кишечнику людини
Спільнота мікроорганізмів, заселена в людському тілі, відома як мікробіота. Концентрація кількості мікробних клітин у просвіті в десять разів більша, ніж клітини еукаріотичних клітин-господарів, що становить 1–2 кг ваги [3]. Мікробіота кишечника класифікована приблизно на 1000 різних видів [4]. Три відмінні домінанти тип було виявлено в кишечнику людини: Firmicutes, Bacteroidetes та Actinobacteria [5], на частку яких припадає приблизно 90% загальної кількості бактерій у кишечнику, головним чином у його кінцевій частині, товстій кишці. Різноманітна біохімічна активність цих бактерій має життєво важливий метаболічний внесок в організм людини, в якому організм не може виконувати самостійно [6].
Подібним чином мікробіота бере участь у гомеостазі особин, забезпечуючи ряд ключових функцій, таких як розщеплення не засвоюваних дієтичних полісахаридів, регулювання накопичення енергії, синтез вітамінів, модуляція імунної системи, а також має захисну дію кишковий бар’єр [13]. Отже, будь-який фактор або події, що впливають на одну з цих функцій, мають наслідки для інших і негативно впливають на весь організм. У сукупності ця стаття має на меті зібрати наукову літературу про значення мікробіоти для ожиріння та можливі механізми запобігання або лікування пандемії ожиріння.
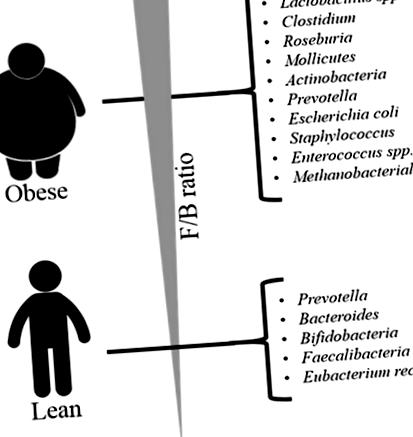
Змінений профіль мікробіоти кишечника при ожирінні
Короткий зміст збільшення складу мікробіоти кишечника у осіб, що страждають ожирінням та худорбою
Докази свідчать, що дієтичне втручання може покращити ожиріння, змінивши профіль мікробіоти. Як повідомляється, зелений чай та його продукти переробки, такі як чорний, разом із улунним чаєм, сприяють сприятливому метаболізму ліпідів та ефекту ожиріння [25]. Відповідно до цих висновків, Seo et al. показали прояви проти ожиріння ферментованих екстрактів зеленого чаю (FGT; 500 мг/кг; розчинені в 0,1% метилцелюлози) на мишах, у яких дієта з високим вмістом жиру (HFD), що годувалася ожирілими мишами, отримувала щоденне пероральне введення сухого зеленого чаю листя, зброджені Bacillus subtilis, тоді як контрольним групам вводили 0,1% метилцелюлози в якості носія. Результати показали, що 8-тижневе введення ФГТ різко знизило Firmicutes/Bacteroidetes співвідношення при зниженні рівня глюкози та ліпідів у плазмі крові. Більше того, дієтичне втручання зменшило експресію ліпогенних та прозапальних генів, тим самим запобігаючи гіперліпідемії [26, 27]. У сукупності передбачається, що модифікація мікробіоти кишечника за допомогою дієтичного втручання може бути перспективним терапевтичним ад'ювантом ожиріння.
Кореляція мікробіоти, ожиріння та пребіотиків
Дослідження на тваринних моделях ожиріння, спричиненого генетичним або дієтичним режимом, показали, що пребіотики можуть посилити кишкову бар'єрну функцію, толерантність до глюкози та модуляцію ліпідного обміну, одночасно зменшуючи збільшення ваги, жирову масу та запальний статус. Подібним чином він може регулювати вироблення кишкових гормонів за допомогою трофічного ефекту, що сприяє розвитку слизової оболонки [21, 28,29,30]. У таблиці 2 наведено підсумок досліджень пребіотиків на мишах та людських ключах.
Крім того, дослідження на мишах показали взаємозв'язок між енергетичним балансом, харчуванням та складом мікробіоти кишечника. Вважається, що на мікробіоти кишечника впливає накопичення поживних речовин, накопичення енергії та безліч метаболічних шляхів [5]. Мікробіота має значні біологічні ефекти в організмі людини; що стосується засвоєння поживних речовин, мікробіота метаболізує не засвоювані залишки їжі, такі як харчові полісахариди (наприклад, олігосахариди, стійкий крохмаль та фруктоза). Отже, різниця в метаболічній активності мікробіоти кишечника може призвести до змін у споживаних калоріях з харчових речовин, зберігання калорій у жировій тканині та доступності енергії для розмноження мікробів. Такі відмінності мікробіоти в кишечнику також пов’язані з варіацією енергетичного засвоєння людиною, що пояснює аспекти ожиріння, які можуть бути відповідальними за схильність людини до метаболічних порушень [24].
Більшість змін складу мікробіоти є оборотними, що припускає, що мікробіота особи є вродженою характеристикою [20]. Однак ці зміни у осіб із ожирінням (генетичні або індуковані дієтою) можуть бути скасовані шляхом перорального перенесення худих мишей кишкової мікробіоти [9, 10] або за допомогою дієтичного втручання пребіотиків [31]. Запалення, діабет, ожиріння та резистентність до інсуліну у мишей можна покращити шляхом трансплантації калу [21].
Тільки у тварин модуляція композицій мікробіоти може покращити масу тіла. Ожиріння тварин безмікробним мишам (GFM) та нежирним тваринам трансплантація мікробіоти призводить до ожиріння, тоді як спостерігається протилежне при перенесенні мікробіоти з худих тварин із ожирінням [11, 32, 33]. Наприклад, Turnbaugh et al. продемонстрував, що трансплантація калу об/об в GFM призвело до збільшення маси тіла протягом 2-тижневого періоду [10]. Так само Гудман та ін. провели дослідження з використанням мишей, яким трансплантували людську мікробіоти з худорлявих особин і годували дієтою з високим вмістом жиру та високим вмістом цукру, що призводило до збільшення Firmicutes та зменшення групи Bacteroidetes, пов’язаного з бактеріальним бродінням [34]. Відповідно до цих висновків, Bäckhed et al. показав, що GFM C57BL/6 після колонізації звичайними мишами дистальної мікробіоти збільшує ІМТ разом з резистентністю до інсуліну через 14 днів, одночасно зменшуючи споживання їжі, виявив, що мікробіота кишечника сприяє поглинанню моносахаридів, що призводить до індукції печінкового ліпогенезу de novo [20].
Пребіотики - це інгредієнти, вибірково ферментовані для сприяння корисним модифікаціям складу та/або активності мікробіоти шлунково-кишкового тракту і, отже, здатні надавати людям користь для здоров'я [28, 35, 36]. Зазвичай вони є «не засвоюваними» дієтичними елементами, але ферментуються мікробіотою кишечника, служачи джерелом енергії [37, 38]. Вплив пребіотиків на енергетичний гомеостаз та регуляцію насичення пов'язаний із зменшенням метаболічних розладів та частотою ожиріння [39, 40] (рис. 2). Хоча точні кореляційні зв’язки мікробіоти та ожиріння до кінця не відомі, маніпуляції з мікробіотами кишечника на основі дієти, особливо за допомогою пребіотиків та харчових волокон, можуть бути потенційним підходом для зворотного розвитку або профілактики ожиріння.
Кореляція пребіотичних добавок з мікробіотою кишечника та його вплив на ожиріння та метаболічний синдром
Виробництво коротколанцюгових жирних кислот за допомогою мікробіоти
Останнім часом харчові волокна зацікавлені завдяки виконанню корисних метаболічних функцій, включаючи вироблення SCFA мікробіоти кишечника. SCFAs впливає на ріст і диференціювання ентероцитів і колоноцитів. Енергія, видобута з харчових волокон мікробіотою, стає доступною для організму і дозволяє уникнути їх втрати в калі. Ферментація харчових волокон мікробіотою вивільняє SCFAs, такі як ацетат, пропіонат і бутират, загальна концентрація яких може досягати 130 мМ в товстій кишці [41, 42]. Тоді як бутират метаболізується головним чином колоноцитами; ацетат та пропіонат всмоктуються, досягаючи концентрацій від 300 до 450 мкМ у портальній крові та 50 та 100 мкМ у периферичній крові [16, 20, 43]. Ацетат є домінуючим типом SCFA у людини, і ці SCFAs, схоже, відіграють цікаву роль у модуляції активності протеїнкінази (PKA), що активується 5'-AMP-активованою протеїнкіназою (AMPK), разом з інфільтрацією макрофагів у жирову тканину [12].
На відміну від цього, синтез ліпідів або глюкози de novo ініціюється пропіонатом, виступаючи джерелом енергії для господаря. Більше того, бутират та пропіонат ініціюють кишковий глюконеогенез через вісь кишечника та мозку, сприяючи метаболічним перевагам у регулюванні глюкози та маси тіла [43]. SCFA можуть функціонувати як сигнали, отримані від мікробів, які впливають на метаболізм вуглеводів та фізіологію кишечника, стимулюючи секрецію гормонів, таких як грелін, та вивільнення більшого пептиду тирозину тирозину (PYY) та глюкагоноподібного пептиду-1 (GLP-1) під час подачі. як джерело енергії клітин епітеліального кишечника (рис. 3). Ацетат, зокрема, являє собою бажаний субстрат для глюконеогенезу та синтезу холестерину та тригліцеридів [28, 41, 44].
Взаємодія між SCFA, рецепторами GPR43 та GPR41. (1) Бактерії в кишечнику взаємодіють зі складними дієтичними вуглеводами, що утворюються SCFA шляхом гідролізу та бродіння; (2) Зв’язування між SCFA та рецептором GPR43 в ентероцитах сприяє вивільненню GLP-1, збільшуючи чутливість до інсуліну; (3) активація GPR43 через взаємодію SCFAs в адипоциті пригнічує вивільнення інсуліну, інгібуючи запаси жиру в жировій тканині; (4) Зв’язування з рецепторами SCFAs-GPR41 збільшує вивільнення PYY, зменшуючи розвиток ожиріння
Крім того, завдяки своїй ролі у відновленні енергії, SCFA є лігандними сполуками для G-білка, зчепленого з рецептором вільних жирних кислот 2 (FFAR2/GPR43) та 3 (FFAR3/GPR41). Ацетат вибірково активує GPR43 in vitro; пропіонат здійснює подібну активацію на GPR43 та GPR41; однак, бутират має активність за спорідненістю порівняно з GPR41 [45]. Ці рецептори беруть участь у регуляції апетиту та енергетичного обміну, що впливає на резистентність до інсуліну та ожиріння у людей. За даними Gao et al. добавки бутирату мишам DIO піднімали кишкові та циркулюючі SCFA, що призводить до придушення набору ваги, активації AMPK та посилення функції мітохондрій. Ці результати показали, що годування HFD разом з добавками бутирату індукованим дієтою мишам, що страждають ожирінням, зменшує і запобігає резистентності до інсуліну [46].
В якості альтернативи, стимуляція GPR43 сприяє накопиченню енергії, збільшуючи адипогенез, інгібуючи ліполіз в адипоцитах та зменшуючи витрати енергії [44]. Пропіонат, модулює енергетичний гомеостаз, сприяючи активації симпатичних нейронів, опосередкованих GPR41, на відміну від кетонових тіл [44]. Крім того, у порівнянні з дикими типами, нокаутовані тварини для GPR41 або GPR43 мають менше печінкових тригліцеридів та холестерину в плазмі, більшу чутливість до інсуліну та менший приріст ваги при харчуванні HFD [47]. Таким чином, кишковий епітелій або печінка в значній мірі використовують SCFA як джерело енергії для надання метаболічних переваг господареві, таких як придушення споживання їжі та стимуляція секреції гормонів кишечника, одночасно захищаючи від непереносимості глюкози та збільшення ваги, викликаного жирами.
Вплив пребіотиків на метаболічний синдром та ожиріння
Крім того, припускають, що пребіотики можуть чинити ефекти ожиріння за рахунок зменшення адипогенезу. Девульф та ін. спостерігали, що 4-тижневі дієтичні добавки мишей із ожирінням фруктаном інулінового типу (0,2 г/день/миша) зменшували експресію мРНК GPR43 у підшкірній жировій тканині, зменшували розвиток індукованої HFD жирової маси при одночасному посиленні ліполізу, покращуючи реакцію тканинного інсуліну. Згодом модулюється активація рецептора, активованого проліфератором пероксисоми (PPAR-γ), і зменшення експресії зв’язуючого білка CCAAT-енхансера (C/EBPα), ліпопротеїнової ліпази (LPL) та білка, що зв’язує жирні кислоти (FABP/ap2). Ці білки беруть участь у процесах накопичення ліпідів та диференціації адипоцитів в адипогенезі і, отже, представляють позитивну кореляцію зі зменшенням розміру адипоцитів та маси жиру. Отже, введення фруктану типу інуліну мишам, що годували HFD, призвело до важливого підвищення рівня біфідобактерій та протиділо всім індукованим HFD змінам, включаючи відновлення активності PPAR-γ та експресії GPR43. Однак специфічна модуляція мікробіоти кишечника, при якій інулін протидіє індукованому HFD PPAR-γ, залишається невловимою [51].
Про інші позитивні результати прийому пребіотиків при ожирінні у людей повідомляють Genta et al. при яких жінки із зайвою вагою та легкою дисліпідемією протягом 120 днів проходили програму схуднення (гіпокалорійна дієта + фізичні навантаження); У тих, хто включав до свого раціону сироп якону, багатий фрукто-олігосахаридами (ФОС) (достатньо, щоб забезпечити 0,14 г ФОС/кг маси тіла на добу), спостерігалося більше зменшення маси тіла, ІМТ та окружності талії. Що стосується біохімічних змінних, ця група жінок показала зниження значень HOMA-IR, інсуліну натще і холестерину ліпопротеїдів низької щільності. Автори підкреслюють, що ці результати не можуть бути віднесені виключно до добавок до ФОС, однак радили корисний ефект [60]. Незважаючи на те, що пребіотики, здається, є перспективними інструментами харчової стратегії зменшення ризику ожиріння або як допоміжний засіб при лікуванні цього клінічного стану завдяки здатності сприяти секреції ендогенних шлунково-кишкових гормонів, що беруть участь у регуляції апетиту. Потрібні подальші дослідження на людях, щоб підтвердити вплив харчових волокон на зменшення ожиріння, а також супутніх захворювань, пов’язаних із ожирінням.
- Вплив харчового досвіду в ранньому та дорослому житті на продуктивність та дієтичні звички
- Вправа щодо розподілу дієтичних калорій - регуляція ліпопротеїдів та холестерину в сироватці крові
- Вплив добавок кальцію на масу тіла та ожиріння у дорослих із надмірною вагою та ожирінням A
- Чай з кульбаби Путівник Користь для здоров’я, побічні ефекти та профіль смаку; Чайний бар Sencha
- Дати проти родзинок - користь для здоров’я, факти харчування, побічні ефекти