Вплив добавок L-карнітину на харчові, імунологічні та серцеві параметри у хворих на гемодіалізі: пілотне дослідження
Анотація
Передумови
L-карнітин є важливою сполукою, яка полегшує транспорт довголанцюгової жирної кислоти через внутрішню мітохондріальну мембрану для β-окислення. Однак вплив добавок L-карнітину ще слід повністю вивчити у пацієнтів з хронічними захворюваннями нирок. У цьому дослідженні ми мали на меті більш детально визначити різноспрямований вплив добавок L-карнітину на клінічні параметри.
Методи
Ми перорально вводили L-карнітин для підтримки рівня без сироватки карнітину в межах норми (від 30 до 70 мкмоль/л) протягом 6 місяців у 21 пацієнта на гемодіалізі (HD) (вік, 74 ± 11 років; час на HD, 60 ± 84 місяців).
Результати
Добавки L-карнітину значно збільшили рівень трансферину в сироватці зі 155 ± 41 до 175 ± 48 мг/дл (стор
Передумови
Витрата енергії білка (PEW) включає надмірні втрати білкової маси та енергетичних запасів, і це пов’язано з високою захворюваністю та смертністю у хворих на хронічну хворобу нирок (ХХН) [1]. Є багато причин PEW, такі як недостатнє споживання поживних речовин, збільшення втрат поживних речовин від діалізату, запалення, оксидантний стрес, карбонільний стрес, порушення анаболічних або катаболічних гормонів та ацидемія [1].
L-карнітин - це природна сполука, яка синтезується з лізину та метіоніну. L-карнітин має важливе значення при перенесенні довголанцюгових жирних кислот в мітохондрії для β-окислення. Коли розвивається дефіцит карнітину, довголанцюгові жирні кислоти недоступні для β-окислення або виробництва енергії, що спричиняє надмірне накопичення ліпідів в таких органах, як м’язи. Карнітин також необхідний для підтримки функції та морфології коричневої жирової тканини [2]. Приблизно 95% пулу карнітину присутній у скелетному та серцевому м’язах, 2–3% у печінці та нирках та лише 0,5–1% у позаклітинній рідині [3].
Діалізні пацієнти особливо схильні до високого ризику дефіциту карнітину через недостатнє споживання таких джерел дієтичного карнітину, як червоне м’ясо, знижений біосинтез у нирках та дифузні втрати від діалізату. У хворих на гемодіаліз (ГД) рівень карнітину в плазмі крові знижується протягом першого тижня лікування, постійно знижуючись протягом перших 12 місяців лікування [4]. Вміст карнітину в скелетних м’язах також зменшується у хворих на гемодіалізі і обернено корелює з часом на HD [4, 5].
Метаболізм скелетних м’язів залежить від карнітину, оскільки окислення жирних кислот є основним джерелом енергії в м’язових клітинах. Однак залишається повністю визначити, чи покращує додавання L-карнітину м’язову силу, фізичну працездатність та м’язові симптоми.
Метою цього дослідження є подальше з'ясування впливу добавок L-карнітину на клінічні параметри у хворих на ГД. Ми перспективно вводили L-карнітин перорально, щоб підтримувати рівень вільного карнітину в межах норми протягом 6 місяців, і більш детально вивчили вплив добавок L-карнітину на харчові, імунологічні, запальні та серцеві маркери.
Методи
Пацієнти
Це дослідження було проведено в одному діалізному центрі (Національна лікарняна організація Yanai Medical Center, Ямагучі, Японія). Спочатку до цього дослідження було залучено 26 пацієнтів із ЗН, які дали свою згоду. Не було жодного пацієнта, який би отримував будь-які добавки з L-карнітином до вступу. Дизайн дослідження був схвалений відповідними комісіями з перевірки етики установи, в межах якої проводилось дослідження, і він відповідав положенням Гельсінської декларації.
Всім пацієнтам регулярно проводили HD із застосуванням полісульфонових діалізаторних мембран з бікарбонатними буферами протягом 3 - 4 год тричі на тиждень.
L-карнітин
Спочатку ми модифікували початкову дозу перорального L-карнітину відповідно до сухої ваги (DW), щоб підтримувати рівень сироватки в межах норми без ризику, оскільки надлишок L-карнітину може бути перетворений кишковою мікробіотою в триметиламін-N-оксид (TMAO), потенційний промотор коронарного атеросклерозу [6]. Коли DW був вище 50 кг, ми спочатку вводили 400 мг/день один раз на день, тоді як коли DW коливався від 30 до 50 кг, ми вводили 300 мг/день. Крім того, якщо DW становив менше 30 кг, ми починали з дози 200 мг/день.
Потім ми вимірювали рівень карнітину в сироватці крові до предіалізу щомісяця протягом перших 3 місяців. Коли загальна концентрація карнітину перевищувала нормальну верхню межу (≥70 мкмоль/л), ми зменшували дозу на 100 мг на день до наступного вимірювання. На відміну від цього, коли рівень загального карнітину в сироватці крові був нижчим за нижню межу (аналіз вивільнення 51 Cr проти K562 (високодиференційована та гранулоцитна мієлолейкозна клітинна лінія від бластного кризису) як еталонних клітин-мішеней з 6-годинною інкубацією. Активність NK була виражається як співвідношення E (ефекторна клітина)/T (клітина-мішень) (контрольні діапазони; співвідношення E: T = 20: 1: 17,1–48,7% та співвідношення E: T = 10: 1: 8,9–29,5%). диференціація (CD) 4/CD8 була здійснена за допомогою проточної цитометрії з використанням FACSCalibur ™ (BD Biosciences, Сан-Хосе, Каліфорнія, США) та KX-21 (Sysmex, Кобе, Японія) .Розчинний у сироватці крові рецептор інтерлейкіну-2 (IL- 2R) також вимірювали за допомогою наборів імуноферментних аналізів (референс, 122–496 Од/мл).
Рівні селену, цинку та міді в сироватці крові вимірювали за допомогою атомно-абсорбційної спектрофотометрії (контрольні діапазони; селен - 107–171 мкг/дл; цинк - 59–135 мкг/дл; та мідь - 66–130 мкг/дл).
Харчова оцінка
Ідеальну масу тіла (БТ) визначали як таку, яку розраховували на основі зросту пацієнтів за допомогою індексу маси тіла (ІМТ) 22,0 кг/м 2. ІМТ обчислювали як суху вагу в кілограмах, поділену на квадрат висоти в метрах. Ми розрахували прогностичний індекс живлення Onodera (PNI) із використанням сироваткового альбуміну, загальних лімфоцитів (TLC) та сухої BW наступним чином: PNI = [10 × альбумін (г/дл)] + [0,005 × TLC] [8]. Ми також визначили геріатричний індекс харчового ризику (GNRI) наступним чином: GNRI = [14,89 × альбумін (г/дл)] + [41,7 × сухий/ідеальний BW]. Коли DW перевищував ідеальну вагу, GNRI розраховували як співвідношення DW/ідеального BW, ідентичне 1,0 [9].
Ми визначили нормалізовану швидкість катаболізму білка (nPCR) та норму генерації процентилю креатиніну (% CGR), які можуть оцінити споживання білка в їжі та масу скелетних м’язів відповідно [7, 10].
Антропометричні параметри
На початку та в кінці дослідження ми вимірювали окружність середньої руки (MAC) та товщину шкірних складок трицепсів (TSF), використовуючи штангенциркулі на кінцівці, які не використовувались для судинного доступу після сеансу HD. Ми розрахували окружність м’язів середньої руки середньої руки (MAMC), використовуючи MAC та TSF, наступним чином: MAMC = MAC - (TSF × 3,14). Всі вимірювання проводив один і той же навчений дослідник.
Ми також визначили область м’язів стегна за допомогою комп’ютерної томографії (КТ; Aquilion ONE TSX-301A, Toshiba, Токіо, Японія). Кожного пацієнта обстежували в положенні лежачи на спині з розслабленим м’язом стегна. Осьове КТ-зображення було отримано в середині лінії, що простягається від верхньої межі надколінка до великого вертлужного відділу стегнової кістки. Товщина зрізу становила 10 мм. Площу м’язів стегна та область кісток стегна визначали за допомогою програмного забезпечення SCFM-001A (Toshiba, Токіо, Японія). Ми використовували стандартизовану область м’язів стегна (TMA), розділену на область стегнової кістки (TBA), щоб уникнути впливу розміру тіла, сурогатного маркера саркопенії стегна [11].
Міцність рукоятки
Ми виміряли силу рукоятки на верхній частині руки, яка не використовується для судинного доступу, безпосередньо перед сеансом HD, використовуючи динамометр ручки Смедлі. Кожен пацієнт зробив дві максимальні силові спроби з інтервалом не менше 1 хв між спробами. Найвищий запис було прийнято як показник сили рукоятки.
Ехокардіографія в М-режимі
Ехокардіографію в М-режимі проводили в недіалізний день при вступі в дослідження та через 6 місяців. Всі вимірювання проводив один і той же навчений лікар.
Систолічну функцію лівого шлуночка оцінювали як фракцію викиду (EF) та фракційне вкорочення (FS). EF та FS розраховувались наступним чином: EF (%) = (кінцевий діастолічний об'єм лівого шлуночка (LVEDV) - кінцевий систолічний об'єм лівого шлуночка (LVESV))/LVEDV × 100 та FS (%) = (кінцевий діастолічний лівий шлуночок) розмір (LVDd) - кінцево-систолічний розмір лівого шлуночка (LVD))/LVDd × 100.
Масу лівого шлуночка (LVM) розраховували наступним чином: LVM (g) = 1,04 × [(LVDd + міжшлуночкова перегородка (IVS) + кінці діастолічної товщини задньої стінки лівого шлуночка) (LVDd 3) - 14. LVM з урахуванням площі поверхні тіла в квадратних метрах і виражається як індекс маси лівого шлуночка (LVMI).
Рентген грудної клітки
Кардіоторакальний коефіцієнт (CTR) вимірювали на рентгені грудної клітки безпосередньо перед терапією HD, підготовленим дослідником.
Статистичний аналіз
Для статистичного аналізу був використаний JMP (версія 11.1.1, SAS Institute, Кері, Північна Кароліна, США). Описові результати були виражені як середнє значення ± стандартне відхилення (SD). Параметричний аналіз проводили за допомогою Стьюдента т-тест, і Вілкоксона т тест використовували для непараметричного аналізу. Значення стор
Результати
Базальні характеристики
Під час спостереження, оскільки ми втратили п'ять пацієнтів через смерть (n = 4) та гостра інфекція (n = 1), нарешті ми проаналізували 21 пацієнта.
У таблиці 1 представлені основні характеристики. Середній вік становив 73,5 ± 11,6 років, із середнім часом перебування на HD 60 ± 84 місяців. Причинами термінальної стадії захворювання нирок були наступні: діабетична нефропатія у дев'яти, гіпертонічний нефросклероз у чотирьох, хронічний гломерулонефрит у двох, інші у трьох та невідомі у трьох.
Рівні карнітину
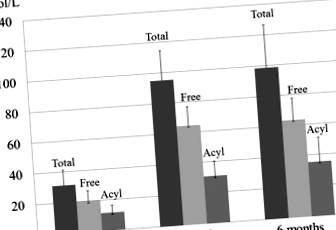
Добавки L-карнітину нормалізували рівень загального, вільного та ацилкарнітину в сироватці крові через 3 місяці. Загальний рівень карнітину був збільшений з 31,1 ± 10,0 до 98,6 ± 27,9 (норма, 45,0–91,0) (стор Рис. 1
Зміни рівня загального, вільного та ацилкарнітину в сироватці крові після 6-місячного прийому L-карнітину. Добавки L-карнітину протягом 6 місяців нормалізували загальний рівень карнітину з 31,1 ± 10,0 до 98,6 ± 27,9 (норма, 45,0–91,0), рівень вільного карнітину - з 19,8 ± 6,6 до 63,3 ± 14,3 (норма 36,0–76,0) та ацилкарнітин рівні від 11,4 ± 4,9 до 35,3 ± 15,9 (норма, 6,0–23,0) мкмоль/л
Кінцева доза L-карнітину становила 191 ± 114 мг/добу (4,0 ± 2,1 мг/кг РГ/добу). Не було виявлено різниці в дозуванні L-карнітину у пацієнтів із ЗН із збереженою залишковою функцією нирок (3,8 мг/кг печінки/день, n = 7) та тих, хто не має (4,5 мг/кг РГ/добу, n = 14).
Параметри харчування
Незважаючи на однаковий DW, знайдено значне збільшення сироваткового трансферину (стор Таблиця 2 Вплив добавок L-карнітину на харчові параметри
Антропометричні параметри
TSF був значно збільшений з 0,4 ± 0,3 до 0,6 ± 0,3 см (стор Таблиця 3 Вплив добавок L-карнітину на імунологічні, запальні показники та мікроелементи
Розсіяні елементи
Селен у сироватці крові значно зменшився з 60,4 ± 13,9 до 52,4 ± 12,2 мкг/л під час спостереження (стор = 0,01). Рівень цинку та міді в сироватці крові не змінювався (табл. 3).
Серцеві параметри
L-карнітин збільшився щодо FS з 42,2 ± 11,4 до 46,1 ± 9,8% (стор Таблиця 4 Вплив добавок L-карнітину на серцеві параметри
Обговорення
У цьому дослідженні ми перорально вводили L-карнітин, щоб підтримувати рівень вільного карнітину в сироватці крові в межах норми протягом 6 місяців, ретельно контролюючи та змінюючи дозування протягом перших 3 місяців. Як результат, ми підтримували рівень вільного карнітину в межах норми, незважаючи на відносно меншу дозу (3,8-4,5 мг/кг БТ/добу) порівняно з рекомендованою дозою (5-10 мг/кг БТ/добу).
Ми також показали, що режим прийому L-карнітину мав кілька сприятливих впливів на харчові, імунологічні та серцеві параметри, як показано нижче.
Вплив на харчування
Повідомляється, що добавки L-карнітину покращують харчовий статус у пацієнтів із ЛП. Пероральне введення L-карнітину збільшувало nPCR незалежно від дози діалізу [12]. L-карнітин також покращує харчові параметри, такі як сироватковий трансферин та альбумін у хворих на ГД [13, 14]. Внутрішньовенне введення L-карнітину (2 г) в кінці сеансу HD також збільшує морфологічні діаметри волокон скелетних м’язів [15]. Обробка L-карнітином запобігла погіршенню пікової швидкості споживання кисню (VO2 max) [16].
У цьому дослідженні L-карнітин значно збільшив сироватковий зв’язуючий ретинол білок та трансферин через 6 місяців. Крім того, лікування збільшило рівень аміаку в сироватці крові, незважаючи на те, що знаходиться в межах норми, вказуючи на можливість того, що L-карнітин може посилити вироблення аміаку через цикл сечовини за рахунок збільшення споживання їжі. Однак nPCR, непрямий маркер споживання білка з їжею, залишався нижчим під час дослідження. L-карнітин також не покращував інші харчові параметри, такі як GNRI та PNI. Не було різниці в площі м’язової маси, потужності рукоятки та% КГР. Ці результати переконливо свідчать про те, що пероральне лікування L-карнітином протягом 6 місяців для підтримання карнітину без сироватки в межах норми не полегшило поганий харчовий статус.
На відміну від цього, TSF значно підвищувався після лікування. Однак, оскільки співвідношення TMA/TBA, маркер площі скелетної маси стегна, було досить зменшено з 9,1 ± 3,0 до 8,8 ± 3,1, незважаючи на відсутність збільшення маси тіла, це можна пояснити змінами регіонального складу тіла через прогресуючу саркопенію в надпліччя.
Вплив на імунну відповідь
Активність NK-клітин відіграє важливу роль у механізмі захисту від інфекцій та пухлин. У хворих на HD активність NK-клітин знижується або не змінюється [17]. Більш високе співвідношення CD4/CD8, маркер вироблення Ig В-клітинами, також пов'язане з кращою серологічною реакцією на вакцинацію проти гепатиту В [18].
L-карнітин може відновити вікові зміни функції нейтрофілів, такі як хемотаксична та фагоцитарна активність in vitro [19]. Лікування L-карнітином також запобігало індукованому збудником експериментального коліту шляхом скасування як вроджених, так і адаптивних імунних відповідей у мишей [20]. Крім того, L-карнітин може знижувати апоптотичний рівень клітин CD4 + і CD8 + [21].
У цьому дослідженні добавки L-карнітину значно збільшували активність NK-клітин при співвідношенні E/T 10: 1 і 20: 1, але вперше це стало очевидним через 6 місяців. Отже, для відновлення активності NK-клітин після терапії L-карнітином буде потрібно принаймні більше 3 місяців. Дефіцит селену потенційно пов’язаний із клітинним імунітетом у пацієнтів із ЗН [17]. Однак селен у сироватці крові скоротився з 60,4 ± 13,9 до 52,4 ± 12,2 мкг/л після прийому добавок, що свідчить про відсутність асоціації дефіциту селену з відновленою активністю NK-клітин.
Вплив на параметри серця
L-карнітин запобігає розвитку фіброзу шлуночків та серцевої недостатності із збереженим ЕФ при гіпертонічній хворобі серця [22]. L-карнітин також блокує дієтичну дисфункцію лівого шлуночка, спричинену дефіцитом вітаміну B, і послаблює підвищений вміст BNP у сироватці крові, спричинений дієтою [23]. У пацієнтів з хронічною серцевою недостатністю рівні карнітину в плазмі корелюють з% FS, EF та LVMI [24]. Мета-аналіз також виявив, що L-карнітин асоціюється зі зниженням смертності від усіх причин на 27% та зменшенням симптомів стенокардії на 40% у пацієнтів із гострим інфарктом міокарда [25].
Повідомлялося, що пероральне лікування L-карнітином суттєво покращувало функцію лівого шлуночка [26, 27], в той час як зменшувало LVMI [28]. У цьому дослідженні ми підтвердили, що добавки L-карнітину викликали значне збільшення% ФС одночасно зі зниженням BNP. На відміну від цього, L-карнітин не змінює LVMI. Причина такої розбіжності залишається невідомою, але частково це може бути пов’язано з більш коротким періодом добавок, ніж у попередньому дослідженні (12 місяців) [28].
Вплив на запалення
Зв'язок між запаленням та дефіцитом карнітину добре пропонується у пацієнтів з високою чіткістю. Однак результати останніх двох досліджень мета-аналізу, що включали рандомізовані контрольовані дослідження, не збігалися; одне дослідження [29] показало, що L-карнітин суттєво знижує рівень СРБ у сироватці крові, тоді як інше не виявляло жодного ефекту [30].
У цьому дослідженні пероральний L-карнітин не змінює рівень СРБ у сироватці крові, тоді як він, швидше, підвищує рівень ІЛ-6 у сироватці крові через 6 місяців. Оскільки повідомляється, що пероральне введення 1000 мг/кг БТ L-карнітину знижує рівень СРБ та IL-6 у сироватці крові [31, 32], може знадобитися більша доза для полегшення запальної реакції, пов’язаної з уремією.
Обмеження навчання
У цього дослідження є кілька обмежень. По-перше, це дослідження не проводилось рандомізованим контрольованим способом, і кількість пацієнтів була явно невеликою. Отже, необхідні майбутні дослідження, що включають більше зразків, щоб підтвердити зв'язок лікування L-карнітином та клінічних параметрів. По-друге, ми просто порівняли багато клінічних маркерів до та після лікування L-карнітином. Отже, залишається невідомим, чи можуть ці імунологічні та ехокардіографічні зміни мати сприятливий вплив на клінічні результати. По-третє, оскільки ми вводили L-карнітин перорально у відносно низьких дозах, його ефект може бути обмежений порівняно з внутрішньовенним введенням. По-четверте, ми не вимірювали індекс апендикулярної маси скелета за допомогою біоелектричного імпедансу (BIA) або рентгенівської абсорбціометрії з подвійною енергією, тому ми не могли точно підтвердити наявність саркопенії. Нарешті, атрофія м’язів з часом прогресує, тому необхідно буде оцінити ефект L-карнітину в довгостроковій перспективі.
Висновки
Ми показали, що добавки L-карнітину мали кілька впливів на клінічні параметри. L-карнітин підвищував активність NK-клітин після 6-місячного лікування. Відбулося значне збільшення% ФС із зменшенням BNP. Отримані дані свідчать про те, що L-карнітин може покращити імунологічні та пов'язані з ЛШ систолічні функціональні параметри. На противагу цьому, L-карнітин не покращував саркопенічні маркери і не зменшував запальну реакцію. Отже, очевидно, необхідні майбутні добре розроблені РКД, щоб підтвердити різноспрямовані дії добавок L-карнітину у пацієнтів із регулярною HD.
- Вплив заміни їжі на склад тіла та метаболічні параметри серед суб'єктів з
- ЕНЕРГІЙНІ ПОТРЕБИ ДЛЯ ВІДНОВЛЕННЯ ЕФЕКТІВ ДІАРЕЇ - Лікування гострої діареї
- Знайти найкраще) Таблиця цілей для схуднення Вулкан Gnc Добавка Побічні ефекти - Табір Комо
- Поширені астматичні стероїди, пов’язані з побічними ефектами в надниркових залозах Стаття AMP Reuters
- Побічні ефекти глюкофажа загальні, важкі, довгострокові