Вміст альфа-ліноленової кислоти в насінні льону асоціюється з індукцією експресії жирового лептину
Анотація
Вступ
Адипоцити, клітини, що складають основну масу жирової тканини в організмі, відіграють важливу фізіологічну роль поза здатністю зберігання ліпідів. Вони секретують ряд важливих клітинних сигнальних молекул, які називаються адипокінами. Ці адипокіни мають наслідки, починаючи від місцевих аутокринних та паракринних ефектів і закінчуючи системними ендокринними діями. Адипокіни також сильно відрізняються як за своєю функцією, так і за механізмами контролю. Одним з таких механізмів контролю є жирнокислотний склад жирової тканини, який може впливати на клітинну сигналізацію, торгівлю жирними кислотами, експресію генів і, отже, метаболізм [1]. Склад жирової тканини варіюється залежно від двох основних ефекторів: енергетичного балансу, який регулює метаболізм вільних жирних кислот у жировій тканині, та дієти, яка змінить профіль жирних кислот жирової тканини. Незважаючи на те, що перший досліджували широко, особливо щодо експресії лептину та диференціації адипоцитів, вплив останнього на ендокринну функцію почали досліджувати лише нещодавно.
Адипонектин - це найбільш виражений і секретується адипокін, сприятливо впливає на обмін речовин, запалення та роботу судин. Адипонектин має парадоксальний характер вираження. Зі збільшенням ожиріння експресія і секреція адипонектину зменшується в жировій тканині [2]. Вважається, що цей парадокс є частиною патології ожиріння і є симптомом дисфункціональної жирової тканини. Адіпонектин відіграє роль у чутливості до інсуліну, окисленні ЛПНЩ, активації eNOS, придушенні запалення та катаболізмі жирних кислот [3–5]. Таким чином, гіпоадіпонектинемія представляє інтерес як біомаркер як серцево-судинних захворювань, так і метаболічного синдрому.
Ще одним важливим адипокіном, який може стимулюватися зміною профілю жирних кислот, є лептин. Вперше це було виявлено як білок, кодований ожиріння ген, названий за фенотип подвійної нокаутованої миші. Ці миші не відчувають ситості, і, отже, їдять безперервно, коли їх годують довільно, що призводить до важкого ожиріння, спричиненого дієтою. У людей дефіцит лептину спричинений у випадках патологічного ожиріння як генетичний фактор, або метаболічна недостатність [6, 7]. Роль лептина в опосередкованому гіпоталамом придушенні апетиту у відповідь на споживання калорій не є єдиною його функцією. Лептин також може мати важливе значення в модуляції активності Т-клітин на ранніх стадіях атеросклеротичного розвитку, а також інших імунних клітин [8]. При ожирінні лептин може бути недостатньо виражений жировою тканиною у відповідь на стабільно висококалорійну дієту, або рецептори лептину можуть бути знижені, що призводить до високого рівня лептину в плазмі крові та стійкості до лептину [9].
Насіння льону останнім часом набуває популярності як функціональний корм. Альфа-ліноленова кислота (ALA) становить приблизно 55% загального вмісту жирних кислот у жирних кислотах льону [10]. Багаті на ALA дієти, включаючи дієти, збагачені меленим лляним насінням, показали в інтервенційних та експериментальних випробуваннях зменшення як летального, так і нефатального інфаркту міокарда [11, 12], серцевих аритмій [12–15] та частоти атеросклеротичних уражень [12, 14, 16, 17]. Однак механізм, за допомогою якого ALA та насіння льону індукують цю серцево-захисну дію, незрозумілий. Попередні дані вказували на те, що ALA із збагаченої насінням льону дієти відкладається в жировій тканині [18]. Тому цілком можливо, що ця зміна вмісту жирних кислот у жировій тканині може впливати на функцію жирової тканини. Ми припускаємо, що зміна складу ліпідів у жировій тканині у відповідь на дієту з добавкою льону може вплинути на передачу адипокіну від адипоцитів. Отже, можливо, корисні серцево-судинні дії насіння льону, які спостерігались раніше, можуть бути пов'язані зі змінами експресії адипокіну.
Матеріали і методи
Дієта та годування
Всі експерименти проводились відповідно до рекомендацій Канадської ради з догляду за тваринами. Шістнадцять чоловічих новозеландських білих кроликів (2,8 ± 0,1 кг, Південна троянда кроликів) були випадковим чином призначені для отримання однієї з чотирьох дієт. Дієти готувались, як було описано раніше [15, 17], шляхом додавання компонентів до звичайної (RG) кролячої дієти (повний раціон кроликів CO-OP, Федеративні кооперативи): 0,5% холестерину (CH) або 10% меленого льону (FX), або обидва (CF) протягом 8 тижнів (n = 4). Чау зберігали при 4 ° C і захищали від світла. Дієти відрізнялися лише загальним вмістом жиру завдяки включенню в ньому багатого на природу ALA меленого насіння льону (таблиці 1, 2). Склад дієтичних жирних кислот викладений у таблиці 2. Додавання лляного насіння до раціону значно збільшило кількість C16: 0, C18: 0, C18: 1 (олеїнова кислота) та C18: 3 (ALA). Додавання холестерину не мало значного впливу на дієтичні жирні кислоти, порівняно з дієтою РГ. Кроликів годували 125 г/день раціону.
Забір крові та аналіз
Кров брали з лівої крайової вушної вени кроликів, які голодували протягом ночі перед початком експериментальної дієти та через 8 тижнів. Її збирали у вакуаторні пробірки, що містять ЕДТА (Бектон – Дікінсон). Зразки крові центрифугували при 4500 ×g при кімнатній температурі протягом 10 хв, а потім плазму зберігали при -80 ° C. Перед аналізом зразки плазми розморожували та центрифугували при 6800 ×g. Рівні холестерину та тригліцеридів у плазмі крові аналізували за допомогою аналізатора крові VetTest 8008 (лабораторії IDEXX). Жирні кислоти витягували з плазми та дериватизували, як описано раніше [15, 18].
Колекція тканин
Після 8 тижнів дієтичного лікування тварини були евтаназовані 5% -ним ізофлураном, що надходить під маску для обличчя, з подальшою серцевою екстракцією. Забирали ретроперитонеальну та епідидимальну жирові тканини. Щоб запобігти забрудненню RNase, тварину та інструменти обприскували RNaseZap (Ambion) як до, так і під час забору тканин. Жирову тканину негайно поміщали в RNAlater і витримували протягом ночі при 4 ° C, як зазначено в інструкціях виробника (Ambion). Попереднє тестування показало, що була успішна стабілізація мРНК порівняно із швидким заморожуванням або підтримкою протягом ночі при 4 ° С (як оцінювали за допомогою електрофорезу в агарозному гелі та подальшої qRT-ПЛР), незважаючи на високий вміст ліпідів у цій тканині. РНК пізніше видаляли з тканини відсмоктуванням, а потім зразки швидко заморожували у рідкому азоті та зберігали при -80 ° C.
qRT-ПЛР
РНК виділяли з жирової тканини в середовищі, що не містить РНКази. Жирову тканину гомогенізували в реактиві Trizol (Invitrogen), а жир видаляли. Фенол відокремлювали від розчину, двічі промиваючи розчин хлороформом. РНК осаджували з розчину етанолом і додавали до колонок RNeasy для подальшого очищення (Qiagen). Вилучену РНК кількісно визначали та оцінювали за допомогою спектрофотометра та електрофорезу в агарозному гелі. Потім його використовували для qRT-PCR (Quanta Biosystems), використовуючи систему виявлення ПЛР iQ5 у реальному часі (Bio-Rad). Праймери, розроблені з використанням програмного забезпечення BLAST (NCBI), були такими: Адипонектин: (вперед 5′ACCAGGACAAGAACGTGGAC3 ′, зворотний 5′TGGAGATGGAATCGTTGACA3 ′);
Лептин: (вперед 5′GTCGTCGGTTTGGACTTCATC3 ′, реверс 5′CGGAGGTTCTCCAGGTCGTTG3 ′) [19];
GAPDH: (вперед 5′GATGGTGAAGGTCGGAGTGAA3 ′, реверс 5′GGTGAAGACGCCAGTGGATT3 ′) [20].
Праймери були перевірені за допомогою програмного забезпечення BLAST від NCBI [21]. Невикористані зразки зберігали при -80 ° C. кДНК синтезували з 1 мкг РНК за допомогою qScript кДНК Supermix (Quanta) за вказівками виробника. qPCR тривав протягом 2 хв при 50 ° C, 95 ° C протягом 8,5 хв, потім 40 циклів при 95 ° C протягом 15 с і 60 ° C протягом 60 с, після чого дані були зафіксовані. Криву розплаву отримували після циклу при 95 ° C протягом 1 хв, після чого 55 ° C протягом 1 хв та 80 циклів захоплення 10-ти секунд 55 + 0,5 ° C/цикл. Результати нормалізували за допомогою експресії GAPDH та аналізували методом дельта-дельта-Ct за допомогою програмного забезпечення iCycler для виявлення в реальному часі.
Екстракція та метилювання жирних кислот
Жирні кислоти плазми безпосередньо екстрагували та дериватизували за допомогою модифікації оригінального методу, описаного Лепажем та Роєм [22], а пізніше модифікованого Гаргом та співавт.. [23]. Коротко, 100 мкл плазми поєднували з 2 мл 4: 1 (об/об) метанолу: толуолу в пробірці з боросилікатного скла. Розчин метанол: толуол містив 0,5 мг/мл внутрішнього стандарту, C19: 0 (Nu-Chek Prep. Inc.). Під час завихрення повільно додавали 200 мкл ацетилхлориду. Пробірки закривали тефлоновою кришкою, зважували і потім нагрівали при 100 ° С протягом 1 години. Після охолодження до кімнатної температури пробірки повторно зважували, щоб гарантувати відсутність втрати зразка. Потім додавали п’ять мілілітрів водного 6% розчину K2CO3 для припинення та нейтралізації реакції. Потім пробірку для проби центрифугували при 5000 об/хв протягом 5 хв при кімнатній температурі, після чого верхній шар толуолу видаляли і піддавали газовому хроматографічному аналізу з використанням детектора полум'яної іонізації (GC-FID). Метилювання було перевірено за допомогою тонкошарової хроматографії. Жирні кислоти з приблизно 15 мг жирової тканини витягували та дериватизували, використовуючи метод, описаний Лепажем та Роєм [24].
Газова хроматографія
Метилові ефіри жирних кислот (FAME) вводили в газохроматографічну систему Varian CP 3800 за допомогою автозабірника Varian CP 8400. Аналіти виявляли за допомогою виявлення іонізації полум’ям та аналізували на робочій станції Varian MS (версія 6.9.1). Один мікролітр зразка вводили при 250 ° С при співвідношенні розщеплення 50: 1 на капілярну колонку Varian CP-Sil 88 (60 м × 0,25 мм × 0,20 мкм). Газ гелій (ультрачистий) використовували як газ-носій при постійній швидкості потоку 1,5 мл/хв. Температуру в духовці підтримували на рівні 111 ° C протягом 1 хв, потім швидко підвищували на 20 ° C/хв до 170 ° C. Потім його повільно збільшували зі швидкістю 5 ° C/хв до 190 ° C і, нарешті, на 3 ° C/хв до 225 ° C, де його підтримували протягом 10 хв. FAME були кількісно оцінені щодо зовнішнього стандарту GLC 462 (Nu-Chek Prep, Inc.).
Кількісна оцінка атеросклерозу аорти
Аорту від висхідної дуги до роздвоєння клубової кістки виділяли з периферичних тканин і промивали холодним PBS, потім розкривали поздовжньо і закріплювали плоско. Просвіт аорти фотографували цифровим способом, а просвіти просвічували за допомогою програмного забезпечення Silicon Graphics Imaging. Жирові прожилки та ускладнені ураження виражались у процентилях від загальної площі поверхні просвіту.
Статистика
Результати повідомлялись як середні значення ± SE та аналізувались за допомогою програмного забезпечення Sigma-Stat за допомогою одностороннього ANOVA, використовуючи LSD-тест Фішера. Значну кореляцію виявив a т тест. стор ≤0,05 вважали статистично значущим.
Результати
Вага тіла
Через 8 тижнів дієтичного лікування середня маса тіла значно зросла з 2,8 ± 0,06 до 3,7 ± 0,09 кг. Однак не спостерігалося впливу на вагу експериментальних дієт порівняно з контрольними дієтами (дані не наведені).
Плазмові ліпіди
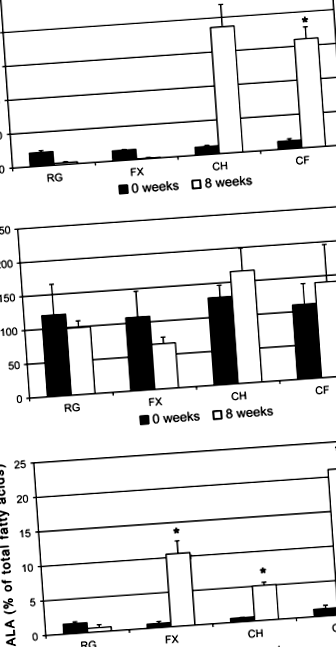
Через 8 тижнів не спостерігалось суттєвих змін рівня холестерину в плазмі у тварин, які харчувались звичайною дієтою або дієтою з додаванням льону. Доповнення дієти холестерином з їжею протягом 8 тижнів викликало важку гіперхолестеринемію (рис. 1а). Додавання дієтичного насіння льону до збагаченої холестерином дієти не знизило значень холестерину в плазмі крові від тих, що спостерігались у тварин, які харчувались раціоном, доповненим лише холестерином.
Жодна з дієт не зазнала значного впливу на тригліцериди плазми (рис. 1б). Додавання подрібненого насіння льону до раціону, забезпечуючи ALA, спричинило 17-кратне збільшення процентного складу ALA у плазмі (рис. 1в). Одночасне споживання лляного насіння та холестерину подвоїло кількість ALA у плазмі порівняно із споживанням лише лляного насіння, що складало 21% усіх жирних кислот плазми. восьмикратне збільшення рівня ALA в плазмі, незважаючи на те, що він отримував лише 2 мг ALA/грам, що підтверджує спостереження, що холестерин сприяє поглинанню ALA [15–18].
Атеросклероз
У тварин, яких годували регулярною їжею або доповнювали насіння льону протягом 8 тижнів, атеросклероз, що піддається кількісному вимірюванню, в дузі аорти не був (рис. 2). Включення 0,5% холестерину в раціон, викликане атеросклеротичними ураженнями аорти, що охоплює 76,3 ± 8,5% просвіту аорти (стор Рис.2
Розвиток атеросклеротичних уражень на аорті новозеландських білих кроликів через 8 тижнів дієтичного лікування. Значення - середні значення ± SE; n = 3. *стор ≤ 0,05 проти RG; стор ≤ 0,05 проти СН. RG звичайна чау, FX чау з додаванням 10% лляного насіння, СН 0,5% дієта з добавкою холестерину, МВ 10% лляного насіння та 0,5% дієти з добавкою холестерину
Склад жирових кислот жирової тканини
Загальні ліпіди були вилучені з двох основних джерел вісцерального жиру. Епідидимальний та ретроперитонеальний жир складався з 92,24% ліпідів за мокрою масою (діапазон 83,3–99,5%), без суттєвих змін загального ліпіду між різними дієтичними методами лікування або будь-яким жировим джерелом (таблиці 3, 4).
Основним компонентом жирової тканини була олеїнова кислота C18: 1, яка складала 32,3 ± 1,9% від загальної кількості жирних кислот у заочеревинному жирі тварин, що годували РГ (табл. 3). С16: 0, пальмітинова кислота та С18: 2, лінолева кислота, також були поширеними, що складало 25,2 ± 1,4 та 26,7 ± 1,3% від загального вмісту жирової кислоти в заочеревинній жировій тканині відповідно. Також у помітних кількостях у заочеревинній жировій тканині тварин, яких годували звичайним раціоном, були ALA (6,34 ± 0,34%), стеринова кислота (6,14 ± 0,57%), пальмітолеєва кислота (2,12 ± 0,08%), вакценова кислота (1,98 ± 0,21%) ) та міристинової кислоти (1,77 ± 0,12%) (табл. 3).
Пропорції жирних кислот у тканині епідидиму тварин, яких годували звичайним раціоном, не суттєво відрізнялись від пропорцій жирних кислот у заочеревинній тканині (табл. 4). Харчовий холестерин суттєво не впливав ні на загальні ліпіди, ні на окремі жирні кислоти порівняно з РГ. Додавання лляного насіння до звичайної дієти значно знизило рівень С16: 0, С18: 1-цис, C18: 1-переклад, і C18: 2 в жировій тканині як в абсолютних концентраціях, так і щодо загального вмісту жирних кислот (таблиці 3, 4). При споживанні разом з 0,5% холестерину харчове насіння льону спричиняло 3,1-кратне збільшення рівня ALA жирової тканини, що суттєво зростало порівняно з РГ, але значно менше, ніж тварини, що отримували лише лляне насіння. Харчовий холестерин не впливав на жодну з інших спостережуваних жирних кислот.
Експресія адипокіну
Адипонектин і лептин є двома найбільш вираженими адипокінами в жировій тканині. У жировій тканині епідидиму не спостерігалося суттєвих змін експресії мРНК ні лептину, ні адипонектину після додавання в раціон насіння льону або холестерину (рис. 3а). Експресія адипонектину не змінювалася залежно від дієтичного лікування заочеревинної жирової тканини (рис. 3b). Однак у заочеревинній жировій тканині харчове лляне насіння викликало дворазове збільшення мРНК лептину (стор Рис.3
Ці зміни в експресії лептину позитивно корелювали з рівнем ALA у плазмі та жировим вмістом ALA (рис. 4). ALA плазми корелює з експресією лептину в заочеревинній жировій тканині (стор Рис.4
Зв’язок експресії лептину з атеросклерозом
У всіх тварин, яких не годували холестерином, атеросклероз не спостерігався. Отже, для того, щоб визначити, чи існує суттєвий зв’язок між експресією лептину та розвитком атеросклеротичних уражень, лінійну регресію виконували лише на даних, отриманих від тварин, які отримували дієту з добавкою холестерину. Підвищена експресія лептину в заочеревинній жировій тканині суттєво корелювала (стор Рис.5
Обговорення
Механізм, за допомогою якого експресія мРНК лептину регулюється харчовими ліпідами, наразі незрозумілий. Хоча експресія мРНК SREBP1c безпосередньо пов’язана із вмістом поліненасичених жирних кислот у жировій тканині [30], а в промоторі лептину присутній SREBP-подібний зв'язуючий елемент, він не реагує на сам SREBP [31]. Однак поліненасичені жирні кислоти можуть діяти як ліганди для гамма PPAR для зміни експресії адипокіну [32]. Це може статися через збільшення кількості перекладів [33]. Мейсон та ін. [28] продемонстрували новий сайт зв'язування для адипоцит-специфічного фактора транскрипції в позиції -87 промотору лептину, який зберігається як у мишей, так і у людини, проте консенсусна послідовність не відповідає жодному відомому фактору транскрипції. Цей регіон, який називається LP1, представляє цікаву можливість для нового фактора транскрипції, який може регулювати реакцію лептину на харчові ліпіди на додаток до PPAR-гамми.
Спостереження, що жирова тканина реагує на ці дієти дуже точно, свідчить про те, що зміни є фізіологічно важливими. Підвищений рівень лептину раніше визначався як фактор ризику розвитку атеросклерозу [34]. Однак дані про кореляцію лептину та атеросклерозу отримані на основі ожиріння людей та тваринних моделей ожиріння [35–39]. Наші дані вказують на те, що в популяції, що не страждає ожирінням, лептин може мати раніше невстановлену роль у кардіопротекції. На підтвердження цієї гіпотези експресія лептину суттєво негативно корелювала з атеросклерозом. Коли рівень лептину був високим, атеросклероз низьким, а коли експресія лептину була знижена циркулюючим холестерином, стимулювався атерогенез.
Як корисні, так і шкідливі цитокіни з жирової тканини можуть бути відповідальними за багато зв’язків між дієтою, ІМТ та серцево-судинними захворюваннями. Наведені дані демонструють, що холестерин та лляне насіння мають здатність змінювати експресію лептину. Вважається, що кардіопротекторні ефекти льняного насіння частково забезпечуються доставкою ALA в організм [16, 40]. Однак механізм пояснення індукції цих ефектів за допомогою ALA залишається незрозумілим. У цьому дослідженні ALA в жировій тканині була сильно пов'язана зі збільшенням експресії лептину та подальшим зменшенням атеросклерозу. Таким чином, наші дані свідчать про те, що насіння льону може індукувати його антиатерогенний ефект частково за допомогою ALA-опосередкованої модуляції експресії лептину.
- Ринок тіоктової кислоти (альфа-ліпоєвої кислоти) для очевидців до масового зростання до 2028 року Шиндек, Тайке
- Таблетки для схуднення Топ-5 найкращих оглядів для зниження ваги альфа-ліпоєвої кислоти, схвалених FDA _ Therapeutical
- Переваги альфа-ліпоєвої кислоти - рослинна жаба
- Огляди 17 найкращих амінокислотних добавок 2020
- Лікування дитячої могильної хвороби пов’язане із надмірним збільшенням ваги