Видалення серцевого фібробласту GRK2 посилює скоротливість та ремоделювання після травми ішемії/реперфузії
Меріл С. Вудолл
1 Центр трансляційної медицини, Медична школа Льюїса Каца, Університет Темпл, Філадельфія, Пенсільванія, США
Бенджамін П. Вудолл
1 Центр трансляційної медицини, Медична школа Льюїса Каца, Університет Темпл, Філадельфія, Пенсільванія, США
Ерхе Гао
1 Центр трансляційної медицини, Медична школа Льюїса Каца, Університет Темпл, Філадельфія, Пенсільванія, США
Анкай Юань
1 Центр трансляційної медицини, Медична школа Льюїса Каца, Університет Темпл, Філадельфія, Пенсільванія, США
2 Кафедра кардіології, лікарня Рень Цзі, Медичний факультет, Шанхайський університет Цзяо Тонг, Шанхай, Китай.
Вальтер Дж. Кох
1 Центр трансляційної медицини, Медична школа Льюїса Каца, Університет Темпл, Філадельфія, Пенсільванія, США
Пов’язані дані
Анотація
Обґрунтування
G-білкова рецепторна кіназа 2 (GRK2) - важлива молекула, що регулюється після ушкодження міокарда та під час серцевої недостатності. Специфічна для міоцитів втрата GRK2 до і після ішемічного ураження міокарда покращує серцеву функцію та реконструкцію. Фібробласт серця відіграє важливу роль у відновленні та реконструкції після ішемії серця; значення GRK2 у цих подіях не досліджувалось.
Об’єктивна
Метою цього дослідження є з'ясування наслідків видалення GRK2 у серцевому фібробласті після пошкодження ішемії/реперфузії (I/R) in vivo.
Методи та результати
Ми демонструємо, використовуючи індуковані тамоксифеном, специфічні для фібробластів миші-нокаутери GRK2, що втрата GRK2 надає захисну перевагу над контрольними мишами після пошкодження міокарда. Миші-нокаути з фібробластом GRK2 представлені зменшеним розміром інфаркту та збереженою серцевою функцією через 24 години після введення/введення, що продемонстровано збільшенням фракції викиду (58,1 ± 1,8% проти 48,7 ± 1,2% у контрольних групах, p Ключові слова: Ішемія міокарда/реперфузійна травма, G-білкова рецепторна кіназа 2, серцевий фібробласт, фіброз, запалення
ВСТУП
Пошкодження ішемії/реперфузії (I/R) активує «стерильну» запальну реакцію, коли нейтрофіли вербуються до ішемізованої зони некротичними міоцитами та активними формами кисню (АФК). 7 Надмірна інфільтрація нейтрофілів у місці інфаркту вважається шкідливою для виживання міоцитів, оскільки нейтрофіли також секретують АФК, ще більше посилюючи руйнування клітин та тканин. 8 Розуміння запалення та реконструкції після пошкодження В/В важливо для розробки нових методів лікування; численні дослідження продемонстрували, що пригнічення екстравазації нейтрофілів зменшує пошкодження тканин і зменшує розмір інфаркту. 9-11 Нас цікавлять серцеві сигнали та клітинний зв'язок між міоцитами та фібробластами, які можуть регулювати або змінювати пошкодження тканин після пошкодження I/R.
Хоча регуляція GPCRs в міоцитах під час ішемічної травми була широко вивчена, передача сигналів GPCR фібробластів під час I/R пошкодження та фокус цього дослідження, GPCR кіназа 2 (GRK2), не були добре охарактеризовані. Основна роль GRK2 полягає у фосфорилюванні активованих агоністами GPCR і спрямуванні їх на β-арестин-опосередковану інтерналізацію; у серці GRK2 регулюється в міоциті після пошкодження, і його посилена активність спрямована на β-адренергічний рецептор (βAR) для модуляції скоротливості. 12-13 десятиліть досліджень виявили згубні наслідки підвищеної активності GRK2 при серцевих захворюваннях і надали широкі докази того, що втрата експресії GRK2 міоцитів або її пригнічення до або після серцевого пошкодження є корисним для скоротливості міокарда та реконструкції серця. 14-16 Більш пізні дослідження також розширили універсальність GRK2, окресливши неканонічні ролі в регуляції eNOS 17,18, функції мітохондрій 19,20 та передачі сигналів про інсулін. 21
В даний час мало відомо про функцію GRK2 в серцевому фібробласті. У цьому дослідженні ми прагнули вивчити, чи буде втрата фібробластів GRK2 вигідною чи шкідливою для серцевої функції після гострої ішемічної травми in vivo. За допомогою індуцибельних та умовних мишей з нокаутом GRK2 (KO) ми піддали мишам GRK2 KO, характерним для фібробластів, пошкодження міокарда та дослідили ефекти, пов'язані з функцією серця, фіброзом та запаленням. Наші результати чітко показують, що в гострій ситуації втрата фібробластів GRK2 сприятлива для серцевої функції та ремоделювання, і що це може бути пов’язано з різницею в рекрутингу запальних клітин у ранні години після реперфузії. Ми також провели експерименти in vitro на свіжоізольованих серцевих фібробластах новонароджених щурів та дорослих мишей, щоб отримати уявлення про те, як фібробласт може впливати на виживання міоцитів та запалення серця in vivo.
МЕТОДИ
Дослідні тварини
Для отримання індуцибельних, специфічних для фібробластів мишей GRK2 KO мишей Collagen1α2-CreER (T) 22 (Jackson Labs Stock # 029235) схрещували з мишами GRK2 fl/fl 23 (Jackson Labs Stock # 012458). Цуценят повторно схрещували для отримання мишей Collagen1α2-CreER (T)/GRK2 fl/fl (іменовані як GRK2 fKO). Мишей GRK2 fl/fl використовували в якості контролю дикого типу (WT). Тамоксифен (Sigma T5648) вводили внутрішньочеревно (ІП) щодня протягом 10 днів із 40 мг/кг/добу. Всі дослідження на тваринах проводились із схвалення Комітету з догляду та використання тварин при Університеті Темпл.
Виділення серцевих фібробластів та міоцитів дорослих мишей
Серця витягували у мишей> 2-3 місяців і обробляли, як описано раніше. 24
Виділення клітин кісткового мозку та препарат лізату
Стегно було видалено у мишей> 2-3 місяців. Зміст промивали за допомогою буферованого сольового розчину Хенка (Corning 21-023-CV), шприца та голки 27 калібру. Клітини кісткового мозку центрифугували і промивали 1X PBS. Клітини ресуспендували в буфері RIPA, доповненому інгібіторами протеази, обробляли ультразвуком і центрифугували для видалення клітинних залишків.
Виділення гладких м’язів судин та препарату лізату
Грудна аорта була виділена від мишей віком> 2-3 місяців. Після промивання в 1X PBS на аорти реагували в буфері RIPA, доповненому інгібіторами протеази, обробляли ультразвуком і центрифугували для видалення клітинних залишків.
Виділення серцевих фібробластів щурів у новонароджених
Серцеві фібробласти щурів у новонароджених виділяють як побічний продукт виділення міоцитів серця у щурів у новонароджених, як це було описано раніше 17 .
Імуноблотинг
Антитіла до GRK2 та GAPDH були від Санта-Крус. Антитіла до фосфо-AKT та загальні AKT були отримані від Cell Signaling.
Модель in vivo ішемії/реперфузійної травми
Ішемія/реперфузійна травма була виконана, як описано раніше. 25 Розмір інфаркту вимірювали, як описано раніше. 26
Трансторакальний ехокардіографічний аналіз
Трансторакальну двовимірну ехокардіографію проводили сліпо, як описано. 25
Кінцевий гемодинамічний аналіз серцевої функції
Гемодинамічний аналіз проводили сліпим, як описано раніше. 25
Вимірювання апоптозу міокарда
Апоптоз міокарда оцінювали за допомогою фарбування TUNEL. 18
Оцінка фіброзу міокарда
Рівні колагену вимірювали за допомогою набору для фарбування Trichrome Masson (Sigma HT15) та набору для аналізу гідроксипроліну (Sigma MAK008) без модифікацій.
Вимірювання рівнів цАМФ
Серцеві фібробласти щурів у новонароджених обробляли 10 мкМ ізопротеренолу протягом 15 хвилин. Рівні cAMP вимірювали за допомогою циклічного набору для аналізу AMP XP (Cell Signaling 4339) без модифікацій.
Імунофлюоресценція
Серця збирали через 72 години після реперфузії, фіксували на ніч у 4% параформальдегіді, вкладали у парафін і розрізали на довгій осі на секції 6um. Після депарафінізації, регідратації та вилучення антигену за допомогою розчину для викриття антигенів Vector (Vector Labs H3300) зрізи блокували в 10% FBS/1X PBS. Первинне антитіло (α-SMA, Sigma A5228) інкубували зі зрізами протягом ночі при 4 ° C. Вторинне антитіло (Life Technologies A21463) застосовували протягом 1 години при кімнатній температурі. Зрізи обробляли кріпильним носієм DAPI і закривали кришку. Інтенсивність флуоресценції вимірювали за допомогою ImageJ. Для фарбування серцевих фібробластів щурів новонароджених клітини обробляли метанолом протягом 15 хвилин при -20 ° С, промивали та блокували протягом 1 години при кімнатній температурі в 5% BSA/PBS. Антитіло P65 (Cell Signaling 6956) інкубували протягом ночі при 4 ° C, а вторинне антитіло (Life Technologies) застосовували протягом 1 години при кімнатній температурі. Зрізи обробляли кріпильним носієм DAPI та закривали кришку. Клітини підраховували, використовуючи Image J, принаймні за п’ять полів на групу. Всі зображення імунофлюоресценції були зроблені за допомогою мікроскопа Nikon Ti.
Фарбування мієлопероксидазою (MPO)
Мишей евтаназували через 6 і 24 години реперфузії, а серця фіксували у 4% параформальдегіді. Серця були вкладені в парафін і розрізані на ділянки товщиною 5 мкм. Імуногістохімію проводили на зрізах, включаючи пошук антигену за допомогою розчину для викриття антигенів Vector. Первинне антитіло до MPO та вторинне антитіло отримували у Санта-Крус (sc16129, sc2354, відповідно). Зображення інфарктної зони стінки ЛШ були зроблені з принаймні двох випадково вибраних полів на Nikon DS-Ri1 та кількісно оцінені сліпо за допомогою ImageJ.
Мікрочип цитокінів
Виділені серцеві фібробласти миші у дорослих, як описано вище. Клітини піддавали дії in vitro ішемічного буфера 27 і супернатант збирали для використання з панеллю масиву цитокінових масивів A мишей Protefi Profiler (R&D ARY006) з однією модифікацією: використовували IRDye 800CW Streptavidin (Rockland S000-31).
Умовний експеримент із ЗМІ
Серцеві фібробласти новонароджених обробляли LacZ або shGRK2, що містять аденовірус. Через 24 години фібробласти голодували протягом ночі, обробляли протягом 30 хвилин буфером ішемії in vitro, а потім реперфузували в 0,1% DMEM протягом 3 годин. Супернатант збирали і поміщали на серцеві міоцити новонароджених на 10 хвилин. Фібробласти збирали для забезпечення втрати GRK2, а міоцити збирали для цільноклітинного лізату.
Буфер реперфузії ішемії in vitro
Цей буфер імітує позаклітинне середовище ішемізованого середовища, оскільки воно має дефіцит глюкози, гіперкаліємічний і багатий кислотою/лактатом. Він складається з 137мМ NaCl, 3,8мМ KCl, 0,49мМ MgCl2, 0,9мМ CaCl2, 4,0мМ Гепесу, доповненого 10мМ 2-дезоксиглюкозою, 20мМ лактату натрію, 1мМ натрійдітіоніту і 12мМ KCL, рН 6,5.
Статистичний аналіз
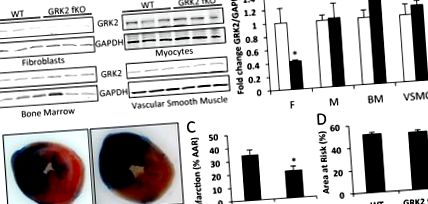
Дані виражаються як середнє значення ± SE. Статистичну значимість визначали неспареним t-тестом на експериментах, що порівнювали дві групи, або тестом ANOVA та Tukey для експериментів, що включали чотири порівняння за допомогою vassarstats.net. Значення P Рисунок 1а). Нокдаун GRK2 був специфічним для фібробластів, оскільки рівень білка підтримувався в міоцитах, клітинах кісткового мозку та клітинах гладких м’язів судин після лікування тамоксифеном в обох групах (рис. 1а). Цей висновок корелює з раніше опублікованими звітами, що використовують цю модель для інших генних продуктів. 24,28 Ми можемо зробити висновок про незначне втручання через нокдаун у циркулюючих фіброцитах. Хоча цей тип клітин має фібробластні якості, фіброцити походять від моноцитів, а рівень GRK2 підтримується в клітинах кісткового мозку. Розмір інфаркту лівого шлуночка (ЛШ) через 30 хвилин після оклюзії лівої передньої низхідної коронарної артерії та 24 години реперфузії вимірювали у мишей GRK2 fKO та виявляли суттєві відмінності порівняно з контрольними мишами (рис. 1). У односеменних підстилках розмір інфаркту ЛШ становив 34,17 ± 3,98% площі ризику (рис. 1б, в). Однак специфічна для фібробластів абляція GRK2 спричинила зменшення розміру інфаркту на 20,67 ± 3,03%. Область ризику ЛШ була подібною в обох групах, що вказувало на однакову кількість ішемічної травми (рис. 1г). Ці результати встановлюють, що втрата фібробластів GRK2 під час гострої ішемічної травми надає захисну перевагу реперфузійній тканині міокарда.
A) Репрезентативні фотографії пофарбованих TUNEL та α-саркомерного актину (αSA) зрізів із прикордонної зони 6-годинних сердець після I/R WT та GRK2 fKO, включаючи зображення 40X, на якому показано TUNEL та αSA + кардіоміоцити (білі стрілки) Шкала шкали, 100 мкм. α-саркомерний актин (зелений), кардіоміоцити; ТУНЕЛЬ (червоний), апоптотичні ядра; DAPI (синій), загальні ядра. Б) Кількісне визначення TUNEL + кардіоміоцитів, представлене як відсоток клітин TUNEL і αSA + у WT та GRK2 fKO. * P Малюнок 3c, d). Фібробласти обробляли аденовірусом, що містить shRNA для GRK2, або контрольним аденовірусом LacZ (малюнок 3c, верхня панель), піддавали впливу in vitro буфера Креба і повторно конфузували з DMEM протягом 3 годин. Супернатант збирали, поміщали на міоцити і вимірювали сигналізацію АКТ (мал. 3С, нижня панель). Кондиціоновані середовища з аденовірусу LacZ та оброблені I/R фібробласти in vitro збільшували фосфорильований АКТ у міоцитах порівняно із середовищами з фібробластів, оброблених лише аденовірусом LacZ. Нокдаун GRK2 у серцевих фібробластах посилив це збільшення фосфорильованого AKT у міоцитах після обробки кондиціонованими середовищами фібробластів in/in vitro, вказуючи на те, що втрата GRK2 у фібробластах in vitro здатна модифікувати секретом фібробластів для посилення сигналів виживання в міоцитах 3d).
Абляція GRK2 у фібробластах інгібує індукований I/R фіброз міокарда та фібротичну генну регуляцію
A) Представницькі зображення трихрому Массона та кількісна оцінка області інфаркту через 72 години після введення/виведення. Кількісна оцінка виражається як відсоток фіброзу від загальної площі. Шкала шкали, 50 мкм *** P Рисунок 5a). Цікаво, що ми виявили, що як миші WT, так і GRK2 fKO експресували рівні кількості білка актину α-гладкої мускулатури, причому обидві групи демонстрували збільшення в 2,64 рази (рис. 5b). Ми також виявили подібне збільшення експресії мРНК α-SMA як у мишей WT, так і у GRK2 fKO (рис. 5c).
Зафіксовано, що β2-АР є протизапальними. В умовах гострого ураження легенів мишами β2-AR агоністи знижували рівень інфільтруючих нейтрофілів та рівень TNFα у супернатанті ізольованих макрофагів, оброблених LPS. 37 Крім того, інфільтрація нейтрофілів у ендотеліальних клітинах венус щурів після обробки речовиною Р інгібувалась за допомогою агоніста β2-AR, формотеролу. 38 Серцеві фібробласти у мишей та людей переважно заселені підтипом β2-AR 39, 40 та основною мішенню GRK2. Втрата GRK2 може підтримувати або навіть посилювати β2-AR опосередковану протизапальну сигналізацію в умовах ішемічної травми, що може мати поступальне значення у серцевих хворих.
Крім того, є дані, що цАМФ інгібує продукцію TNFα через β2-AR. 41 Після обробки LPS селективний інгібітор cAMP-PDE IV роліпрам пригнічував вироблення TNFα. 42 Навпаки, лікування мишачих макрофагів агентами, які підвищують внутрішньоклітинний цАМФ, пригнічений експресією запальних генів, індукованих LPS, включаючи TNFα. 43 Механічно, підвищений цАМФ призводить до активованого РКА, який фосфорилює та сприяє деградації p105, попередника p50. 44 Ці дані натякають на інший потенційний механізм того, як зменшення GRK2 може призвести до ослаблення рівня TNFα; шляхом підтримання рівнів цАМФ, утворених збереженою або посиленою сигналізацією β2-AR. Відповідно до цих міркувань, ми бачимо, що втрата GRK2 у серцевих фібробластах призвела до посилення рівнів цАМФ порівняно з фібробластами WT після обробки ізопротеренолом.
Наші результати свідчать про протизапальну дію GRK2, що суперечить іншим повідомленням, що GRK2 є протизапальною. Специфічний для мієлоїдних клітин нокдаун GRK2 збільшив пошкодження тканин після ін'єкції LPS, посиливши сигналізацію NFκB1p105-ERK 45. Лімфоцити зі зниженим рівнем GRK2 демонструють підвищений хемотаксис до CCL3, CCL4 та CCL5 46. Однак, хоча гемізиготні миші GRK2, уражені експериментальним аутоімунним енцефаломієлітом (EAE), мають швидший початок захворювання, ніж аналоги EAE дикого типу, миші GRK2 +/- не страждають рецидивами, як миші дикого типу. Відсутність рецидивів корелювала з ослабленими запальними інфільтратами ЦНС 47. Крім того, високий рівень GRK2 безпосередньо корелює з тяжкістю хвороби Альцгеймера у пацієнтів людини 48. Ці суперечливі повідомлення про запальну роль GRK2 вказують на відсутність однозначної відповіді, і висновки можуть залежати від типу клітини та моделі захворювання.
Іншим цікавим аспектом наших висновків є те, що, незважаючи на знижений рівень фіброзу та експресії фіброзних генів, які спостерігаються у групі GRK2 fKO, активація міофібробластів та експресія α-SMA виявляються подібними як у мишей WT, так і у fKO. Події, що регулюють трансформацію міофібробластів та фіброзні гени, є багатофакторними, що стосується GRK2, вісь цАМФ є одним із сигнальних шляхів, важливих для регулювання цих подій. Активація аденилатциклази після активації GPCR призводить до утворення цАМФ. cAMP може модулювати відповіді через дві сигнальні платформи, PKA та Epac. Swaney et al. Продемонстрували, що активація цАМФ та Epac екзогенними агентами може притупити синтез колагену, експресію α-SMA та трансформацію міофібробластів у серцевих фібробластах щурів, вказуючи на паралельні ролі. 56 Однак cAMP та Epac мають протилежний вплив на міграцію фібробластів. 57 Ці контрасти, швидше за все, пов’язані з різницею в протоколах (ex vivo проти in vivo), видів (щур проти миші) та моделі пошкодження (I/R проти екзогенних фіброзних агентів), але порушення регуляції цієї подвійної осі сигналу після I/R може пояснити ці відмінності.
З терапевтичної точки зору, наші результати є значними, оскільки вони підкріплюють думку про те, що інгібування GRK2 як у міоцитах, так і у фібробластах є корисним для підтримки інотропного резерву. Існує величезна кількість літератури, що демонструє захисні ефекти абляції GRK2 в серцевому міоциті після ішемії, але обмежені дані свідчать про переваги делеції GRK2 у серцевому фібробласті. Метою цього дослідження було дослідити гострі та хронічні наслідки абляції GRK2 у серцевому фібробласті; ми бачили, що нокдаун GRK2 фібробластів запобігає загибелі міоцитів та надмірному запаленню та надає довготривалі переваги функції серця. Детальне дослідження ролі GRK2 під час постішемічного запалення серця є важливим для подальшого аналізу. Однак наші сучасні висновки додають глибини різним вигідним ролям, раніше приписуваним втраті GRK2, за допомогою класичних або некласичних шляхів.
Новизна та значущість
Що відомо?
G-білкова рецепторна кіназа 2 (GRK2) є основною ГРК в серці, і вона регулюється після серцевої травми та під час серцевої недостатності.
- Новий аналог GIP, ZP4165, посилює спричинену глюкагоном подібний пептид-1 втрату маси тіла та
- Витриманий екстракт часнику підсилює посилене фізичними вправами поліпшення метаболічних показників з високим вмістом жиру
- Розмір серця Стаття про розмір серця від The Free Dictionary
- Китайський стартап створив камеру, яка покращує ваше обличчя - Business Insider
- 039; Це; # 039; s Називається пранаяма; # 039 Індіанці звільняють Scientific American; # 039; s; # 039; Серцеві