Трансляційна сигналізація, атрогенна та міогенна експресія генів під час розвантаження та перезавантаження скелетних м’язів у мишей, дефіцитних міостатин
Хізер К. Сміт
1 Департамент спорту та фізичних вправ Оклендського університету, Окленд, Нова Зеландія,
Кеннет Г. Метьюз
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Дженні М. Олдхем
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Ференц Жанплонг
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Шеллі Дж. Фальконер
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Джеймс Дж. Басс
3 Інститут Ліггінса, Оклендський університет, Окленд, Нова Зеландія,
Моніка Сенна-Салерно
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Джеремі В.
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Крістофер Д. Макмехон
2 AgResearch Ltd., Сільськогосподарський центр Руакура, Гамільтон, Нова Зеландія,
Задумав та спроектував експерименти: CDM HKS KGM JMO FJ JJB. Виконував експерименти: KGM CDM JMO SJF MSS JWB. Проаналізовано дані: CDM HKS JMO SJF JWB. Написав папір: CDM HKS FJ KGM.
Анотація
Вестерн-блот-аналіз
Зразок 150 мг бічного шлунково-м’язового м’яза гомогенізували в 1 мл буфера для лізису (10 мМ Hepes, 10 мМ KCl, 1,5 мМ MgCl, рН 7,9) з 0,5% миючим засобом IGEPAL (Sigma, MO, США) та інгібітором ферменту (Complete, Рош Діагностика). Зразки гомогенізували на льоду, потім центрифугували при 11000 × g протягом 10 хв. Супернатант відновлювали, змішували з завантажувальним буфером Леммлі [55], кип’ятили протягом 5 хв, потім зберігали при –20 ° C до аналізу. Концентрацію білка супернатанту визначали за допомогою аналізу на біцинхонінову кислоту (Sigma-Aldrich NZ, Auckland, NZ).
м 7 GTP-сефарозна хроматографія
Щоб перевірити, що стан фосфорилювання 4E-BP1 відображає зв'язування з eIF4E, ми використовували m 7 GTP-сефарозну 4B смолу для виділення та оцінки зв'язаного стану цих білків для завантаженого (день 0) та нерозвантаженого (день 2) порівняння, як раніше описані [56], [57]. Коротко, смолу m 7 GTP-сефарози 4В (GE Healthcare Ltd, Окленд, Нова Зеландія) двічі промивали буфером для лізису (описано вище) і 80 мкл 50% -ної суспензії змішували з 300 мкг супернатанту з гомогенізованого м’яза шлунково-кишкового тракту та дозволяється інкубувати протягом ночі при 4 ° С. Після центрифугування при 13000 × g та трьох промивань в 1 мл буфера для лізису, зв’язаний матеріал повторно суспендували у рівному обсязі 2x завантажувального буфера Леммлі. Вестерн-блот проводили шляхом завантаження 30 мкл зразка на 10% (eIF4E) або 15% (4E-BP1) гелі SDS-PAGE. Мембрани були заблоковані, як було описано раніше, і 4E-BP1 було виявлено шляхом інкубації з кролячими анти-4E-BP1 антитілами (1∶2000, Cell Signaling Technology Inc), тоді як eIF4E було виявлено інкубацією з моноклональним антитілом eIF4E миші (1∶2000, # sc9976, Санта Круз Біотехнологія Inc) за ніч. Виявлення було таким, як було описано раніше.
Оцінка ізоформ важкої ланцюга міозину
Розмір м’язового волокна
Статистичний аналіз
Волога маса м’язів виражалася відносно початкової маси тіла на d0. Дані піддавали дисперсійному аналізу з використанням GenStat версії 13 (VSN International Ltd) з урахуванням факторів генотипу (Mstn (-/-) або дикого типу), дня та їх взаємодії, включених у виклад моделі. Послідовне багаторазове порівняння проводили з використанням методу Тукі [61]. Дані представлені як середнє значення та стандартна похибка середнього значення (sem).
Результати
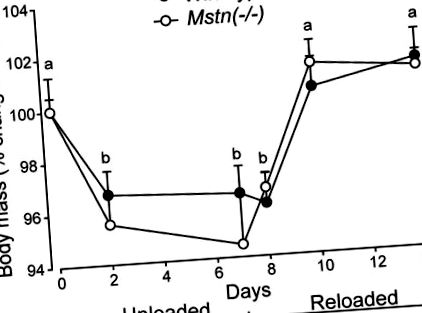
Миші обох генотипів втрачали масу тіла під час ГС і відновлювали масу тіла приблизно однаково під час перезавантаження (P Рисунок 1). Усі м’язи, зібрані від мишей Mstn (-/-), втрачали м’язову масу під час ГС, тоді як лише підошви мишей дикого типу втрачали масу під час ГС. Втрачена маса м’язів мишей Mstn (-/-) в основному була відновлена після 7 днів перезавантаження. Проте маса м'язів B. femoris та Quad Mstn (-/-) не була повністю відновлена d7 перезавантаження (рис. 2). Відносні втрати (∼20%, P Рисунок 2).
На відміну від літер позначають суттєві відмінності (P Рисунок 3A та 3B). Однак спостерігалася більша втрата типу IIb MyHC у Mstn (-/-) порівняно з мишами дикого типу (наслідки дня P, Малюнок 3C).
Зірочками позначені відмінності між генотипами у показані дні (** P Рисунок 6. Загальна кількість 4E-BP1 загалом спостерігалася в м’язах мишей Mstn (-/-) порівняно з тими у мишей дикого типу (P Рисунок 7) Ряд фосфорильованого 4E-BP1 суттєво відрізнявся між двома генотипами лише при d8, зменшувався в обох генотипах при d2, збільшувався при d7 (d8 у Mstn (-/-)), а потім зменшувався на решту перезавантаження. на відміну від цього, співвідношення фосфорильованого до загального 4E-BP1 було нижчим до HS і залишалося нижчим протягом HS та фаз перезавантаження в шлунково-м’язових м’язах Mstn (-/-) порівняно з мишами дикого типу (Рисунок 7). зниження співвідношення під час ГС в обох генотипах. Очевидним було подальше збільшення на 8 день та поступове відновлення під час перезавантаження (ефекти дня Р 7 ГТФ-сефарози для специфічного виділення та збагачення 4E-BP1, зв’язаного з eIF4E, протягом 0 та 2 днів для порівняння між у завантаженому та незавантаженому стані. Відповідно до мастила Внаслідок достатнього вмісту 4E-BP1, що спричинило нижчий коефіцієнт фосфорильованого до загального 4E-BP1 (рис. 7), у м'язах Mstn (-/-) було більше 4E-BP1, зв'язаного з eIF4E (-/-) мишей до ГС, і це співвідношення зростало через 2 дні ГС в обох генотипах (ефекти дня P Рисунок 8).
Зірочками позначаються суттєві відмінності між генотипами у зазначені дні (* Р 7 GTP-сефарозний випадаючий аналіз у шлунково-м’язовому м’язі Mstn (-/-) та мишах дикого типу (n = 6 на генотип і день) до і після двох дні розвантаження. Були основні наслідки дня (Р Малюнок 9). Ряс фосфорильованого eIF2α не відрізнявся між генотипами і збільшувався під час ГС та перші три дні перезавантаження, потім зменшувався на м’язах мишей дикого типу при d14 (Малюнок 9). Як і у випадку 4E-BP1, співвідношення фосфорильованого до загального eIF2α було стабільнішим, ніж чисельність або загального, або фосфорильованого білка, і не відрізнялося між генотипами. Співвідношення зросло (P Рисунок 9).
Зірочками позначені суттєві відмінності між генотипами у зазначені дні (*** P Рисунок 10). Співвідношення фосфорильованого до загального rpS6 не відрізнялося між генотипами і збільшувалось (P Рисунок 10).
Ми прийшли до висновку, що скелетні м’язи мишей Mstn (-/-) є більш сприйнятливими до HS-індукованої атрофії, ніж у мишей дикого типу, але відновляються при перезавантаженні. Ми також показуємо, що більша частка MyHC типу IIb у м'язах мишей Mstn (-/-) відповідає більшій сприйнятливості цих міоволокна до атрофії під час розвантаження. Ми припускаємо, що поєднання тимчасового збільшення деградації білка через систему убиквітин-протеасоми та аутофагії-лізосоми, а також стійке зниження синтезу механізмів білка (зокрема, механізму більшої 4E-BP1) лежать в основі сприйнятливості м'язів Mstn ( -/-) миші до атрофії, спричиненої розвантаженням. Підвищена експресія міогеніну та MyoD може захищати міофібри, що містять більшу частку білка MyHC типу IIb у м’язах мишей Mstn (-/-). Зміна цих механізмів може сприяти швидшому відновленню м’язової маси у мишей Mstn (-/-) під час перезавантаження.
З цих висновків ми припускаємо, що антагоністи міостатину можуть не бути корисною терапією під час фази атрофії скелетних м’язів, але можуть бути корисними під час фази відновлення, коли м’язи активно навантажуються. Крім того, наші дані дозволяють припустити, що міостатин може бути терапією, яку застосовуватимуть під час атрофії, спричиненої розвантаженням, щоб захистити, зокрема, волокна, що швидко смикаються - думка, яка, можливо, суперечлива і відходить від сучасної догми [7]. Незважаючи на цей коментар, інші показали, що введення розчинного рецептора активіну 2B зменшує ступінь атрофії м'язів під час кахексії, що, можливо, підкреслює той факт, що інші члени TGF-β активуються в різних патологічних станах до індукованої атрофії [83].
Подяка
Ми дякуємо Ріку Бродхерсту, Боббі Сміту та Гленді Сміт за догляд за мишами в колонії дрібних тварин. Ми також дякуємо доктору Нілу Коксу за статистичний аналіз.
Заява про фінансування
Це дослідження було підтримано грантом Фонду Марсдена, підрозділу Королівського товариства Нової Зеландії. Фінансист не брав участі у розробці досліджень, зборі та аналізі даних, прийнятті рішення про публікацію чи підготовці рукопису.
- Харчовий статус цинку впливає на експресію генів ZnT1 та ZIP4 у дітей з високим ризиком розвитку
- Проект розвантаження танкерів збирає багато грошей для брендів Conagra ProFood World
- Порт Тутікорін встановлює рекорд з вивантаження вугілля Madurai News - Times of India
- Вивантаження в порту Ctg поновлюється через 3 дні негоди The Daily Star
- РОЗВАНТАЖЕННЯ ТА ТИЛЬКИ ВАНТАЖЕННЯ (БЕЗ ВІЗИЦІЙ) Дорожні вантажоперевезення