Толерантність та прийнятність низькокалорійної педіатричної пептидної формули для ентеральної пробірки: багатоцентрове дослідження у Великобританії
* Відповідний автор:
Анотація
Поширеність дітей з ДЦП, яким потрібна низькокалорійна їжа, становить 8-15%. Робоча група ESPGHAN рекомендує використовувати формулу з низьким вмістом жиру, низькою калорійністю, високим вмістом клітковини та мікроелементів для нерухомих неврологічних дітей.
Діти віком від 1 до 11 років з неврологічними проблемами були набрані з Національної служби охорони здоров'я Великобританії (NHS). Учасники отримали нову низькокалорійну формулу ентерального корму з клітковиною (Peptamen Junior 0,6 ккал/мл, Nestlé Health Science) протягом 7 днів. Було зареєстровано прийом суміші та шлунково-кишкову толерантність.
Сім з 9 завершили 7-денну пробну версію. Одна дитина відмовилася від дослідження через незначне збільшення метеоризму (дитина раніше була на кормі, що не містить клітковини). Одна дитина призупинила подачу на 3-й день через помилку користувача. Середнє щоденне споживання суміші становило 1032 мл (600-1300 мл) для тих, хто завершив випробування і переносив 100% низькокалорійної суміші. Одна дитина спостерігала збільшення частоти стільця (зазвичай типу 6) з 2 до 4 разів на день та незначне збільшення метеоризму та здуття живота; було зазначено, що ця дитина раніше також годувала корм, що не містить клітковини, і пропонуємо повільне введення суміші, що містить клітковину, дітям, які чутливі, може бути корисним.
Більшість учасників добре переносили нову низькокалорійну формулу. Ця формула може бути корисною для забезпечення досягнення повноцінних харчових цілей для дітей з низькими енергетичними потребами.
ВСТУП
Поширеність дітей з ДЦП у Великобританії, за оцінками, становить 2,4 на 1000 дітей віком 3–10 років [1]. Відповідно до Керівних принципів Європейського товариства дитячої гастроентерології, гепатології та харчування (ESPGHAN); Оцінка та лікування шлунково-кишкових та харчових ускладнень у дітей з неврологічними порушеннями передбачає, що неврологічним дітям, які користуються інвалідним візком, потрібно 60–70% споживання енергії порівняно зі здоровими дітьми [2,3].
Згідно з публікацією медичної позиції NASPGHAN (Північноамериканське товариство дитячої гастроентерології, гепатології та харчування), поширеність дітей із ХП із надмірною вагою становить 8% -14% [3].
Перегодовування ентеральним харчуванням ризикує перейти від негативного до позитивного енергетичного балансу, що призведе до накопичення жиру [2]. Оглядове поперечне дослідження (n = 15) дітей з неврологічними порушеннями (NI), які отримують ентеральне харчування, виявило, що, керуючись таблицями росту здорових дітей, потреби в харчуванні можуть бути завищені, що призведе до накопичення надлишкового жиру замість нормального росту та збільшення ваги [4].
Зменшення обсягу суміші, яку вводять дітям з НІ, які потребують ентерального харчування, у яких зменшені енергетичні потреби, щоб зменшити ризик перегодовування або надмірного збільшення ваги, ставить дитину перед ризиком дефіциту макро- та мікроелементів [5].
Робоча група ESPGHAN (Європейське товариство дитячої гастроентерології, гепатології та харчування) рекомендує використовувати формулу з низьким вмістом жиру, низькою калорійністю, високим вмістом клітковини та мікроелементів для підтримання годування з ентеральної трубки після харчової реабілітації у нерухомих дітей з ІМ; він рекомендує випробувати формулу на основі сироватки у випадках шлунково-стравохідного рефлюксу, блювоти та ритму у дітей з НІ [2].
Полімерні суміші, такі як суміші на основі казеїну, можуть погано переноситись деякими дітьми з НІ, які потребують ентерального харчування, головним чином через основні шлунково-кишкові проблеми, такі як гастро-езофагеальний рефлюкс (ГОР) та блювота [2]. Формули на основі сироваткового пептиду можуть бути корисними для дітей з поганою переносимістю корму через затримку спорожнення шлунка. У дітей з важкою формою НІ також показано, що ентеральна формула на основі пептиду сироватки значно зменшує епізоди кислого ГОР, відчуття ритму та блювоти [2].
Для задоволення харчових потреб дітей із ХП із зниженими енергетичними потребами була розроблена повноцінна з низьким вмістом калорій формула корму для зондів, яка випробовувалась виключно у дітей, що харчуються через зонд.
МЕТОД
Дизайн дослідження та учасники
Це дослідження було багатоцентровим випробуванням толерантності та прийнятності. Набір відбувся у трьох національних службах охорони здоров’я (NHS) у Великобританії; Брайтонський та Сассекський університетський госпіталь NHS Trust, Lewisham and Greenwich NHS Trust, Manchester University NHS Foundation Trust. Дизайн дослідження відповідав критеріям Консультативного комітету Великобританії з прикордонних речовин (ACBS) для підтримки подання заявок на рецепти в рамках Національної служби охорони здоров’я (NHS).
Всім учасникам (n = 9) годували зондом та набирали з установ NHS та під наглядом дієтолога/лікаря. Учасникам давали нову формулу протягом 7 днів, Peptamen® Junior 0,6 ккал/мл (Nestlé Health Science), що містить 2,3 г білка на 100 мл, 6,8 г вуглеводів на 100 мл, 0,8 г клітковини на 100 мл та осмолярність 206 мОсм/л *. Дієтолог заповнив базові форми для кожної дитини та зібрав демографічні показники, вагу на початку та в кінці дослідження, діагноз алергії, поточні симптоми шлунково-кишкового тракту (ШКТ), тип стільця, консистенцію та частоту (тип стільця вимірювали за допомогою таблиці Брістоля). Батькам та вихователям було запропоновано записати симптоми шлунково-кишкового тракту та кількість споживаної суміші за 7-денний пробний період.
* Інформація заснована на картці даних Nestle Health Science Peptamen Junior 0.6 від лютого 2020 року.
Критерії включення
Діти віком> 12 місяців були добре встановлені та стабільні на пептидній ентеральній формулі з анамнезом НІ. Отримано письмову та інформовану згоду та згоду батьків чи опікунів.
Критерії виключення
Діти, які мали нездатність виконувати протокол дослідження, на думку слідчого, були виключені з дослідження. Сюди входили діти з відомою харчовою алергією на будь-який інгредієнт у формулі або з порушеннями функції нирок або печінки. Дітей також виключали, якщо вони брали участь в іншому інтервенційному дослідженні протягом 2 тижнів після цього випробування, мали зміну існуючих ліків або застосовували додаткові добавки до макроелементів протягом періоду дослідження, якщо тільки клінічно не вказано та не схвалено дослідником.
Етичне твердження
Етичне схвалення дослідження було надано Комітетом з етики досліджень Манчестер-Північ-Захід-Хейдок 18/NW/0412 та затверджено HRA HRA та Дослідженням охорони здоров'я та охорони здоров'я Уельсу (HCRW).
Первинні та вторинні показники результатів
Вимірювали такі первинні та вторинні результати:
• Діарея, запор, здуття живота, нудота, блювота, відрижка, метеоризм, відрижка, біль у животі або дискомфорт.
• Вимірювання відповідності учасників, обсяг, що призначається щодня, проти того, який обсяг прийнятого
• Запис маси тіла (кг) на початку та в кінці дослідження та дослідження будь-яких тенденцій змін ваги протягом періоду втручання.
РЕЗУЛЬТАТИ
Усі учасники (n = 9; віком 1-11 років) мали неврологічні проблеми; у більшості хворіли на ХП з валовою моторною функцією IV, у однієї дитини був синдром Айкарді-Гутьєра, у іншої - гіпоксична ішемічна енцефалопатія.
Діти з ХП мають складний анамнез, і набір може бути складним завданням (Таблиця 1). Цифри набору для цього дослідження подібні до інших клінічних випробувань, включаючи дітей із серйозною затримкою розвитку [6,7].
Учасник
Стать (чоловіча чи жіноча)
Стан здоров'я
Недіагностований неврологічний стан, GMFCS IV
Церебральний параліч чотирьох кінцівок, GMFCS IV, судоми в анамнезі
Церебральний параліч, GMFCS IV
Гіпоксична ішемічна енцефалопатія III ступеня
Синдром Айкарді-Гутьєра, GMFCS IV
Моторне розлад чотирьох кінцівок (GMFCS IV)
Церебральний параліч, GMFCS IV
Церебральний параліч, GMFCS IV
Екс-прем, внутрішньошлуночкові крововиливи 3 ступеня, ДЦП
Таблиця 1: Медичний стан учасників.
Середнє добове споживання суміші становило 1032 мл (600-1300 мл) для тих, хто завершив випробування (Рисунок 1).
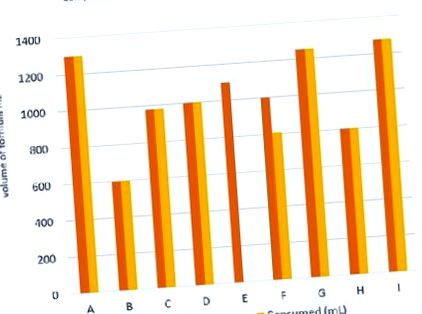
Набрано дев'ять дітей, семеро завершили 7-денну пробу (рис. 2). Одна дитина не закінчила дослідження; дитина була вилучена з дослідження, оскільки вихователь помітив незначне збільшення метеоризму; ця дитина раніше була на кормі, що не містить клітковини. Інша дитина призупинила подачу на 3-й день через помилку користувача. Усі, хто закінчив випробування, переносили 100% низькокалорійної суміші. Одна дитина спостерігала збільшення частоти стільця (зазвичай типу 6) з 2 до 4 разів на день та незначне збільшення метеоризму та здуття живота; було зазначено, що ця дитина також раніше була на кормі, що не містить клітковини, повільне введення кормів, що містять клітковину, у дітей, чутливих до клітковини, може бути корисним.
Малюнок 2: Підсумок завершення учасника.
ОБГОВОРЕННЯ
Діти, які страждають від надмірної ваги та мають неврологічні порушення, мають такий самий ризик ожиріння, як і діти, що страждають ожирінням та іншими супутніми захворюваннями, такими як цукровий діабет 2 типу, серцево-судинні, ортопедичні, неврологічні, печінкові, легеневі та ниркові захворювання [8 ]. У рамках дослідження було залучено дев'ять дітей, яким для вимірювання толерантності та прийнятності потрібна низькокалорійна формула. З дев'яти дітей семеро пройшли 7-денний суд. Подібні цифри набору спостерігались у двох клінічних випробуваннях Khoshoo et al, 1996 та Fried et al, 1992 [6,7]; як і в цих дослідженнях через обмежену кількість дітей, яким потрібен набір низькокалорійного пептидного корму, було складно.
Khoshoo та ін., 1996 р. Завербували десятьох неврологічно ослаблених дітей у віці від 4,5 до 14,5 років, яких випадковим чином перевели у формулу на основі казеїну або на сироватці. Дослідження виявило значне скорочення тривалості та епізодів гастроезофагеального рефлюксу за допомогою формул на основі сироватки (p
Цитування: Thornton-Wood C, Saduera S (2020) Толерантність та прийнятність низькокалорійної педіатричної пептидної формули для ентеральної пробірки: багатоцентрове дослідження у Великобританії. J Neonatol Clin Pediatr 7: 049.
- Трифала; Дивовижна трав'яна формула Анна Велле Аюрведа
- Спеціальна програма формул SCDHEC
- Зондове годування (переважно через ніс у шлунок або безпосередньо у шлунок) у людей із
- Спробуйте ароматизований оцет для підвищення калорійності смаку у своїх рецептах
- Єдина запіканка Формула Ви; Будуть коли-небудь потрібні MyRecipes