Тихоокеанська гавань мікробіоти кишечника в Мексиці: її взаємозв’язок з дієтою та функціональними висновками
Арлетт Пачеко-Сандовал
1 Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, Нижня Каліфорнія, Мексика
Йоланда Шрамм
2 Universidad Autónoma de Baja California, Енсенада, Нижня Каліфорнія, Мексика
Гізела Геккель
1 Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, Нижня Каліфорнія, Мексика
Елізабет Брассеа-Перес
1 Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, Нижня Каліфорнія, Мексика
Марсель Мартінес-Порчас
3 Centro de Investigación en Alimentación y Desarrollo, Ермосільо, Сонора, Мексика
Асунсьйон Лаго-Лестон
1 Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, Нижня Каліфорнія, Мексика
Пов’язані дані
Усі файли послідовності доступні з бази даних SRA NCBI (номери приєднання PRJNA515402 та PRJNA518147).
Анотація
Вступ
Морські тюлені (Phoca vitulina) - це ластоногі з найширшим поширенням у світі, включаючи Північну частину Тихого та Атлантичного океанів [1]. Південна межа розповсюдження тюленя морської гавані на півночі Тихого океану (P. v. Richardii) знаходиться в Мексиці на дев'яти островах із західного узбережжя Нижньої Каліфорнії: Коронадо; Тодос Сантос; Сан-Мартін; Сан-Джеронімо; Сан-Беніто; Седрос; Натівідад; Асунсьйон; і Сан-Роке. Ця межа також охоплює деякі райони вздовж самого узбережжя Нижньої Каліфорнії [2]. Усі острови розташовані відносно недалеко від континентального узбережжя (2–50 км), що робить тюленів уразливими до впливу різних збурень та забруднювачів, що утворюються внаслідок людської діяльності.
Морські тюлені вважаються умовно-патогенними хижаками з високим трофічним рівнем, які харчуються донними або пелагічними або обома видами, переважно рибами та головоногими [3]. Мексиканські морські тюлені харчуються на невеликих глибинах, між 5–50 м [4,5], головним чином донною або донною здобиччю [6–9]. З-поміж ластоногих, знайдених у Мексиці, тюрем гавані дозволив отримати найбільшу кількість інформації про якість їхнього місцевого середовища завдяки їхній вірності місцям вивезення, де вони залишаються цілий рік [2]. На основі даних супутникових передавачів, тепер відомо, що морські тюлені харчуються поблизу своїх колоній (на відстані від 25 км [10] до 30 км [4]); тому очікуються відмінності у типі споживаної здобичі [8,9], оскільки більшість колоній тюленів гавані в Нижній Каліфорнії розділені на більші відстані. Однак відмінності в харчуванні також були виявлені в колоніях, розділених лише 16 км [7]. Ця мінливість дієти може відображатися на мікробіоті тюленів, яка також може виявити наявність шкідливих речовин у навколишньому середовищі.
Дієта морських тюленів багата білками та поліненасиченими жирними кислотами [11], що, як очікується, відобразиться на її складі мікробіоти кишечника [12]. Як уже давно встановлено, дієта значною мірою визначає склад спільноти мікробіоти кишечника [13,14] і вважається основним шляхом колонізації мікробів [15]. Однак існують добре відомі упередження у традиційних методах аналізу дієти, особливо при ідентифікації залишків здобичі, внаслідок ерозії травлення [16]. Нещодавно розроблені методи ДНК, такі як метабаркодування ДНК, виявили здобич, яка не залишає залишків твердих речовин (наприклад, ракоподібних), надаючи більш точну інформацію про дієтичні норми [16].
Мікробіота кишечника відіграє важливу роль в онтогенетичному розвитку хазяїна, фізіології, здоров’ї, фізичній формі та засвоєнні поживних речовин [17,18]. Незважаючи на його важливість, про склад мікробіоти та її функції у морських ссавців відомо мало, частково через труднощі з забором зразків. Різні дослідження вивчали мікробіоти кишечника у неволі або диких ссавців, таких як дюгони [19], ламантин [20], кити [21] та ластоногі [12,22–26], виявляючи більше багатство мікроорганізмів, ніж у їхніх наземні аналоги, що могло бути пов’язано з придбанням морських таксонів бактерій [27]. Наскільки нам відомо, лише в одному дослідженні була досліджена мікробіота кишечника морських тюленів, але у осіб, що перебувають у полоні [12]. З огляду на те, що на мікробний склад сильно впливають фактори навколишнього середовища, існуючі дослідження, проведені на тваринах, що перебувають у неволі, не мають широких можливостей для вивчення впливу мікробіоти кишечника на метаболізм хазяїна в природних середовищах існування людини, де такі фактори, як доступність їжі та клімат, змінюються [28].
Дослідження приматів, які не є людьми, показали, що дослідження мікробіоти кишечника корисні як показники стану здоров’я господаря та можуть допомогти виявити генетичні відмінності між популяціями [29]. Оскільки мікробний склад особин з тієї самої популяції має більше подібностей, ніж у різних популяцій [29], ми очікували побачити відмінності серед мікробіотичної спільноти колоній морських тюленів, представлених тут. Метою цього дослідження була характеристика спільноти мікробіоти кишечника морських тюленів Нижньої Каліфорнії шляхом секвенування області V4 16S рибосомної мікробної ДНК, взятої з зразків калу, для того, щоб зрозуміти роль дієти у формуванні мікробіома кишечника. Ми оцінили взаємозв'язок між мікробіомом кишечника та раціоном як першим підходом до розуміння того, як споживана здобич формує склад і функції мікрофлори кишечника у диких морських тюленів. Ця інформація може також позиціонувати тюленя гавані як екологічний сторожовий вид для узбережжя Нижньої Каліфорнії та його островів.
Матеріали і методи
Етичні заяви
Всі зразки були зібрані, не заважаючи тваринам та не завдаючи їм стресу чи шкоди. Дозволи були надані Міністерством навколишнього середовища та природних ресурсів Мексики (SEMARNAT, SGPA/DGVS/12269/13 та SGPA/DGVS/08370/14), Міністерством внутрішніх справ (SEGOB, UG/211/0087/2014 та UG/211/01022/2014) та біосферний заповідник Ель-Віскаїно (F00.DRPBCPN.000027 та F.00.1.DRPBCPN.00004/2014).
Збір зразків
Двадцять зразків фекалій було зібрано з травня по червень 2014 року в п’яти колоніях морських тюленів, розташованих у Нижній Каліфорнії, Мексика: лиман Пунта Банда (PBE) (n = 5); Острів Тодос Сантос (TS) (n = 3); Острів Сан-Джеронімо (SJ) (n = 4); Острів Натівідад (N) (n = 4); та острів Сан-Роке (SR) (n = 4) (S1 Рис). Координати конкретних пляжів, на яких були зібрані зразки, доступні в метаданих проекту послідовності у сховищі бази даних. Проби відбирали протягом сезону линьки, коли найбільша кількість особин вивозиться [30], як правило, залишається на березі протягом багатьох годин [31]. Кожну пробу збирали індивідуально за допомогою одноразового стерилізованого шпателя. Зразки отримували з внутрішньої частини калу, намагаючись уникнути перехресного забруднення з навколишнього середовища. Зразки калу отримували від пломб без різниці статі та вікових категорій, лише свіжі зразки поміщали в стерильні пробірки, а потім зберігали у RNAlater ® (Sigma-Aldrich). Зразки транспортували до лабораторії та зберігали замороженими при -80 ° C до подальшого аналізу.
Вилучення та секвенування ДНК
Геномну ДНК витягували з 20 індивідуальних зразків калу, включаючи (PBE = 5, TS = 3, SJ = 4, N = 4 та SR = 4), використовуючи міні-набір QIAamp ® DNA Stool Mini (QIAGEN). З кожної проби було використано приблизно 300–400 мг фекального матеріалу. Якість ДНК візуалізували за допомогою електрофорезу в агарозному гелі, а концентрацію визначали за допомогою спектрофотометра Nanodrop ® (Thermo Fisher Scientific).
Гіпервариабельна область V4 гена 16S рРНК була ампліфікована за допомогою двоступеневого методу ланцюгової реакції полімерази (ПЛР). Початкову ПЛР проводили з 10 нг матричної ДНК у реакції 20 мкл із використанням специфічних для регіону праймерів: 16S- F (5'- GTGCCAGCMGCCGCGGTAA-3 ') та 16-R (5'– GGACTACHVGGGTWTCTAAT-3') [32 ]. Програма ПЛР складалася з початкової денатурації при 95 ° С протягом 3 хв і 25 циклів при 95 ° С протягом 30 с, 55 ° С протягом 30 с і 72 ° С протягом 30 с, з остаточним продовженням при 72 ° С. протягом 5 хв. Другу ПЛР проводили з використанням праймерів з набору Nextera XT Index (Illumina), що включав вісім циклів (95 ° C x 30 с; 61 ° C x 30 с; 72 ° C x 5 хв). Реакції ПЛР проводили індивідуально для кожного зразка, і продукти візуалізували за допомогою гель-електрофорезу та кількісно визначали за допомогою набору для аналізу Qubit dsDNA BR (Thermo Scientific) на флуорометрі Qubit 3.0 (Thermo Fisher Scientific). Нормалізацію продуктів ПЛР проводили за допомогою набору SequalPrep TM Normalization Plate (96) (Applied Biosystems ™) згідно з протоколом виробника для отримання кожного амплікона в концентрації 1–2 нг/мкл перед змішуванням.
Пул зразків (1100 мкм), який містив 10 мкл кожного зразка, денатурували 0,2 н. NaOH, розбавляли додатково до 5 п. М. І поєднували з 5% (об./Об.) Денатурованим 5 мкм. . Секвенування проводили в установках секвенування Центру наукових досліджень та вищої освіти в Енсенаді (CICESE) з використанням платформи секвенування MiSeq (Illumina). В якості хімії використовували реактивний набір MiSeq v2, який давав зчитування в парі на кінці 2x150 bp. Початкові заходи контролю якості включали видалення будь-якої послідовності, що містить нерозчинений нуклеотид і короткі послідовності (-20, відсоток ідентичності ≥ 96% та довжина вирівнювання ≥ 100 п.н. Отримані розподіли видів перевіряли вручну, щоб видалити ті види, які не розподілені по всій досліджуваній території виявлені забруднювачі, види, які не є потенційною здобиччю (наземні тварини, мікроорганізми тощо), та послідовності морських тюленів. Базами даних, що використовувались для визначення розподілу та звичок виявленої здобичі, були FishBase (http: // www .fishbase.org/search.php) та SealLifeBase (http://www.sealifebase.org/). Ми використовували пакет R UpsetR [44] для візуалізації кількості видобутих, як спільних, так і унікальних серед колоній морських тюленів.
Функціональне передбачення
Закритий збір посилань OTU був проведений щодо довідкової бази даних GreenGenes (версія 13.5) у QIIME. Програмний пакет біоінформатики Langille Lab, PICRUSt (філогенетичне дослідження спільнот шляхом реконструкції неспостережуваних станів) [45], був застосований на сервері Galaxy і використовувався для прогнозування метагеномного складу спільноти за допомогою даних послідовності 16S рДНК. Коли нормалізували номер копії 16S і передбачали функції метагенома, шляхи KEGG (Кіотська енциклопедія генів і геномів) використовувались для ідентифікації метагеномного вмісту. Статистичне порівняння проводили в програмному забезпеченні R [36] з використанням тесту ANOVA, за яким слідував тест багаторазового порівняння Tukey HSD.
Взаємозв'язок між дієтою та мікробіотою кишечника
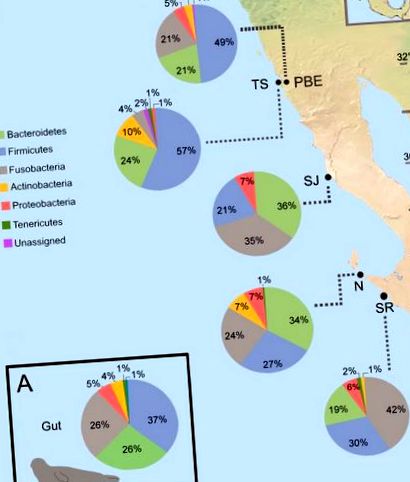
Щоб оцінити взаємозв'язок між дієтою та функцією та складом мікробів кишечника, ми застосували кореляційні тести Спірмена між частотою появи здобичі, на що вказує відносна чисельність бактерій (п'ять найбільш поширених видів та 10 найбільш часто виявлених сімей) та відносна кількість метаболічних шляхів. Ті родини видобутку та види з частотою зустрічальності> 20% були включені, тоді як p Рис. 1A) (Таблиця S1). Раніше повідомлялося про домінування цих видів у мікробіоти кишечника гавані тюленя [12,25]. Як і у інших морських ссавців, морська тюлень має меншу кількість видів Firmicutes, ніж у сухопутних ссавців [26]. Більша частка твердих речовин, ніж бактероїдетів, пов’язана як з більшою ефективністю збирання енергії з їжі, так і з ожирінням у людей та мишей [46]. Високе відношення твердих речовин до бактеріоїдетів, яке спостерігається в кишечнику морських тюленів, могло бути пов’язане з тим, що ці тварини сильно покладаються на відкладення жиру для накопичення енергії та терморегуляції [22,47]. Таким чином, можливо, що морські тюлені покладаються на свої кишкові мікроби, щоб полегшити ефективне накопичення жиру, необхідне для виживання, завдяки збільшеній доступності енергії товстої кишки, як це спостерігається у людей [48].
(А) Загальний склад мікробіоти кишечника на рівні філа. (B) Середня відносна кількість найпоширеніших бактеріальних видів у колоніях морських тюленів, показані лише таксони з відносною чисельністю> 1%. Місця відбору проб морських тюленів на західному узбережжі Нижньої Каліфорнії наведені на малюнку як PBE = лиман Пунта Банда, TS = острів Тодос Сантос, SJ = острів Сан-Джеронімо, N = острів Натівідад, SR = острів Сан-Роке.
На рівні сімейства бактерій було виявлено 19 сімей із відносною чисельністю ≥ 1% та включали бактеріальний порядок Clostridiales, хоча це не було класифіковано на рівні родини. Сімейство Fusobacteriaceae було найпоширенішим сімейством (27%), за ним слідували Ruminococcaceae (16%) та Bacteroidaceae (14%) (рис. 2). Члени сімейства Ruminococcaceae показали сильну позитивну кореляцію з поліненасиченими тригліцеридами дієтичного походження [49], яких багато в здобичі морських тюленів, таких як анчоус та сардина.
Показані лише таксони з відносною чисельністю> 1%. PBE = лиман Пунта Банда, TS = острів Тодос Сантос, SJ = острів Сан-Джеронімо, N = острів Натівідад, SR = острів Сан-Роке.
Фузобактерії (тип Fusobacteria), рід, відомий тим, що виявляє протеолітичну активність в кишечнику людини [47], виявився переважаючим родом в мікробіоті кишечника морських тюленів (25%). Морські ссавці мають більшу кількість фузобактерій, ніж наземні ссавці [26]. Члени цього виду, такі як Fusobacterium, населяють ротову порожнину та кишечник тварин, а також знаходяться в морських відкладах [18]. Морські тюлені можуть придбати ці мікроорганізми з мікробіоти осаду, оскільки вони в основному харчуються донною та донною здобиччю (наприклад, камбала) [6,50]. Придбання цих мікробів може принести корисні нові гени від глобального мікробіома до мікробіома кишечника шляхом горизонтального перенесення генів [18].
В межах типу Bacteroidetes також виявлено багато родів Bacteroides (14%) та інших представників сімейств Rikenellaceae (7%) та Paraprevotellaceae (6%). Рід Bacteroides був пов’язаний з м’ясоїдними дієтами, що характеризуються високим рівнем білків, амінокислот та тваринних жирів [51]. Кодуючи велику кількість вуглеводно-активних ферментів тваринного походження, бактероїди мають високу здатність гідролізувати дієтичні глікани - різновид полісахаридів, отриманих з білків [52]. Отже, велика кількість роду Bacteroides, знайденого в морських тюленях в рамках цього дослідження, узгоджується з їх м’ясоїдними звичками. Ферменти, що містяться в цих типах бактерій, можуть допомогти тюленю гавані отримувати енергію з спожитої здобичі [51]. U U
Firmicutes були представлені представниками сімейств Ruminococcaceae (14%), Clostridiaceae (3%), Lachnospiraceae (1%), Mogibacteriaceae (1%) та Peptostreptococcaceae (1%), а також родами Clostridium (3%), Oscillospira (1%), Faecalibacterium (1%) та Phascolarctobacterium (1%). Сімейства Ruminococaceae і Lachnospiraceae відіграють важливу роль в імунних функціях господаря [53] і зазвичай зустрічаються в травних шляхах багатьох видів ссавців, тоді як велика кількість популяцій відсутня в середовищах, не пов'язаних з господарями [54–56].
Тип протеобактерій був представлений в основному родами Cupriavidus (1%), і Anaerobiospirillum (1%), і представником сімейства Vibrionaceae (1%). У меншій мірі ми виявили представників цього виду, які зазвичай не вважаються присутніми в травному тракті тварин ссавців, родами Photobacterium (0,004%) та Vibrio (0,0005%), про яких повідомляється у більшій кількості у тварин на основі кальмарів дієти, такі як пілоти-кити [57]. Люмінесцентні бактерії Photobacterium та Vibrio є загальними членами мікробіоти кальмарів і можуть бути придбані морськими тюленями через споживання кальмарів [58]. Атопобій (3%) та слакія (1%) були основними представниками типу Actinobacteria.
Порівняння між колоніями
Оскільки мікробний склад кишечника особин з тієї самої популяції має більше схожості, ніж особин з різних популяцій [29], ми очікували виявити відмінності в мікробіоти різних колоній морських тюленів, що вивчались тут. Отримані нами результати показали варіації серед колоній морських тюленів щодо відносної чисельності домінуючої філи (S2 Рис). З 26 спостережуваних типів п’ять внесли> 2% до відмінностей, виявлених серед колоній, на основі результатів, отриманих в результаті аналізу SIMPER (табл. 1). Зміни відносної чисельності членів Firmicutes (33,88%), Fusobacteria (31,95%) та Bacteroidetes (16,86%) в основному пояснюють різницю, що спостерігається (таблиця 1). Згідно з аналізом SIMPER, на сімейному рівні Fusobacteriaceae (25,93%) та Ruminococcaceae (13,19%) найбільше сприяли відмінностям мікробіоти кишечника серед колоній морських тюленів (табл. 1). Члени сімейств Ruminococcaceae та Lachnospirace поширені в кишечнику ссавців і, як відомо, перетворюють вуглеводи в коротколанцюгові жирні кислоти (SCFA) за допомогою ферментації мікробів, а кінцевий продукт поглинається господарем як джерело енергії [59].
Таблиця 1
PBE = лиман Пунта Банда, TS = острів Тодос Сантос, SJ = острів Сан-Джеронімо, N = острів Натівідад, SR = острів Сан-Роке.
- Складний зв’язок між дієтою та здоров’ям - PubMed
- Складний зв’язок між дієтою та охороною здоров’я
- Підйом дієти під керівництвом дієтологів Як я змінив свої стосунки з їжею і досяг своєї мети
- Чому можна; t Я худну, незважаючи на дієту та фізичні вправи Інститут функціональної медицини
- Часи Фіджі; Стародавня Фіджі Тихоокеанський острівний раціон