Терапевтична ефективність перорального трансгенного тютюну з низьким вмістом алкалоїдів, що експресує інтерлейкін-10 людини на миші на коліті
Південний центр захисту рослинництва та досліджень продуктів харчування, сільське господарство та сільськогосподарська їжа Канади, вул. Сандфорд 1391, Лондон, Онтаріо, Канада, N5V 4T3
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Науково-дослідний інститут Робертса, Лондон, Онтаріо, Канада, N6A 5A5
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Plantigen Inc., 700 Collip Circle, Лондон, Онтаріо, Канада, N6G 4X8
Санібрук та Жіночий коледж Науковий центр охорони здоров'я, 2075 Bayview Avenue, кімната A338, Торонто, Онтаріо, Канада, M4N 3M5
Південний центр захисту рослинництва та досліджень продуктів харчування, сільське господарство та сільськогосподарська їжа Канади, вул. Сандфорд 1391, Лондон, Онтаріо, Канада, N5V 4T3
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Науково-дослідний інститут Робертса, Лондон, Онтаріо, Канада, N6A 5A5
Південний центр захисту рослинництва та досліджень продуктів харчування, сільське господарство та сільськогосподарська їжа Канади, вул. Сандфорд 1391, Лондон, Онтаріо, Канада, N5V 4T3
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Науково-дослідний інститут Робертса, Лондон, Онтаріо, Канада, N6A 5A5
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Plantigen Inc., 700 Collip Circle, Лондон, Онтаріо, Канада, N6G 4X8
Санібрук і Жіночий коледж Науковий центр охорони здоров'я, 2075 Bayview Avenue, кімната A338, Торонто, Онтаріо, Канада, M4N 3M5
Південний центр захисту рослин та харчових продуктів, Сільське господарство та сільськогосподарська їжа Канади, 1391 Sandford St., Лондон, Онтаріо, Канада, N5V 4T3
Інститут досліджень охорони здоров’я Лоусона, Лондон, США, Канада, N6A 5A5
Науково-дослідний інститут Робертса, Лондон, Онтаріо, Канада, N6A 5A5
Резюме
Вступ
Спочатку описаний у 1989 р. (Fiorentino та ін., 1989), численні дослідження показали, що IL-10 є потужним протизапальним цитокіном завдяки своїй здатності інгібувати активацію макрофагів і Т-хелпер-1 (Th1) Т-клітин, а також експресію TNF-α ( Вієйра та ін., 1991; Кун та ін., 1993; Шрайбер та ін., 1995). Незважаючи на те, що системне введення IL-10 показало очевидну користь для стійких до стероїдів CD та UC, на жаль, у довгострокових дослідженнях клінічна користь та ендоскопічне поліпшення запалення кишечника у пацієнтів з помірно активним та хронічним активним CD були компенсовані шкідливим впливом на рівень еритроцитів і тромбоцитів, які, ймовірно, були пов’язані із системним (підшкірним) введенням більш високих доз IL ‐ 10 (> 10 мкг/кг) (Schreiber та ін., 2000). Щоб уникнути токсичності, пов’язаної із системним введенням, Steidler та ін. (2000) використовували внутрішньошлунковий прийом Lactococcus lactis секрецію IL-10 для зменшення запалення в IL-10 -/- та декстрансульфат натрію (DSS) мишачих моделей коліту. У подальших дослідженнях тимідин-залежний штам Лактокок був використаний для вирішення питань біобезпеки та потенційних втеч модифікованих організмів в навколишнє середовище (Steidler та ін., 2003).
Результати і обговорення
Експресований рослиною IL-10 не глікозильований
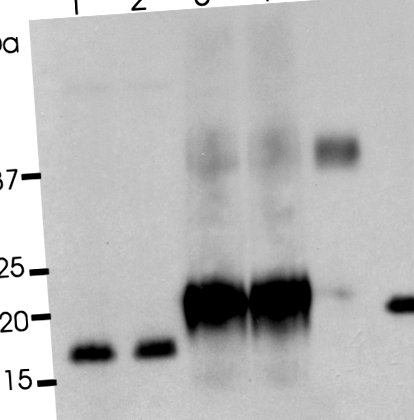
Рослинний рекомбінантний людський інтерлейкін-10 (pIL-10) не глікозильований. Рекомбінантний IL-10 (rIL-10), pIL-10 та рекомбінантний еритропоетин (rEPO) обробляли в буфері деглікозилювання протягом 2 годин при 37 ° C з або без PNGase F. Доріжка 1, rIL-10; доріжка 2, rIL ‐ 10 з PNGase F; доріжка 3, pIL ‐ 10; провулок 4, pIL ‐ 10 з PNGase F; доріжка 5, rEPO; доріжка 6, rEPO з PNGase F.
Експресований рослиною IL-10 стійкий до перетравлення шлункової та кишкової рідини
Очищений білок IL-10 є кислотонестійким і швидко руйнується в умовах низького рН (Syto та ін., 1998). Оскільки ми мали намір доставити rIL ‐ 10, експресований в рослинній тканині, як харчову добавку, критично важливо було визначити, чи стійкий pIL ‐ 10 до деградації шлунково-кишкового тракту, і чи сприяє рослинний клітинний матрикс будь-якому захисту від ферментів та Умови рН. В пробірці дослідження з модельованими розчинами травлення широко використовуються як моделі травлення тварин для дослідження контрольованого вивільнення експериментальних фармацевтичних препаратів (Доерті та ін., 1991), а також засвоюваність рослинних і тваринних білків та харчових добавок (Zikakis та ін., 1977; Тільч та Еліас, 1984). Тому ми порівняли стабільність hIL ‐ 10, виробленого в трансгенних рослинах, або вбудованому в ліофілізовану тютюнову тканину, або очищеному з рослинної тканини, використовуючи змодельовану шлункову рідину (SGF, 3,2 г/л пепсину, рН 1,2) для моделювання стану шлунку та імітація кишкової рідини (SIF, 10 г/л панкреатину, рН 6,8) для проксимальних станів тонкої кишки. Усі експерименти з травлення проводились з нативними димерними білками rIL ‐ 10 та pIL ‐ 10, для яких раніше було доведено, що є біологічно активними (Menassa та ін., 2001).
За відсутності рослинного матеріалу очищений рослинний рекомбінантний людський інтерлейкін-10 (pIL-10) порівнювали з рекомбінантним IL-10 (rIL-10). IL-10 було виявлено імуноблотінгом після перетравлення rIL-10 (a, c) та pIL-10 (b, d) в імітованій шлунковій рідині (SGF) при кислому (a, b) та нейтральному (c, d) pH. Заповнені зірки позначають мономер IL-10; відкриті зірки позначають димер IL ‐ 10. pIL ‐ 10 трохи більше, ніж rIL ‐ 10 через C ‐ кінцеву мітку (Menassa та ін., 2001).
Виявлення інтерлейкіну-10 (IL-10) за допомогою імуноферментного аналізу (ІФА). (a) Лікування ліофілізованого листя в імітованій шлунковій рідині (SGF) при нейтральному або кислому рН. (b) Лікування очищеного рекомбінантного IL-10 (rIL-10), рослинних рекомбінантних людських IL-10 (pIL-10) або ліофілізованих листя, що експресують IL-10, у імітованій кишковій рідині (SIF).
Миші добре переносять хронічне пероральне вживання тютюну з низьким вмістом нікотину
Було показано, що нікотин впливає на запалення як у пацієнтів з UC, так і у CD (Birrenbach and Bocker, 2004). Хоча нікотин негативно впливає на єюніт, він, як видається, покращує коліт у мишей IL-10 -/-, вказуючи на наявність безпосереднього впливу нікотину на імунну систему (Еліакім та ін., 2001). Тому було важливо забезпечити, щоб вплив навіть невеликих кількостей нікотину в тютюні з низьким вмістом алкалоїдів не змішував спостереження у мишей, яких годували тютюновою тканиною. Тютюн з низьким вмістом алкалоїдів, вирощений у камерах із контрольованим середовищем, містив від 1,5 до 3,1 мкг нікотину/г сухої маси (РГ) (Таблиця 1). Розрахована максимальна експозиція менше 6 мкг на день була значно нижчою за рівні експозиції 75 мкг на день, що мало ефект на мишей IL-10 -/- (Eliakim та ін., 2002). Відповідно до цього, не було різниці в будь-якому клінічному параметрі, прирості ваги або гістології кишечника у мишей, яким давали лише рослинні тканини тютюну з низьким вмістом нікотину порівняно з тими, хто отримував нормальну чау (не показано).
| Випробування 1 | C57BL/6 | 8 | 20 | 2.9 | 5.2 | 2.68 |
| Випробування 2 | C3H | 8 | 20 | 3.1 | 2 | 4.5 |
| Випробування 3 | C3H | 5 (контроль), 10 (група IL-10) | 30 | 1.5 | 1.4 | 6 |
- * Мінливість вмісту нікотину та IL-10 є результатом різниці в умовах росту різних партій, тобто різних камер росту, різного віку рослин під час збору врожаю.
(а) Дослідження токсичності тютюну. Середній відсоток приросту ваги мишей дикого типу В6, яких годували звичайним чау, вирощеним у польових умовах високонікотиновим тютюном (C, 7 мг нікотину/г сухої маси) або вирощеним у польових умовах тютюном з низьким вмістом нікотину (LN, 0,6 мг нікотину/г сухої маси ) або на 10%, або на 20% від дієти (мас./мас.) протягом 7 тижнів. (b) Загальні показники гістології кишечника для мишей C57BL/6 з нульовим інтерлейкіном ‐ 10 (IL ‐ 10 -/-), яких годували регулярною чау-їжею (n = 8), вирощений тютюн, вирощений у камері (LN 20%, 2,9 мкг нікотину/г сухої маси, n = 8) або вирощений в камері вирощування тютюн, що експресує IL-10 (LN 20% IL-10, 5,2 мкг нікотину/г сухої маси, 2,68 мкг IL-10/г сухої маси, n = 8) на 20% раціону. Зрізи оцінювали за виразками, інфільтратом, пошкодженням епітелію та лімфоїдними фолікулами. Наведені дані стосуються тонкої кишки. Стовпчики позначають стандартну помилку; зірочка вказує на значну різницю в P = 0,002.
Експерименти з годуванням мишей тютюном, що експресує IL-10
(a) Середній відсоток приросту ваги інтерлейкіну-10 нульових (IL-10 -/-) C3H мишей, яких годували звичайною чау-сумішшю, вирощеною з низьконікотиновим тютюном (LN, 3 мкг нікотину/г сухої маси) або трансгенним низьконікотиновим тютюном тютюн, що експресує IL-10 (LN IL-10, 6 мкг IL-10/г сухої маси) при 30% дієти протягом 30 днів. (b) Загальні показники гістології кишечника для мишей C3H IL ‐ 10 -/-, яких годували регулярним чау (n = 13), вирощений тютюн, вирощений у камері (LN, 2,9 мкг нікотину/г сухої маси, n = 12) або вирощений в камері вирощування тютюн, що експресує IL-10 (LN IL-10, 5,2 мкг нікотину/г сухої маси, 2,68 мкг IL-10/г сухої маси, n = 18) при 20% або 30% раціону. Зрізи оцінювали за виразками, інфільтратом, пошкодженням епітелію та лімфоїдними фолікулами. Наведені дані поєднують товсту і тонку кишку з 20% і 30% груп, що годуються тютюном, у складений бал. Стовпчики позначають стандартну помилку; зірочки означають значну різницю в P = 0,004.
Годування тютюну, що містить IL-10, впливає на експресію гена цитокінів кишечника
Порівняно мало досліджень вивчали вплив впливу IL-10 на експресію гена цитокінів в природних умовах. У мишачих макрофагів від мишей IL-10 -/- і TNF-α, і IL-1β регулювались вниз, а жодні гени цитокінів не регулювались при застосуванні IL-10 (Lang та ін., 2002). На противагу цьому, IL-10 регулюється вниз TNF-α та індукує IL-1α та IL-1β в мононуклеарних клітинах людини в пробірці, без впливу на експресію IL-2, IL-4 та інтерферону-γ (IFN-γ) (Вільямс та ін., 2002; Юнг та ін., 2004). В природних умовах аналізи профілів транскриптів цитокінів у хворих на псоріаз, які проходили лікування IL-10, продемонстрували вплив лише на IL-24, який є членом цитокінів сімейства IL-10 (Jung та ін., 2004). Можливо, ці різні результати відображають варіацію видів або відмінності, пов'язані з конкретними популяціями клітин. Хоча молекулярна основа імунодепресивних ефектів IL-10 не з'ясована повністю, у більшості випадків IL-10 має глибоку регуляторну здатність щодо прозапального цитокіну TNF-α, і терапевтично це видається важливим, враховуючи доведене ефективність антитіл, що блокують TNF-α при ВЗК.
Рівні стійкого рівня фактору некрозу пухлини-α (TNF-альфа), інтерлейкіну-1β (IL-1бета) та ІР-2 мРНК у мишей C3H, які годували 30% тютюну у своєму раціоні. мРНК, витягнуту з тонкої кишки кожної миші, об'єднували та аналізували за допомогою ланцюгової реакції зворотної транскриптази-полімерази в реальному часі (RT-PCR). Результати нормалізували до гліцеральдегід-3-фосфатдегідрогенази (GAPDH). Рівень експресії в рослинному контролі встановили на рівні 100, а обробку тютюну, що експресує IL-10, виразили як відсоток від контролю. IL ‐ 10, миші годували 30% тютюну, що експресує IL ‐ 10; P ‐ C, мишей, яких годували контрольним тютюном.
Використання тютюну з низьким вмістом алкалоїдів у цьому дослідженні дозволило хронічну доставку IL-10 мишам без великої обробки рослинної тканини, а мінімізація обробки викликає заклик як з точки зору вартості, так і стабільності цитокінів. Нікотин - основний алкалоїд тютюну, який складає близько 95% загального вмісту алкалоїдів. Хоча спостерігалося зниження нікотину більше ніж на 90% у вирощеному в польових умовах низькоалкалоїдному тютюні та на 99,9% за рахунок використання камер росту, вплив на людину невеликих кількостей нікотину та навіть менших кількостей незначних алкалоїдів норнікотину, анатабіну та анабазин, щодня даються, невідомі (оглянуто в Hukkanen та ін., 2005). Подальші звичайні та молекулярні селекційні спроби можуть дозволити збагачення трансгенних цитокінів та подальше зниження рівня алкалоїдів до рівнів, які дозволять проводити клінічні випробування з трансгенним тютюном (Сато та ін., 2001).
Це дослідження вперше демонструє здатність перорально введеної трансгенної тютюнової тканини з низьким вмістом алкалоїдів, що експресує IL-10, послаблювати травмування кишечника на мишачій моделі ВЗК та інгібувати експресію TNF-α безпосередньо в місцях запалення. Оскільки IL-10 та, можливо, інші терапевтичні цитокіни, експресовані в рослинному матриксі, є біологічно активними та мають підвищену стійкість до деградації шлунково-кишкового тракту, використання трансгенних рослин як систем експресії та доставки може мати привабливі переваги перед сучасними терапевтичними засобами при ВЗК. Цей підхід для послаблення прозапальної експресії цитокінів у кишечнику може стати важливим новим підходом у місцевій та просвітницькій терапії запалення кишечника.
Експериментальні процедури
Експерименти з деглікозилювання
Очищені pIL ‐ 10, rIL ‐ 10 та рекомбінантний EPO деглікозилювали PNGase F (New England Biolabs, Pickering, ON) в обсязі 50 µL при 37 ° C протягом 2 годин, згідно з інструкціями виробника. Деглікозильовані білки відокремлювали на 12% гелі електрофорезом додецилсульфат-натрію-поліакриламід-гель (SDS-PAGE) та промокали на мембрану полівінілідендифториду (PVDF). Імунодетекцію проводили за допомогою біотінільованих поліклональних козячих антитіл до IL-10 (R&D Systems, 1: 1000) та антитіл до ЕРО у кроликів (1: 1000), а потім - стрептавідин-пероксидази хрону (HRP) (BD Pharmingen, 1: 3000 ) та анти-кролячий IgG – HRP (Bio-Rad, 1: 3000). Виявлення проводили за допомогою хемілюмінесцентних реагентів ECL (Amersham Biosciences, Квебек, Канада).
Травлення в імітованій шлунково-кишковій рідині
rIL ‐ 10 отримували у вигляді 100 мкг/мл маточного розчину (BD Pharmingen). pIL-10 очищали за допомогою іммобілізованої іонної хроматографії з трансгенних рослин тютюну, що експресують ген hIL-10 під контролем промотору 35S (Menassa та ін., 2001). rIL ‐ 10 та pIL ‐ 10 (150 нг) перетравлювались у SGF та SIF (Опікунська рада, 2000) у концентрації 1 нг/мкл протягом певного періоду часу (0 с, 15 с, 30 с, 1 хв.), 5 хв, 15 хв і або 30 хв, або 60 хв) при 37 ° C. У кожен момент часу брали аликвоти 10 нг IL-10 і реакцію травлення зупиняли додаванням Na2CO3 до кінцевої концентрації 45 м м. Для перетравлення в SGF при нейтральному рН SGF нейтралізували Na2CO3 перед тим, як проводити розщеплення білка. Зразки аналізували за допомогою імуноблотингу або імуноферментного аналізу (ELISA), як описано в Menassa та ін. (2001).
Для аналізу захисного ефекту тканини листя на pIL ‐ 10, зрілі листя, що експресують pIL ‐ 10, висушували ліофілізацією та подрібнювали у дрібний порошок за допомогою блендера. Для кожного часового моменту 0,7 г тканини листя змішували з 5 мл SGF або SIF, і реакцію гасили через відповідний інтервал 2 мл 160 м м Na2CO3. Перетравлені зразки екстрагували в буфері для екстракції [забуференний фосфатом сольовий розчин, 0,05% (об/об) Твін 20, 2% (об/об) полівінілполіпіролідону (PVPP), 1 мМ фенілметилсульфонілфториду (PMSF), 1 мкг/мл лейпептину, рН 7,4 ] та очищений центрифугуванням при 13000 g протягом 15 хв при 4 ° C. Залишковий IL-10 кількісно визначали методом ІФА.
Дослідження годування мишей та IL-10
Колонія мишей В6 утримувалася в приміщенні для тварин в Університеті Західного Онтаріо, Онтаріо, Канада. Експерименти на тваринах проводились відповідно до рекомендацій Канадської ради з догляду за тваринами за протоколами, затвердженими Підкомітетом з використання тварин у нашій установі. Шеститижневих мишей В6 годували протягом 7 тижнів звичайним чау чи регулярним чау з додаванням 10 або 20% низьконікотинового або нормально нікотинового вирощеного, ліофілізованого тютюну. Групи лікування складалися з трьох мишей, яких утримували в одній клітці. Контрольна група складалася з чотирьох мишей, розміщених разом. Корм додавали в клітини кожні 2 дні, щоб становило 5 г на мишу на день. Після закінчення 2-х днів у спорожнені контейнери в клітці додавали їжу. Мишей зважували індивідуально на початку експерименту, а потім щотижня.
Дві колонії нульових мишей IL-10 були створені в бар'єрних умовах і утримувались у приміщенні для тварин в Університеті Західного Онтаріо. Засновник нульових мишей IL ‐ 10 на оригіналі C57BL/6 (B6), а також зворотним схрещуванням (n = 10) Фонові штами C3H були щедро надані д-ром Е. Лейтером (лабораторія Джексона, Бар-Харбор, штат Мексика, США), і описано їх походження (Farmer та ін., 2001; Mahler and Leiter, 2002). Для годівлі IL-10 насіння з високоекспресуючої гомозиготної лінії IL-10 пророщували та вирощували в камерах з контрольованим середовищем. Листя швидко заморожували в рідині N2 і ліофілізували. Суху тканину подрібнювали, перемішували, аналізували на концентрацію IL-10 методом ІФА (Menassa та ін., 2001) та щодо вмісту алкалоїдів за допомогою капілярної газової хроматографії, як описано раніше (Суд та ін., 1992). Загальний розчинний білок визначали кількісно, використовуючи метод Бредфорда (Bradford, 1976).
Аналіз цитокінових профілів у оброблених та необроблених мишей
РНК виділяли із зразків тканин кишечника та селезінки за допомогою реагенту TRIzol (Invitrogen). РНК від різних тварин в одній і тій же групі обробки об'єднували, і 5 мкг використовували для зворотної транскрипції з оліго-dT та системою синтезу першої нитки SuperScript для ланцюгової реакції зворотної транскриптази-полімерази (RT-PCR) (Invitrogen). Генспецифічні праймери були розроблені після Оверберга та ін. (2003). ПЛР проводили за допомогою LightCycler (Roche) та LC FastStart DNA Master SYBR Green I Kit (Roche). Отримані дані аналізували за допомогою програмного забезпечення LightCycler, і відносні кількості кДНК оцінювали за стандартною кривою, розрахованою з розведень того самого фрагмента, клонованого в плазміді, як описано Овербергом та ін. (2003).
Статистичний аналіз
Односторонній дисперсійний аналіз (anova) або т‐Тести (однобічний розподіл) із використанням статистичного програмного забезпечення Statview (SAS, Cary, NC, USA) використовувались як відповідні для порівняння між групами лікування в експериментах з годуванням. Дані збирали з окремих експериментів у кожному дослідженні для статистичного аналізу. A P значення 0,05 вважалося значущим.
- Тютюнові рогаті черви стають колібрі-метеликами - розширення UFIFAS, округ Вакулла
- The Human Trust Владивосток Огляд Hollywood Reporter
- Значення заліза для здоров’я людини оновлено
- Програма основ основ харчування людини (Інтернет-майстер)
- Таблиця 1 Періодичне голодування як частина управління Т2ДМ від тваринних моделей до людини