Шлях Бегемота, р53 та холестерин
Яель Айлон
Відділ молекулярно-клітинної біології Інституту науки Вейцмана, Реховот, Ізраїль
Моше Орен
Відділ молекулярно-клітинної біології Інституту науки Вейцмана, Реховот, Ізраїль
АБСТРАКТ
Збільшення швидкості синтезу холестерину та ліпідів давно визнано важливими аспектами метаболічного переключення, яке відбувається під час ракової трансформації. Багато генів, що кодують ферменти, що беруть участь у біогенезі холестерину та жирних кислот, є мішенями транскрипції білків, що зв’язують регуляторні елементи стеролу (SREBP). SREBP діють як центр для метаболічних та проліферативних сигналів; їх діяльність є центром перетягування каната між супресорами пухлини, які загалом пригнічують функцію SREBP, та онкогенами, які часто сприяють діяльності SREBP і покладаються на неї. Шлях Бегемота відіграє центральну роль у координації проліферації клітин та розмірів органів, тоді як p53 є важливим супресором пухлини, який підтримує метаболічний гомеостаз та організовує реакції клітинного стресу. Разом сигнальні шляхи Бегемота та p53 співпрацюють на багатьох рівнях для точної настройки активності SREPB та регулювання рівня холестерину/ліпідів. Інгібітори біосинтезу холестерину, такі як статини, приваблюють концептуально, але ще не мали незаперечного впливу на розвиток раку. На щастя, складна регуляція навколо мережі Hippo-p53-SREBP потенційно забезпечує широкий інтерфейс для додаткових нових втручань, спрямованих на боротьбу з раком.
Вступ
Холестерин - це унікальний ліпід, необхідний для біогенезу мембран, проліферації клітин та диференціації клітин. 1 Він є попередником стероїдних гормонів, жовчних кислот і вітаміну D. Холестерин доступний за допомогою дієти, але також синтезується в печінці, тонкому і товстому кишечнику та додаткових тканинах. Він розподіляється по всьому тілу через ліпопротеїни низької щільності (ЛПНЩ) та ліпопротеїни високої щільності (ЛПВЩ). Клітини ссавців синтезують холестерин за допомогою багатоступеневого ферментативного процесу, утворюючи численні метаболіти, які опосередковують фізіологічні процеси, процеси розвитку та пухлини. 1
Було показано, що надлишок холестерину сприяє зростанню пухлини молочної залози та інвазійності на кількох трансгенних моделях мишей. 2-4 У людей гіперхолестеринемія є незалежним фактором ризику раку молочної залози 5-7 та зниження реакції пухлин на ендокринні методи лікування. 8 Це частково пов'язано з тим, що деякі метаболіти холестерину (наприклад, 27-гідроксихолестерин), хоча і відрізняються за своєю структурою, можуть мати подібні способи дії, як естроген, збільшуючи проліферацію клітин раку молочної залози, позитивних до рецепторів естрогену. 9-11 Варто зазначити, що було показано, що інші метаболіти, пов’язані з холестерином, інгібують пухлину. 12
Клітинний рівень холестерину тісно пов’язаний із шляхом SREBP-мевалонату. 13 Геном ссавців містить 2 гени SREBP: SREBP1 і SREBP2, які кодують відповідні фактори транскрипції, специфічні для послідовності. Разом білки SREBP безпосередньо активують безліч генів, присвячених синтезу та засвоєнню холестерину, жирних кислот, тригліцеридів та фосфоліпідів. 13,14 SREBP1 головним чином регулює біогенез ліпідів, тоді як гени, що беруть участь у синтезі холестерину, переважно трансактивуються SREBP2. 15-17 Дві ізоформи SREBP1, SREBP1a та SREBP1c, утворюються за допомогою використання альтернативних промоторів; SREBP1c (з більш коротким доменом трансактивації і, отже, слабшою транскрипційною активністю) переважно експресується в печінці, тоді як в інших органах SREBP1a є більш поширеним.
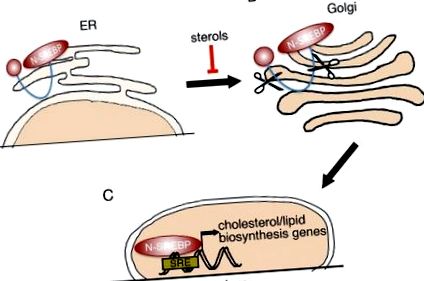
Всі три білки синтезуються як неактивні попередники (P-SREBP), зв’язані з ендоплазматичною сіткою (ER) 18 (рис. 1А). Коли клітини виснажуються холестерином, білки P-SREBP супроводжуються до апарату Гольджі (рис. 1B). У Гольджі P-SREBP послідовно розщеплюється двома різними протеазами, щоб звільнити N-кінцевий транскрипційно активний домен (N-SREBP, рис. 1C). N-SREBP потрапляє в ядро і сприяє програмі синтезу ліпогенного/холестерину, зв'язуючись з його консенсусними ділянками. 14 Коли вміст холестерину в клітині підвищується, P-SREBP утримуються на мембрані ER, вимикаючи транскрипцію генів-мішеней. 13 Таким чином, SREBP одночасно впливають і впливають на рівень клітинного холестерину.
Обробка SREBP. (A) Фактори транскрипції SREBP синтезуються як неактивні попередники (P-SREBP), що утримуються на мембрані ER. Коли внутрішньоклітинний рівень стерину стає низьким, P-SREBP вивільняється з мембрани ER і переноситься в апарат Гольджі. (B) SREBP в апараті Гольджі зазнає 2 послідовних події протеолітичного розщеплення. (C) N-кінцева частина SREBP (N-SREBP), що містить домен активації транскрипції та домен, що зв'язує ДНК, переноситься в ядро, де вона може зв'язувати елементи відповіді на стерол (SRE) та регулювати експресію асоційованої мішені гени.
LATS2 та p53 співпрацюють для обмеження клітинної активності SREBP
Не дивно, що SREBP діють як центр для метаболічних та проліферативних сигналів і високо регулюються шляхами, пов’язаними з раком. Разом вони становлять мережу вищого порядку, яка утворює молекулярну основу для визначення рівня клітинного холестерину в станах здоров'я та захворювань, включаючи рак. Як обговорюється нижче, супресори пухлини часто інгібують активність SREBP, тоді як онкогени збільшують та/або залежать від активності SREBP. Це являє собою битву за метаболічний контроль, яка неминуче псується, коли клітини переживають неопластичну трансформацію.
Сигнальний шлях Бегемота є критичним регулятором клітинної проліферації та диференціації. Центральним для цього шляху є основний кіназний каскад супресорів пухлини MST1/2, LATS1/2 та адаптерних білків SAV1 та MOB1/2. 19 с Ці білки утворюють консервативну касету кінази ("Бегемот"), яка обмежує ріст тканини та проліферацію клітин-попередників, як правило, шляхом фосфорилювання та інактивації транскрипційних коактиваторів YAP та TAZ. Бегемот-фосфорильований YAP/TAZ секвеструється в цитоплазмі і готується до швидкої протеасомної деградації, тим самим пригнічуючи їх транскрипційну активність та їх позитивний вплив на ріст та проліферацію тканин. 20-22 У нормальних тканинах цілісність шляху Бегемота тримає клітини в контролі та запобігає їх неконтрольованій проліферації. І навпаки, дисфункція шляху Бегемота може призвести до конститутивної активації YAP/TAZ і пов'язана з багатьма типами раку. 23
p53 є основним супресором пухлини, мутаційно інактивованим приблизно в половині всіх випадків раку людини. 24,25 З огляду на свою центральну роль у забезпеченні цілісності геному та елімінації клітин, що містять дефектні геноми, р53 було названо "охоронцем геному". 26 Кілька років тому було виявлено, що LATS2 - ключовий компонент основного шляху бегемота - сприяє стабілізації та активації p53 у відповідь на пошкодження мітотичного механізму та активацію онкогену, сигнали від декількох типів стресу, що загрожує геному. Нещодавно було показано, що LATS2, разом із його паралогом LATS1, сприяє канонічним супресивним властивостям p53 також у базальних умовах, за відсутності вираженого генотоксичного стресу. 28 Крім того, p53 зв'язує і трансактивує промотор LATS2, таким чином визначаючи позитивний цикл зворотного зв'язку. 27,29,30 (рис. 2А та 3, "А"). Ця вісь LATS2-p53 тісно поєднує два важливі шляхи супресору пухлини, p53 та бегемота, не тільки у відповідь на генотоксичні образи, але також у фізіологічних процесах, таких як індукована диференціація клітин. 31
LATS2 p53 та перехресні зв’язки з холестерином. (A) LATS2 і p53 позитивно регулюють один одного, інгібуючи синтез холестерину. Надмірний рівень холестерину активує вісь LATS2-p53. Зеленими стрілками зображено позитивне регулювання, а червоними лініями позначено негативне регулювання. (B) Запропонована бістабільність, що регулює взаємодію LATS2-p53 на рівні холестерину. Реакція на збільшення введення (наконечники стрілок вгору) відрізняється від реакції на зменшення введення (наконечники стрілок вниз). Активація LATS2-p53 спрацьовує вище рівня порогового рівня холестерину, щоб досягти стану “В.” Після того, як петля зворотного зв'язку активна, вона підтримує свою активність, так що поріг інактивації зміщується до нижчого рівня холестерину, досягаючи стану «А». Таким чином, петля зворотного зв'язку забезпечує стійкість до коливань між станами «А» та «В».
Часткова картина) регуляторної мережі SREBP. Вісь LATS2-WTp53 (A) інгібує обробку P-SREBP (B) та транскрипцію мРНК SREBP (C). Мутант p53 (mutp53) пов'язує N-SREBP і посилює його транскрипційну активність (D). YAP/2AZ залежать від шляху мевалонату за своєю активністю (E). AMPK інгібує обробку P-SREBP (F). RNF20 убіквітує SREBP і сприяє його деградації (G).
Мережа з SREBP
Важливі процеси в клітині зазвичай жорстко регулюються на різних рівнях. Більше того, окремі та «лінійні» шляхи часто переплітаються, утворюючи інтегровані та скоординовані мережі сигналізації. Тому не дивно, що шляхи бегемота та p53 перетинаються з метаболізмом холестерину за допомогою додаткових механізмів, що виходять за межі осі LATS2-p53, описаних вище.
Як уже зазначалося, p53 транскрипційно репресує експресію SREBP1c, а також 2 його ліпогенних цільових генів, синтази жирних кислот (FASN) та цитратліази АТФ (ACLY) 34 (рис. 3, "C"). Більше того, при глюкозному голодуванні p53 індукує LIPIN1, ключовий модулятор SREBP. 39,40 Важливо, що багато з цих транскрипційних ефектів проявляються p53 також в базальних умовах, за відсутності помітного стресу, тим самим дозволяючи p53 тонко налаштовувати ліпідний метаболічний ландшафт відповідних клітин і тканин.
Мутантні форми р53 (mutp53) із збільшенням функції зустрічаються приблизно в 50% усіх видів раку. 41 Цікаво, що було показано, що mutp53 зв'язує SREBP1 та SREBP2 та збільшує транскрипцію їх генів-мішеней 42 (рис. 3, "D"). У клітинах, що містять мут53, регуляція шляху мевалоната за допомогою цього механізму є достатньою, щоб порушити морфологію клітин і викликати злоякісні фенотипи, такі як інвазія. 42 Таким чином, дикий тип (WT) і mutp53 реалізують двоїстість інь-янь протилежних функцій, WT p53 інгібує і mutp53 посилює активність SREBP. Це також свідчить про те, що обмеження вироблення холестерину є центральним для супресивної ролі пухлини WT p53.
Як уже згадувалося вище, YAP/TAZ є ефекторами шляху гіппопотоків. Характерно, що рівні білка YAP/2AZ та транскрипційна активність інгібуються кіназами LATS1/2. 21,43 Недавні дослідження 44-46 показали, що особливості YAP/TAZ, що сприяють розвитку раку, залежать від рівня холестерину та активності шляху SREBP-мевалонату (рис. 3, "Е"). Механічно, підтримана ядерна активність YAP/TAZ, у поєднанні зі зниженим інгібуючим фосфорилюванням YAP/TAZ, пов'язана з геранілгеранілуванням Rho small GTPases 44 і цілісністю цитоскелета F-актину, 45 обидва з яких регулюються SREBP. У свою чергу, сам ЯП може сприяти транскрипції декількох генів, що беруть участь в метаболізмі холестерину. 45 Насправді, mutp53 та YAP фізично взаємодіють та спільно керують транскрипцією. Що цікаво, було показано, що інгібування шляху мевалонату шляхом лікування статинами зменшує транскрипційні ефекти mutp53 залежно від YAP. 47 Разом із цими спостереженнями випливає, що шлях мевалонату має вирішальне значення як регулятор вищої течії, так і як ефектор низхідного ефекту онкогенних функцій mutp53 та YAP.
Слід зазначити, що у вищезазначених дослідженнях LATS1/2 виявляється необхідним для фосфорилювання YAP/TAZ у відповідь на лікування статинами; 44,45 це суперечить уявленню, що статини діють через простий лінійний шлях Бегемота. Примітно, що незалежна від LATS1/2 активність YAP спостерігалась і в інших контекстах, 48 маючи на увазі, що інші кінази також здатні націлювати та інгібувати YAP/TAZ. Цікавим кандидатом може бути АМФ-активована протеїнкіназа (АМРК), 49-51 - головний регулятор метаболізму і сам по собі інгібітор обробки SREBP 52 (рис. 3, “F”). Буде цікаво розгадати молекулярні події, які перекривають канонічну сигналізацію Бегемота та обходять негативне регулювання YAP/TAZ за допомогою LATS1/2.
Подібним чином, деякі супресивні функції пухлини компонентів шляху бегемота, здається, не залежать від YAP. 53 Справді, LATS2 має зростаючий спектр функцій, включаючи підтримку стабільності геному, індукцію апоптозу, контроль клітинного циклу та тетраплоїдії, інгібування міграції клітин та регулювання диференціації стовбурових клітин, які виходять за рамки регулювання YAP/TAZ. 27,28,31,38,54-63 Аналогічним чином, роль LATS2 у інгібуванні SREBP1/2 не залежить від YAP. 32 Таким чином, LATS2, як видається, застосовує різнобічну стратегію пригнічення активності SREBP, шляхом (1) безпосереднього зв’язування та інгібування обробки цитоплазматичного P-SREBP, 32 (2), регулюючи рівень білка p53, і тим самим, ймовірно, посилюючи інгібуючий ефект p53's SREBP., і (3) можливо, також діючи разом з LATS1, за допомогою канонічного шляху Бегемота, для гальмування ядерного накопичення YAP, тим самим побічно гасячи залежний від YAP вихід SREBP. 45
Безсумнівно, діяльність SREBP регулюється безліччю факторів, що перевищують згадані вище. Наприклад, зрілі N-SREBP - це нестабільні білки, які вкрай регулюються за допомогою убиквітинації та протеасомної деградації. 64,65 Білок RNF20 - це лігаза E3, яка головним чином керує монобіквітіляцією гістону H2B для регулювання експресії генів та особливостей, пов'язаних з раком. 66-68 Однак, нещодавній звіт 69 пов'язує RNF20 також із повсюдним поширенням та посиленою протеасомною деградацією SREBP (рис. 3, "G"). Цікаво, що виснаження RNF20 зменшує транскрипцію p53 66, що передбачає ще один потенційний механізм координації між придушенням пухлини та синтезом холестерину.
Регулювання переробки білка та компартменталізація часто розвиваються для вирішення проблем проміжних проміжних шляхів токсичних шляхів, конкуруючих ферментативних реакцій або повільних темпів обороту. 73 Загалом посттрансляційний контроль забезпечує швидку швидкість відповіді. Одним з ефективних посттрансляційних механізмів є протеолітична активація ключового регуляторного білка, як ілюструє SREBP. Проте, оскільки протеоліз є термодинамічно сприятливою і незворотною реакцією, запобігання неконтрольованій обробці за допомогою тимчасової та компартменталізованої оклюзії, наприклад для ER у випадку P-SREBP, це перевага для надійності шляху. З іншого боку, посттрансляційні ковалентні модифікації, зокрема фосфорилювання, швидко оборотні і дозволяють існуючим білкам перемикатися між активованими/інактивованими станами без необхідності синтезу білка de novo або протеолітичної обробки. 74 Однак обидва способи посттрансляційної регуляції мають високі енергетичні витрати на вироблення білків, які потенційно можуть залишатися у своєму "марнотратному" неактивному стані, якщо клітина не зустрічає відповідний активуючий тригер.
Координація транскрипції з транслокацією P-SREBP з ER та обробка P-SREBP, пов’язаного з Гольджі, може отримати спільні переваги обох регуляторних рівнів. Вимкнення транскрипції та обробки SREBP може створити подвійне безпечне "гальмо" проти надмірного синтезу холестерину. З іншого боку, модуляція ступеня посттрансляційного гальмування може бути методом буферизації потенційно шумного транскрипційного сигналу і може уникнути накопичення потенційно громіздких проміжних сполук, вбудованих в мембрану ER. Убіквітінація білка та протеасомна деградація є більш екстремальною формою посттрансляційного контролю; деградація, безперечно, є незворотним процесом. Повсюдне поширення RNF20 та подальша протеасомна деградація SREBP 69 (рис. 3, “G”) може представляти собою крайній засіб для обмеження функції SREBP.
Статини, профілактика раку та лікування раку
Окрім своєї ролі в зниженні рівня холестерину, статини пропонують мати інші інгібуючі ефекти на ріст та диференціацію пухлини. 89,90 Наприклад, статини можуть виявляти корисні протипухлинні властивості, змінюючи інгібуючий апоптоз ефект VEGF та обмежуючи секрецію матриксних металопротеїназ. На жаль, не всі спроби визначити вплив статинів на рак дали однозначні позитивні результати. 92 Наприклад, нещодавнє дослідження дійшло до висновку, що тривале (10 років) лікування статинами насправді подвоїло ризик інвазивної протокової карциноми та інвазивної долькової карциноми серед жінок у постменопаузі. 93 Це викликає занепокоєння висновок, враховуючи загальний оптимізм щодо профілактичного введення статину як стратегії профілактики раку.
Орієнтація на мевалонатний шлях статинами може бути лише вершиною айсберга. Складна регуляторна мережа, що оточує функцію SREBP, забезпечує великий інтерфейс для додаткових заходів, спрямованих на боротьбу з раком. У той же час, завдяки циклам зворотного зв'язку та надлишковим відмовостійким елементам управління, можливо, потрібно буде одночасно націлювати різні компоненти мережі. Краще молекулярне розуміння регуляції та дерегуляції SREBP за допомогою супресорів пухлини, таких як LATS1/2 та p53, та онкогенів, таких як YAP/2AZ та mutp53, може, зрештою, розширити можливості терапевтичних маніпуляцій з цими взаємодіями, а також створити основу для краще керованих цільових персоналізованих лікування інгібіторами біосинтезу холестерину.
Розкриття потенційних конфліктів інтересів
Жодного потенційного конфлікту інтересів не розкрито.
- Що їсть Фіона, крихітка Бегемот
- Ці продукти точно знизять ваш холестерин! Стаття Дель Монте Філіппіни
- Що таке бегемот; s Дієтичні тварини
- Що таке холестерин Е
- Що таке холестерин і як розвивається артеріосклероз Книжкова полиця NCBI