Що робить Цибуля види, ефективні проти патогенних мікробів?
Анотація
Вступ
Велика різноманітність хімічних сполук з антимікробною активністю, традиційно відомих як вторинні метаболіти, виробляються вищими рослинами. Виявлено тисячі різноманітних природних продуктів, які часто беруть участь у захисті рослин від шкідників та патогенних мікроорганізмів, включаючи терпеноїди, сапоніни, фенольні та фенілпропаноїдні речовини, птерокарпани, стильбени, алкалоїди, глюкозинолати, тіосульфінати та індоли серед багатьох інших (Dixon 2001). Фітохімічне різноманіття рослинних протимікробних сполук було попередньо розглянуто шляхом вивчення їхньої участі в конститутивній (Wittstock та Gershenzon 2002) та індуцибельній хімічній захисті (Hammerschmidt 1999), механізмах стійкості рослин (Morrisey та Osbourn 1999) та витратах на придатність (Heil 2002). Також було оцінено потенційне використання таких молекул для боротьби з патогенами рослин (Dixon 2001). Рід Цибуля включає велику кількість видів (від 600 до 750) (Stearn 1992; Jiemei and Kamelin 2000), з яких вилучено та ідентифіковано багато протимікробних сполук.
Протимікробна активність екстрактів та олій з часнику (Allium sativum), найбільш вивчений вид, що належить до цього роду, відомий з давніх часів. Перше цитування цієї рослини міститься в Кодексі Еберса (1550 р. До н. Е.), Єгипетському медичному папірусі, який повідомляє кілька терапевтичних формул на основі часнику як корисного засобу для лікування багатьох захворювань, таких як проблеми з серцем, головний біль, укуси та глисти. (Блок 1985). Зубчики часнику знайдені в могилі Тутанхамона та у священному підземному храмі биків Сакари. Єгиптяни вважали, що часник підвищує витривалість, і вони припускали його велику кількість. Сирі рослини регулярно давали астматикам та людям, які страждають на бронхіально-легеневі скарги. Пізніше часник був відомий грекам і римлянам, які використовували його як важливий загоюючий засіб, так само, як він використовується і сьогодні більшістю людей у Середземноморському регіоні (Lanzotti 2005). Крім часнику, інший Цибуля види (наприклад, цибуля, цибуля-шалот, цибуля-порей, цибуля, слон-часник) є багатим джерелом фітонутрієнтів, корисних для лікування або профілактики ряду захворювань, включаючи рак, ішемічну хворобу серця, ожиріння, гіперхолестеринемію, діабет 2 типу, гіпертонію, інфекція катаракти та мікробів (Lanzotti 2006, 2012).
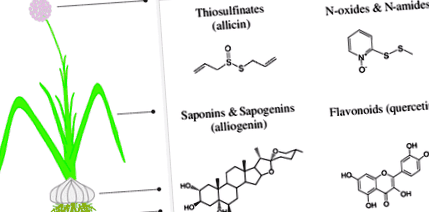
Наукові дослідження цих рослин розпочалися у другій половині XIX століття з роботи Луї Пастера, який у 1858 році вперше відзначив антибактеріальні властивості часнику (Пастер 1858). У 1932 році Альберт Швейцер лікував амебну дизентерію в Африці часником, і до відкриття антибіотиків він також використовувався для ряду епідемічних захворювань (наприклад, тифу, холери, дифтерії та туберкульозу). Недавні дослідження показали, що екстракти та олії часнику ефективні проти ряду сапрофітних, патогенних для людини та рослинних вірусів (наприклад, Вебер та ін., 1992), бактерій (наприклад, Наганава та ін., 1996), грибків (наприклад, Йошида та ін. 1987) та найпростіших (наприклад, Millet et al. 2011). Однак лише в середині минулого століття Кавалліто та Бейлі (1944) визначили найбільш поширену та, серед найбільш потужних, антимікробних сполук з часнику, тіосульфінат аліцин (рис. 1). Подальші дослідження приписували антимікробні властивості часнику алліцин та інші сірчаноорганічні сполуки. Однак новіші дослідження з Цибуля види ідентифікують природні сполуки з антимікробною активністю різних хімічних класів, включаючи сапоніни, флавоноїди, феноли, алкалоїди, а також пептиди та білки (рис. 1).
Схематичне зображення основних хімічних класів природних сполук з Цибуля види з антимікробною активністю. Ці природні сполуки були виділені з різних рослинних тканин (коріння, цибулини, листя та квітів) та насіння
У цій роботі ми розглядаємо хімічну природу та складність антимікробних сполук, виявлених у Цибуля рослини, приділяючи особливу увагу співвідношенню між їх активністю та хімічною структурою.
Аліцин, аджоен та інші сірчаноорганічні сполуки
Алліцин (діалліл тіосульфінат) (1б, Рис. 2) (Кавалліто та Бейлі. 1944) у цибулинах часнику немає. Однак при пошкодженні тканин попередник алліїн (S-алілцистеїнсульфоксид) (1а, Рис. 2), який присутній у цибулинах часнику в концентрації від 5 до 14 мг g -1, негайно перетворюється в аліцин за допомогою ферменту аліінази. На малюнку 2 показано біосинтез аліцину, починаючи з l-цистеїну, який для подальшої реакції з l -глутаміновою кислотою та S-2-пропеніл карбоновою кислотою після декарбоксилювання, окислення та ізомеризації призводить до близького попередника алліїну. Цей останній шляхом ферментативного каталізу аліінази дає відповідний проміжний продукт сульфанової кислоти, автоконденсація якого у водній фазі призводить до утворення аліцину.
Біосинтез аліцину, починаючи з l-цистеїну, який для подальшої реакції з l -глутаміновою кислотою та S-2-пропеніл карбоновою кислотою після декарбоксилювання, окислення та ізомеризації приводить до близького попередника алліїну. Цей останній шляхом ферментативного каталізу аліінази дає відповідний проміжний продукт сульфанової кислоти, автоконденсація якого у водній фазі призводить до утворення аліцину
Сульфоксидні та сульфідні сполуки з Цибуля
Тіосульфатні сполуки з Цибуля
Кінцевий алкільний ланцюг також може бути ненасиченим, таким чином отримуючи 1-пропеніл (названий алліл від Цибуля) або 2-пропенільний залишок. Ця остання група присутня з Z і Е конфігурації і, отже, з'єднання існує у вигляді суміші Z і Е ізомери (напр. 18-19, 20-21 і 22-23, 4) через сигматропну перебудову (Блок 1985). Це також може траплятися для внутрішніх пропенільних ланцюгів, як у випадку з айоеном, сульфоксидом та сульфідним з'єднанням, який був виділений в Е і Z-ізомерів (2 і 3, 3) та його аналога 10-девінілахоєну, також виділеного в обох Е і Z форми (14 і 15).
Аліцин має низьку токсичність щодо культур клітин ссавців з негативними ефектами, які зазвичай спостерігаються при концентраціях вище 60 мкг мл -1 (Ankri and Mirelman 1999). Різна реакція мікробних клітин та клітин ссавців на аліцин, ймовірно, пов’язана з механізмами дії цієї сполуки. Антимікробна активність аліцину була пов’язана з пригніченням сульфгідрил-залежних ферментів (Wills 1956), таких як алкогольдегідрогеназа, тіоредоксинредуктаза та РНК-полімераза. У багатьох випадках додавання цистеїну та глутатіону зменшувало інгібуючу дію аліцину, оскільки ці дві сполуки реагують з дисульфідним зв’язком аліцину, запобігаючи таким чином пошкодженню клітин. Поява глутатіону в клітинах ссавців може пояснити їх обмежену чутливість до аліцину порівняно з мікробними клітинами, які містять дуже малу кількість цієї сполуки (Davis 2005).
Аджоене бере назву від іспанського слова ajo що означає часник. Він утворюється, коли аліцин розчиняється в декількох розчинниках, включаючи їстівні олії (Block et al. 1984). І те, і інше Е- і Z-ajoene виявляв протимікробну активність широкого спектра дії проти грампозитивних та грамнегативних бактерій (Yoshida et al. 1987; Naganawa et al. 1996), грибів (Yoshida et al. 1998; Ledezma et al. 2000) та найпростіших (Perez et al. 1994; Millet et al. 2011; (табл. 1). Крім того, кілька доступних досліджень вказують на те, що аджоен має більш потужну противірусну активність порівняно з аліцином та іншими Цибуля похідні сірчаноорганічних сполук (Weber et al. 1992). Як повідомляється для аліцину, додавання цистеїну значно зменшує інгібуючий ефект аджоєну, ймовірно, в результаті взаємодії між амінокислотою та дисульфідними зв’язками сполуки (Naganawa et al. 1996).
Повідомлялося про антимікробну активність для кількох алілсульфідних сполук (Таблиця 1 та 4-7, 3) і, схоже, пов'язана з кількістю меж дисульфіду, тобто DATTS> DATS> DADS> DAS (Tsao and Yin 2001).
Сапоніни
Сапоніни широко поширені в рослинному світі (Sparg et al. 2004; Vincken et al. 2007), а також у межах роду Цибуля. У цьому огляді ми виявили, що сапоніни були вилучені та ідентифіковані щонайменше з 38 різних Цибуля видів (табл. 2). Більшість доступних досліджень зосереджені на звичайних культивованих видах, таких як часник (A. sativum), цибуля (Allium cepa), цибуля-порей (Цибуля порум), китайська цибуля (Лук чіліенс) і часник цибуля (Цибуля луковична). Однак доступні також дослідження на рідкісних або диких видах (напр. Цибуля цибуля, Allium leucanthum, Allium minutiflorum; Таблиця 2).
Ізольовані сапоніни базуються на спіростанолі, фуростанолі та холестаноловому агліконі (рис. 5) (Lanzotti 2012). Структурно це стерини С27, у яких холестерин зазнав модифікацій, виробляючи спірокеталь. Зокрема, спірокетальна функція походить від бічного ланцюга холестерину за допомогою ряду реакцій оксигенації, що забезпечують гідроксилювання при С-16 і в одному з кінцевих метилів, а потім виробляє кетонову функцію при С-22. Це напівпродукт перетворюється на напівцеллю, нестабільному проміжному продукті, який піддається реакції глікозилювання при С-26, отримуючи таким чином спіростаноловий аглікон або подальшу реакцію, що дає відповідний спірокетал, тобто спіростаноловий аглікон. Це можна також отримати гідролізом фуростанолу аглікону з вивільненням цукрових одиниць (ів) при С-26.
Біосинтез аглікону в Цибуля сапоніни
Аглікон холестерину був знайдений лише в Росії A. porrum і Цибуля лучна, тоді як інші скелети присутні майже на одному рівні (Lanzotti 2012). З літературних даних видно, що скелет спіростанолу типовий для таксонів часнику, тоді як скелет фуростанолу типовий для таксонів цибулі. Малюнок 6 повідомляє про більш поширені сапогеніни (24-28), знайдений у цих рослинах, які складають спіростаноловий аглікон відповідних сапонінів. Гідроксилювання на скелетному ядрі зазвичай зустрічається в положеннях 2, 3, 5 і 6, як показано на рис. 6.
Сапогеніни, ізольовані від Цибуля
Сапоніни від Цибуля вид має багато біологічних властивостей, включаючи спазмолітичну, цитотоксичну, гемолітичну, протизапальну та протипухлинну активність (Sparg et al. 2004). Дивно, але лише деякі дослідження досліджували їх антимікробні властивості.
Приклади сапонінів, виділених з A. minutiflorum, A. sativum var. Voghiera та A. cepa
Дані, отримані в результаті протигрибкових тестів, проведених з аналогічними сапонінами (Barile et al. 2007; Lanzotti et al. 2012a, b), дозволили визначити деякі взаємозв'язки структура-активність, які узагальнені на рис. 8, де фармакофорними елементами цієї активності є виділено. Зокрема, були виявлені позитивні ефекти для гідроксилів у положеннях 3 та 6 та спіростанового аглікону, тоді як негативні ефекти виявлені для фуростанового аглікону, для оксигенації при С-5 та збільшення кількості цукрів при С-3. Однак необхідні подальші дослідження, щоб з’ясувати механізм дії сапонінів та визначити, як ці сполуки детоксикуються патогенними грибами, що призводить до деградації їх хімічної структури із втратою активності.
Ключові фармакофорні елементи протигрибкової активності Цибуля сапоніни
Незважаючи на те, що в Цибуля сірчаноорганічні сполуки видів, сапоніни, феноли, алкалоїди та антимікробні білки зустрічаються разом у тканинах рослин, більшість досліджень стосуються лише протигрибкової активності окремих молекул. Недавнє дослідження повідомило, що протигрибкова активність деяких сапонінів з A. cepa проти рослинного збудника B. cinerea і агент біоконтролю Trichoderma harzianum можуть бути посилені синергічно, якщо вони постачаються в комбінації (Lanzotti et al. 2012b).
Інші органічні сполуки з антимікробною активністю
Хоча антимікробна активність Цибуля видів віднесено до сірчаноорганічних сполук, а нещодавно - до сапонінів, виявлено інші протимікробні сполуки, що належать до різних хімічних класів (рис. 1; табл. 3).
Виявлено декілька білків та пептидів з антимікробною активністю. Наприклад, білок AceAMP1 10 кД від A. cepa інгібували дванадцять видів грибів та два види бактерій (Phillippe et al. 1995). Ванг і Нг (2002, 2004) виявили аскалін та аліципін, два пептиди з протигрибковою активністю від A. ascalonicum і A. cepa, відповідно. Крім того, в коренях і цибулинах часнику, цибулі-порею було виявлено присутність великої кількості двох N-ферулоїламідів, N-ферулойтирозину (32) і N-ферулоїлтираміну (33) (Рис. 9) (Fattorusso et al. 1999). Оскільки настій коріння часнику використовується в традиційній медицині як протигельмінтний засіб, оцінювали можливу антимікробну активність цих двох сполук. Обидві сполуки були активними щодо збудника Fusarium culmorum з ED50 20 та 22 мкг/мл відповідно. Нещодавно О’Доннелл та ін. (2009) виявлено з A. stipitatum три алкалоїди піридин-N-оксиду (34-36, 9) з сильною антибактеріальною активністю на швидко зростаючі види Мікобактерії, метицилін стійкий S. aureus, і різновиди стійких до різних лікарських засобів (MDR) S. aureus.
Ароматичні N-аміди та N-оксиди від Цибуля
Флавоноїди всюди зустрічаються в клітинах фотосинтезу і зазвичай містяться у фруктах та овочах. Загальні флавоноїди, що містяться в часнику та цибулі, представлені на рис. 10 (37-42) з вмістом їх у свіжих цибулинах. Хоча препарати, що містять ці сполуки, століттями використовувались для лікування захворювань людини, лише нещодавно цей клас натуральних продуктів стає предметом досліджень щодо інфекційних хвороб, і багато груп виділили та виявили структури флавоноїдів, що володіють протигрибковою, противірусною та антибактеріальною активністю . Зокрема, кверцетин (41) і кемпферол (39), основні флавоноїди з A. cepa, виявив антибактеріальну активність до Bacillus cereus, E. coli, Listeria monocytogenes, Micrococcus luteus, Pseudomonas aeruginosa та S. aureus (Таблиця 3). Що стосується механізму дії, здається, що активність кверцетину та флавоноїдів з гідроксилюванням B-кільця могла б частково бути віднесена до інгібування ДНК-гірази (Ohemeng et al. 1993), хоча інші механізми не можна виключати.
Флавоноїди в цибулі та часнику та їх вміст
- Секрет ефективного схуднення цього зимового життя в Південній Африці
- 25 найкращих таблеток Be Slim, найбільш ефективних без рецептів, дієтичні таблетки, інтегральна мануальна терапія та
- Ходьба на біговій доріжці для ефективної втрати жиру Живіть здорово
- Дикий часник (Allium Ursinium) - кулінарний захват
- Жінка заробляє важкі гроші, втрачаючи вагу - ця жінка; s Історія - серйозна мотивація схуднення