SENP1-Sirt3 Сигналізація Контроль ацетилювання та метаболізму білка мітохондрій - ScienceDirect
Sirt3 SUMOylation пригнічує його каталітичну активність у мітохондріях
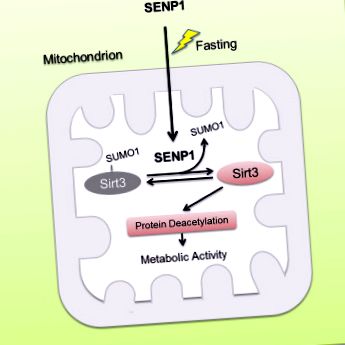
Голодування призводить до транслокації SENP1 в мітохондрії до де-SUMOylate Sirt3
Вісь SENP1-Sirt3 сприяє окисленню жирних кислот та виробленню енергії
Мутація Sirt3 SUMOylation антагонізує ожиріння, спричинене ВЧР, за рахунок витрат енергії
Резюме
Sirt3, як основна дезацетилаза, що залежить від мітохондрій нікотинамід-аденин-динуклеотиду (NAD), необхідна для метаболічної адаптації мітохондрій до різних стресів. Однак, як регулювати активність Sirt3 у відповідь на метаболічний стрес, залишається в основному невідомим. Тут ми повідомляємо про Sirt3 як просумований білок у мітохондріях. SUMOylation пригнічує каталітичну активність Sirt3. Sirt3 із дефіцитом SUMOylation показує підвищене деацетилювання білків мітохондрій та посилене окислення жирних кислот. Під час голодування в мітохондріях накопичується SUMO-специфічна протеаза SENP1, яка швидко де-SUMOylates та активує Sirt3. Дефіцит SENP1 призводить до гіпер-SUMOylation Sirt3 та гіпер-ацетилювання мітохондріальних білків, що зменшує метаболічну адаптацію мітохондрій, реагуючи на голодування. Крім того, ми виявили, що голодування індукує транслокацію SENP1 в мітохондрії, щоб активувати Sirt3. Дослідження на мишах показують, що мутація Sirt3 SUMOylation зменшує жирову масу та протидіє ожирінню, спричиненому високим вмістом жиру (HFD), шляхом збільшення окисного фосфорилювання та енергетичних витрат. Наші результати показують, що сигналізація SENP1-Sirt3 модулює активацію Sirt3 та метаболізм мітохондрій під час метаболічного стресу.
Графічний реферат
- Завантажити: Завантажити зображення високої роздільної здатності (104 КБ)
- Завантажити: Завантажте повнорозмірне зображення
Попередній стаття у випуску Далі стаття у випуску
- Ентеропатія, що втрачає білок - огляд тем ScienceDirect
- Роль мітохондріального комплексу IV у віковому ожирінні - ScienceDirect
- Протеїнкіназа С-бета Виникаючий зв’язок між надлишком поживних речовин та ожирінням - ScienceDirect
- Накачування білка це спрацьовує на фізичні вправи та здоров’я
- Арахісове тісто Нуга Всі натуральні білки VLC Proti-Thin; Нашуа Харчування