Розвантажувальна терапія для пацієнтів з COVID-19
FDA видала дозвіл на екстрене використання (EUA) для серцевих насосів Impella® для забезпечення розвантаження лівого шлуночка та підтримки пацієнтів з COVID-19, які проходять лікування ECMO та розвивають набряк легенів або міокардит.
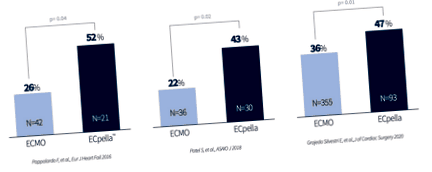
Розвантаження імпелли у пацієнтів, які отримували ЕКМО під час кардіогенного шоку, пов’язане з поліпшенням виживання в декількох опублікованих багатоцентрових звітах
Щоб дізнатись більше про EUA, відвідайте наш прес-реліз
Дозвіл на екстрене використання
Системи підтримки лівого шлуночка (LV) Impella (Impella 2.5, Impella CP, Impella CP з SmartAssist, Impella 5.0 та Impella 5.5 з SmartAssist) мають дозвіл на екстрене використання лікарями в лікарні для надання тимчасових (≤ 4 днів для Impella 2.5, Impella CP та Impella CP з SmartAssist; і ≤ 14 днів для Impella 5.0 та Impella 5.5 з SmartAssist) розвантаження ЛШ та підтримка лікування критичних пацієнтів (тобто пацієнтів у відділенні інтенсивної терапії) із підтвердженою інфекцією COVID-19, які переживають Лікування ECMO та розвиток набряку легенів під час лікування VA ECMO або пізньої серцевої декомпенсації від міокардиту під час підтримки VV ECMO. Системи підтримки Impella LV ні були очищені, ні затверджені для дозволеного показання до використання. Системи підтримки Impella LV отримали дозвіл на вищезазначене надзвичайне використання FDA згідно з EUA. Системи підтримки Impella LV отримали дозвіл лише на час декларації про існування обставин, що виправдовують дозвіл на екстрене використання медичних виробів відповідно до розділу 564 (b) (1) Закону, 21 США. § 360bbb-3 (b) (1), якщо тільки дозвіл не буде припинено або скасовано раніше.
Усі серцево-судинні процедури мають ризик. До потенційних побічних явищ, пов’язаних із застосуванням Імпелли, належать: гостра ниркова дисфункція, пошкодження аортального клапана, кровотеча, кардіогенний шок, інсульт, гемоліз, ішемія кінцівок, інфаркт міокарда, ниркова недостатність, тромбоцитопенія, травми судин та смерть.
- Тромботичні ускладнення пов’язані з терапією флеботомією у пацієнтів з чувашем
- Розвантаження лівого шлуночка перед реперфузією у пацієнтів із передньою елевацією сегмента ST
- Подорожі з трубними каналами Національний фонд розладів ковтання - Спільнота для тих, хто живе
- Хірургія схуднення для пацієнтів з низьким ІМТ (ІМТ 30-35)
- Розвантаження вантажівки Довідка вантажників, щоб розвантажити вантажівку або контейнер