Розширення меж терапії раку: гра поживних речовин
Анотація
Огляд контролю за прогресуванням пухлини за допомогою дієтичних втручань
Безліч епідеміологічних та експериментальних даних продемонстрували ефективність геропротекторних дієтичних режимів (наприклад, натщесерце, калорійність, білки або окремі амінокислотні обмеження) у профілактиці раку (1–3). Крім того, такі дієтичні схеми виявляються ефективними при селективному знищенні ракових клітин, тоді як підвищення стійкості нормальних клітин до токсичного впливу протипухлинних препаратів.
Відомо, що обмеження калорій (CR), яке визначається як 30–60% менше добової потреби в калоріях без недоїдання, подовжує здоровий період життя від дріжджів до ссавців (4). Протипухлинні ефекти КР відомі вже кілька років (5). CR особливо ефективний у зменшенні частоти, маси та метастазів клітин раку молочної залози (6, 7). Примітно, що застосування КР у поєднанні з променевою терапією посилювало ефективність променевої терапії, індукуючи більш виражений апоптоз клітин раку молочної залози, ніж лише радіотерапія (7). Однак у людини CR вимагає високих вимог дотримання, щоб підтримувати їх протягом адекватного терапевтичного періоду. З цих причин короткий період голодування без недоїдання був запропонований як потенційно безпечне втручання, пов'язане з лікуванням раку (8).
Модуляція поживних речовин у проліферуючих/еластичних ракових клітинах: молекулярний погляд
Зниження рівня поживних речовин та факторів росту, що спостерігаються під час голодування, призвело до висунення гіпотези про їх обов’язкову роль у регулюванні диференціальних реакцій стресу в нормальних та ракових клітинах (10, 14, 16, 18). Різні реакції нормальних та ракових клітин на голодування проливають світло на їх різну чутливість до поживних речовин та факторів росту (18).
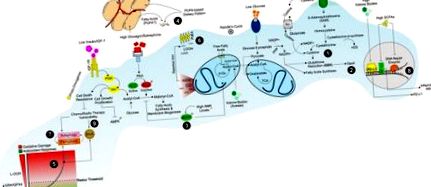
Сигналізація IGF-1/IGF-1R сильно залежить від наявності поживних речовин і передбачає інтенсифікацію проліферації ракових клітин через прямий вплив на сигналізацію PI3K/Akt та стійкість до загибелі клітин, накладену хіміотерапевтиками та променевою терапією (Рисунок (Рисунок 1) 1) (32). Дійсно, голодування знижує рівень циркулюючого IGF-1, і ця подія захищає мишей, у яких недостатня продукція IGF-1 у печінці, від хіміотерапевтичних препаратів (16). Відповідно, відновлення IGF-1 було достатнім, щоб зменшити захисний ефект голодування (16). Відновлення IGF-1 захищає первинну глію, але не клітини гліоми, від циклофосфаміду та ембріональних фібробластів миші від доксорубіцину (16). Навпаки, добавки IGF-1 у голодних клітинах раку молочної залози скасували сенсибілізацію препарату. Загалом, ці висновки чітко вказують на те, що сенсибілізація ракових клітин до хіміотерапевтичних препаратів, що опосередковується натще, забезпечується зниженням рівня IGF-1 (15).
Дієтична стратегія сприяння ворожому метаболізму в проліферуючих/еластичних ракових клітинах. Дієтичні режими з низьким вмістом білків, крохмалю та цукрів сприяють навколишньому середовищу, бідному амінокислотами сірки (тобто метіоніном, цистеїном), глюкозою та факторами росту (інсулін/IGF-1), що може обмежити вироблення NADPH/GSH (1) та GPX4 діяльність (2). Знижений рівень співвідношення глюкози та глюкагону/інсуліну вимикає синтез ліпідів та вмикає шляхи окислення ліпідів під дією AMPK в проліферуючих ракових клітинах (3). За таких метаболічних умов ракові клітини нарощують свої мембрани, використовуючи позаклітинні харчові та/або виділені з білої жирової тканини жирні кислоти (4). Супутня активація метаболізму OxPHOS та зниження рівня GSH є причиною окисного стресу (5), що завершується масовим перекисним окисленням ліпідів (LOOH) (6) та ферроптозом у ракових клітинах (7). Дієта з низьким вмістом крохмалю, цукру та білків, але багата жирними кислотами, також збільшує кетонові тіла та модулює особливості мікробіоти кишечника, виробляючи коротколанцюгові жирні кислоти (SCFA). Кетонові тіла та SCFAs впливають на PD-L1, ядерний фактор-kb та транскрипцію генів ферментів, що відновлюють ДНК (8), сприяючи хімічній/радіотерапії вразливості ракових клітин (9).
Механізми, за допомогою яких КД діють як ад'юванти в терапії раку, також пов'язані зі збільшенням окисного стресу в ракових клітинах (24). Дійсно, при КД високий рівень циркулюючих жирних кислот обмежує доступність глюкози для гліколізу (цикл Рендла) (38). Це зменшує утворення пірувату та глюкозо-6-фосфату і, в свою чергу, синтез NADPH через пентозофосфатний шлях (PPP) (39). NADPH необхідний для буферизації виробництва гідропероксидів (LOOH) за допомогою NADPH-залежної системи глутатіон/глутатіонпероксидази (GSH/GPX) (40, 41). Як наслідок, збільшення LOOH, ймовірно, викликає (24) (рис. (Рис. 1). 1). Відповідно, у хворих на цукровий діабет з гіперкетозом спостерігається більш високий рівень перекисного окислення ліпідів у мембрані еритроцитів і значне зниження рівня GSH у клітинах, ніж у звичайних хворих на кетонічний діабет (42). Лікування кетоновим тілом ацетоацетатом підвищувало рівень перекисного окислення ліпідів в ендотеліальних клітинах людини, інгібуючи їх проліферацію (42). Ці дані свідчать про пряму роль кетонових тіл у безпосередньому впливі на рівень GSH.
Прихильність опосередкованого поживними речовинами ферроптозу в ракових клітинах
Зберігаючи рівні NADPH, ракові клітини підтримують активність GPX/GSH під час обмеження поживних речовин, і це може надати стійкість до окисно-відновних хіміотерапевтичних засобів (61–63). Дійсно, багато клітин ракових бунтів використовують загальний трюк, щоб уникнути анігіляції; вони вступають у так званий мезенхімальний стан, що є переходом «епітеліального в мезенхімальний», що забезпечує стійкість ракових клітин до звичайних терапевтичних схем (64). Було продемонстровано, що стійкі до терапії мезенхімальні ракові клітини суворо покладаються на селензалежний GPX4 для виживання (65). Використовуючи відновлювальну потужність GSH, GPX4 перетворює потенційно токсичний L-OOH у нетоксичні ліпідні спирти (L-OH) (рис. (Рис. 1) 1) (66–68). Відповідно, інактивація GPX4 через виснаження GSH ерастином або прямим інгібітором GPX4 в кінцевому підсумку призводить до перекисного окислення ліпідів у ракових клітинах (69). Таким чином, провокаційною є гіпотеза, що еволюційний тиск на підтримку білка селену GPX4 може корелювати із потребою організму у підвищеному вмісті ПНЖК, що, в свою чергу, робить можливим складну біологічну діяльність (70).
Дієтичні стратегії для посилення імунометаболічних реакцій при терапії раку
Короткочасне голодування благотворно впливає на імунологічний нагляд за раком (100). Зокрема, П'єтрокола та його колеги продемонстрували, що ліки, що імітують голодування або CR, спричиняють виснаження регуляторних Т-клітин (які пригнічують протипухлинний імунітет), запалюючи таким чином аутофагічний потік у мишачих моделей раку легенів, викликаного KRAS. Відповідно, інгібуючий ефект голодування на ріст пухлини втрачається при ракових захворюваннях, які спричинили дефіцит аутофагії (100). Нещодавно також було продемонстровано, що ізокалорійна дієта з обмеженням білка індукує IRE1α-залежний УПО в ракових клітинах, посилюючи цитотоксичну CD8 + Т-клітину (тип ефекторних Т-лімфоцитів), опосередковану відповідь проти пухлин (101).
Подібно до того, що спостерігається при тривалому голодуванні (102), цикли дієти, що імітує голодування (Ящур), ефективні для збільшення проліферації гемопоетичних клітин та сприяння регенерації та модуляції імунної системи (103). Важливо, що ящур має стимулюючий ефект на загальні лімфоїдні клітини-попередники та CD8 + Т-клітинну залежну цитотоксичність на клітини раку молочної залози та меланоми (рис. (Рис. 2) 2) (17, 102). Наявність цитотоксичних CD8 + Т-клітин у пухлинному середовищі [інфільтруючі пухлину лімфоцити (TIL)] вважається позитивним результатом лікування раку (104, 105).
Маніпуляція з поживними речовинами для посилення імунометаболічного фенотипу CD8 + лімфоцитів, інфільтруючих пухлину (TIL). Наївні CD8 + Т-клітини розпізнають антиген ферроптотичних ракових клітин класу I MHC на дендритних клітинах, стаючи таким чином зрілими цитотоксичними CD8 + Т-клітинами (1). Після тривалого голодування або дієти, що імітує голодування (Ящур), може відбутися посилення швидкості регенерації кровотворення (2) та збагачення загальних лімфоїдних клітин-попередників (CLP) (3). Імунотерапія прийомними Т-клітинами in vitro (ACI) (4) та зміни поживних речовин in vivo (5) скидають метаболізм CD8 + TIL до окисних шляхів мітохондрій, тим самим обмежуючи конкуренцію субстрату з раковими клітинами та посилюючи опосередкований CD8 + TIL імунологічний нагляд. Дієтичні стратегії, що сприяють функціональним змінам мікробіоти кишечника (наприклад, збагачення Akkermansia muciniphila) (6), можуть покращити ефективність імунних контрольних точок (анти PD1/PD-L1) (7).
На CD8 + Т-клітини впливають поживні речовини та інші допоміжні сигнали, які зазвичай доступні в їх середовищі. Як правило, пухлинні клітини інактивують CD8 + Т-клітини. Придушення окисного фосфорилювання та регульований гліколітичний потік проліферуючих ракових клітин створюють імунодепресивне мікросередовище (106). Дійсно, глюкозозалежний CD8 + ТІЛ може зазнати конкурентних недоліків для поживних речовин, і це негативно вплине на їх імунну функцію. Імунодепресивне метаболічне середовище може бути додатково посилено експресією пухлини інгібуючими лігандами для запрограмованого рецептора смерті 1 (PD-1), який, зв’язаний із своїми спорідненими рецепторами на Т-клітинах, обмежує поглинання та гликоліз власних глюкози Т-клітин (107, 108) . Повідомлялося, що KD значно зменшує експресію інгібуючого ліганду PD-1 (PD-L1) на CD8 + TIL (109). Крім того, миші, які харчуються KD, мають знижену експресію PD-L1 на ракових клітинах, що, як відомо, пригнічує активність CD8 + Т-клітин (109). Це свідчить про те, що KD може змінити опосередковану пухлиною супресію Т-клітин шляхом зменшення кількості клітин, сприйнятливих до інгібування через інгібіторний шлях PD-1 (рис. (Рис. 2, 2).
В даний час з’ясовується, що відповідь CD8 + TIL на інгібітор блокади імунної контрольної точки PD1 також може модулюватися мікробіотою кишечника (118–120). Зовсім недавня стаття показала, що мікробіота калу у пацієнтів, які постраждали від метастатичної меланоми та реагують на терапію анти-PD1, демонструє збільшення кількості Аккермансії муцініфіла. Введення A. muciniphila мишам, які отримували невідповідну трансплантацію мікробіоти фекалій людини, покращило протипухлинну імунну інфільтрацію CD8 + Т-клітин та підвищило ефективність терапії проти PD1 (120, 121). Іншим інтригуючим спостереженням є те, що Faecalibacterium і Bifidobacterium асоціюються з протизапальними реакціями, регуляторною ланкою імунної системи, яка спрямована на запобігання надмірній активації імунної відповіді та відновлює гомеостаз господаря (120). Враховуючи, що зміни в метаболізмі хазяїна та мікробіоти можуть відбуватися в тандемі, було висунуто гіпотезу про те, що різноманітність та склад кишечника є предикторами відповіді на терапію раку (121) (рис. (Рис. 2). 2). Відповідно, безмікробні миші, імплантовані пухлинними клітинами людини і трансплантовані з фекаліями хворих на хіміотерапію, продемонстрували покращену реакцію на хіміотерапію, ніж миші, колонізовані мікробіотою від пацієнтів, які не відповідали (119).
Висновок та перспектива
Незважаючи на нещодавні досягнення в терапії раку, прогноз для багатьох онкологічних хворих залишається поганим, і нинішні методи лікування все ще демонструють серйозні побічні ефекти. Таким чином, терміново потрібно знайти додаткові методи лікування, які мають обмежену токсичність для пацієнта та одночасно посилюють реакції терапії на рак проти нормальних клітин. Дієта має потужну здатність модулювати реакції клітин на подразники навколишнього середовища і демонструє великий потенціал для поліпшення прогнозу раку. Механізми, за допомогою яких харчові поживні речовини посилюють протипухлинну дію стандартних протипухлинних методів лікування (хіміотерапія, променева терапія, імунотерапія), досі не з’ясовані. Доклінічні дослідження продемонстрували безпеку та ефективність конкретних дієтичних втручань для протидії прогресуванню пухлини під час протипухлинної терапії на мишачих моделях. Однак більшість даних, представлених у літературі, використовують переваги використання мишей, і це може обмежити переклад клінічними дослідженнями. Тому зараз необхідна величезна робота для підтвердження цих дуже перспективних результатів у людини.
Позбавлення поживних речовин (наприклад, глюкози, амінокислот сірки), а також факторів росту, що реагують на поживні речовини (наприклад, IGF-1), здається, вибірково вбиває високопроліферативні/еластичні ракові клітини, примушуючи їх гліколітичний актив до окисного метаболізму (тобто, жирні кислоти та кетонові тіла як джерела енергії) та обмеження активності GPX як наслідок зниження рівня GSH. Дефіцит поживних речовин також покращує імунометаболізм, посилюючи цитотоксичну ефективність CD8 + TIL в межах маси пухлини завдяки, ймовірно, супутній мікробіоти кишечника та імунометаболічним перебудовам (рис. (3)).
Поліпшення метаболітів та імунологічного протипухлинного профілю за допомогою k-PBD. Докази тривалого голодування, дієти, що імітує голодування (ящур) та кетогенної дієти продемонстрували сильну корисність в якості ад'ювантів у терапії раку (1). У цьому номері ми пропонуємо помірну кетогенну дієту на рослинній основі (k-PBD), з низьким вмістом вуглеводів (зокрема, крохмалю та цукрів) та тваринних білків (бідних амінокислотами сірки та селену), але багатих жирами [переважно рослинними поліненасиченими жирні кислоти (ПНЖК)] (2), які можуть сильно модулювати циркулюючі метаболіти (3), імунологічні фактори (4) та активність мікробіоти кишечника (5), що в цілому створює вороже середовище для ракових клітин.
Гіпотетичні фенотипові відповіді раку на k-PBD. Для досліджень дієтичного втручання людини k-PBD (протягом 4 днів поспіль; 5 порцій щодня) повинен забезпечувати близько 1100 ккал/кубик з 5% калорій з рослинних білків, 25% з вуглеводів (некрохмалисті овочі) і 70 % від необроблених рослинних олій (1). k-PBD, запропонований для моделей мишачого раку, повинен бути зменшений у загальній кількості калорій (зниження на 40% порівняно з дієтою ad libitum), забезпечувати 7% калорій з рослинних білків, 45% з вуглеводів з низьким вмістом крохмалю, 48% у рослинних оліях (2). Запропонований режим харчування слід починати до традиційних методів лікування раку (3).
Внески автора
DL-B осмислив і написав рукопис. К.А. здійснив критичний перегляд рукопису для інтелектуального змісту.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Ожиріння значно посилює побічні ефекти стереотаксичної променевої терапії тіла при раку легенів
- Потенційні програми для лігандів сигма-рецепторів у діагностиці та терапії раку - ScienceDirect
- Первинна аменорея через синдром полікістозних яєчників (СПКЯ) - радник з терапії раку
- Побічні ефекти прийому замісної терапії ферментом підшлункової залози при раку підшлункової залози - Підшлункова залоза
- Отит середнього вуха - радник з терапії раку