Роль сурфактанту в хворобі легенів та захисті господаря від легеневих інфекцій
SeungHye Han
1 Медичний факультет, Центр передового лікування гострих травм легенів та
Рама К. Маллампаллі
1 Медичний факультет, Центр передового лікування гострих травм легенів та
2 Кафедра клітинної біології та фізіології Пітсбургського університету, Пітсбург, Пенсільванія; і
3 Спеціальна медична служба, Ветерани у Пітсбурзі, система охорони здоров’я, Пітсбург, штат Пенсільванія
Анотація
Встановлено, що легенева поверхнево-активна речовина зменшує поверхневий натяг на межі повітря-вода в альвеолах, тим самим запобігаючи руйнуванню цих структур в кінці закінчення. Таким чином, ПАР зменшує роботу, пов’язану з диханням. Хоча поверхнево-активна речовина та її поверхнево-активні властивості були виявлені порівняно на початку 20-х років (1), її компоненти та механізм дії почали з'ясовувати лише в 50-х роках минулого століття Патле (2) та Клементс (3). Прорив Ейвері та Саїда допоміг визначити фундаментальне відкриття, яке пов'язує дефіцит легеневого сурфактанту з немовлятами, які померли від синдрому дихального дистрессу (РДС) (4). Дійсно, ці критичні результати допомогли забезпечити замісну терапію сурфактантом як підхід, який революціонізував лікування РДС. Однак протягом 1990-х років дослідники виявили кілька додаткових важливих біологічних властивостей цього поверхнево-активного матеріалу в області імунітету хазяїна проти мікробної інфекції та імуномодулюючої активності.
Склад і функція поверхнево-активної речовини
Склад
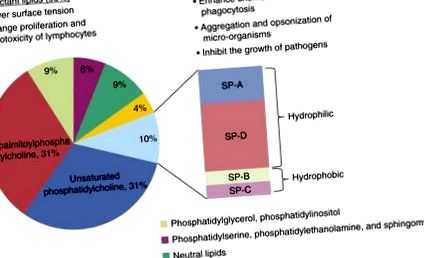
Легенева поверхнево-активна речовина складається переважно з фосфоліпідів та ключових білків (5). Ліпіди складають від 80 до 90% його молекулярної маси, серед яких найбільш поширеними є фосфатидилхолін, фосфатидилгліцерин та фосфатидилінозитол (рис. 1); зокрема, фосфатидилхолін становить приблизно 70% ліпідної частини ПАР, і він існує як відносно унікальна форма, відома як дипальмітоїлфосфатидилхолін (DPPC). Разом з білками ПАР DPPC забезпечує поверхневу активність ПАР (6–8). Решта типів ліпідів, включаючи фосфатидилсерин, фосфатидилетаноламін та сфінгомієлін, здається, присутні у відносно невеликих кількостях. Цей ліпідний склад добре зберігається серед хребетних (7).
Склад і функції ПАР. Поверхнево-активна речовина складається з 90% ліпідів і 10% білка. Вміст ліпідів містить переважно фосфоліпіди, зокрема дипальмітоїлфосфатидилхолін, який відповідає за біофізичну функцію ПАР. Великі гідрофільні білки, поверхнево-активні білки (SP) -A та SP-D, відіграють важливу роль у захисті господаря та імунній модуляції, тоді як SP-B та SP-C беруть участь головним чином у модулюванні біофізичних властивостей.
Поверхнево-активна речовина містить чотири асоційовані білки, білок поверхнево-активної речовини (SP) -A, SP-B, SP-C та SP-D. Два з цих білків, SP-A та SP-D, є гідрофільними, а інші - гідрофобними (9). SP-A та SP-D є членами сімейства вроджених імунних білків, які називаються колектинами (10, 11). Ці білки мають спільну NH2-кінцеву область, подібну до колагену, та С-кінцевий домен лектину, який пов'язує вуглеводи залежно від кальцію. Місця зв'язування цих доменів лектину знаходяться на бактеріальних та вірусних поверхнях (12), і це частково відповідає за роль, яку колекеїни відіграють у вродженому та адаптивному імунітеті.
Білки гідрофобних ПАР, SP-B та SP-C, зберігаються та секретуються разом з фосфоліпідами ПАР (13, 14). SP-B - незамінний білок, який відіграє роль у підвищенні поверхнево-натяжних властивостей поверхнево-активної речовини (14), а також має певну антимікробну активність (15–17). Роль SP-C, одного з найбільш відомих гідрофобних пептидів, невизначена, але його високий ступінь збереження серед видів свідчить про інтегральну функцію (17).
Компоненти ПАР синтезуються в основному клітиною альвеолярного типу II, яка продукує ліпіди ПАР та білки ПАР (5, 18), та клітиною клубових дихальних шляхів, яка синтезує білки ПАР SP-A, SP-B та SP-D (19– 21) (Малюнок 2).
Життєвий цикл ПАР - синтез, секреція та переробка. Клітини альвеолярного типу II, які покривають близько 7% поверхні альвеолярного епітелію, в основному відповідають за виробництво сурфактанту за допомогою харчових субстратів (1). Поверхнево-активна речовина синтезується в ендоплазматичному ретикулумі (ER) (2) клітин альвеолярного типу II і транспортується до Гольджі (3) для подальшої модифікації. Більшість компонентів ПАР зберігаються в пластинчастих тілах (4) доти, поки вони не виділяться в рідку гіпофазу на альвеолах шляхом екзоцитозу (5). Поверхнево-активна речовина утворює решітчасту структуру, що називається трубчастим мієліном (6), яка транспортується до межі розділу повітря - рідина, утворюючи моношар плівки ПАР (7). Фосфоліпіди або внутрішні, і деградуються макрофагами (8), або повертаються назад до клітин типу II для повторного використання (8 ′). Зверніть увагу, що поверхнево-активний білок (SP) -A, SP-B та SP-D також синтезується в клубових клітинах в термінальних бронхіолах.
Функція
Основні функції ПАР полягають у наступному: (1) зниження поверхневого натягу на межі повітря-рідина і, таким чином, запобігання альвеолярному колапсу в кінці, (2) взаємодія та подальше вбивство патогенів або запобігання їх розповсюдженню, і (3) модулюючі імунні відповіді.
Різка зміна площі поверхні альвеол протягом дихального циклу диктує, що поверхневий натяг альвеол повинен бути менше 2 мН/м на кінці видиху, щоб запобігти альвеолярному колапсу (22). Ця критична функція поверхнево-активної речовини досягається завдяки підтримці плівки, сильно збагаченої DPPC, яка виробляє надзвичайно низький поверхневий натяг (табл. 1. Раніше вважалося, що компоненти поверхнево-активної речовини існують лише в легенях. Дослідження моделей тварин та досліджень людини показали, однак, що білки ПАР просочуються в судинний простір при пошкодженні альвеолокапілярних мембран (43–46). Важливо, що рівень білка ПАР, що циркулює, може мати клінічну корисність. результати вірусних інфекцій H1N1 (47), а інший показав, що рівні SP-A та SP-D підвищені у пацієнтів із легеневим фіброзом порівняно зі здоровими добровольцями (48).
Таблиця 1.
Рівні SP-A та SP-D від бронхоальвеолярного промивання при легеневій хворобі
| RDS у новонароджених | ↓ | Не застосовується | ↓ | 140–143 |
| PAP | ↑ | ↑ | ↑ | 144–146 |
| ГРДС | ↓ | Не застосовується | ↓ | 40, 147 |
| IPF | ↓ | = | ↓ | 145, 148–150 |
| Саркоїдоз | ↑ | = | = | 145, 149, 151, 152 |
| Бактеріальна пневмонія | ↓ | Не застосовується | ↓ | 153, 154 |
| Курці | ↓ | ↓ | = | 155, 156 |
| Астма | ↓ | Не застосовується | = | 157 |
Визначення скорочень: ARDS = гострий респіраторний дистрес-синдром; IPF = ідіопатичний фіброз легенів; Не застосовується = недоступний; PAP = легеневий альвеолярний протеїноз; RDS = респіраторний дистрес-синдром.
↓ вказує на зменшення; ↑ означає збільшення; = вказує без змін.
Відомо, що генетичні поліморфізми білків ПАР пов'язані з більшою поширеністю ідіопатичного легеневого фіброзу (49, 50), але також зменшенням поширеності інтерстиціальних захворювань легенів при системному склерозі (51). Крім того, кілька досліджень також описують зв'язок між генетичними поліморфізмами для білків ПАР та висотним набряком легенів (52), ARDS (53), карциномою легенів (54) та бронхолегеневою дисплазією (55). Рідкісна помилкова мутація в SFTPA2, ген, що кодує SP-A2, пов'язана з розвитком сімейного ідіопатичного легеневого фіброзу та раку легенів (56).
З іншого боку, було показано, що численні респіраторні інфекції модифікують склад ПАР. Наприклад, P. aeruginosa пригнічує біосинтез сурфактанту (57, 58), знижує захист та біофізичну функцію господаря (59) та виділяє еластазу для розкладання білків ПАР А та D (60, 61). Крім того, LPS, основний компонент клітинної стінки грамнегативних бактерій, пригнічує синтез і секрецію фосфоліпідів (57, 58). Інгібування сурфактанту бактеріями, здається, пов'язане з цитокінами клітини-хазяїна, такими як фактор некрозу пухлини-α, що призводить до деградації біосинтетичних ферментів сурфактанту. Аденовірус людини порушує торгівлю сурфактантом фосфатидилхоліном (62), тоді як A. fumigatus знижує регуляцію експресії білка SP-B і SP-C та мРНК у мишей (63). Інфіковані респіраторно-синцитіальним вірусом (RSV) клітини бронхів епітелію знизили рівень білка SP-A за рахунок зниження ефективності трансляції мРНК (64).
Антимікробна функція
Бактерії
Гідрофільні білки SP-A та SP-D відіграють важливу роль у захисті хазяїна, пригнічуючи ріст бактерій, полегшуючи поглинання бактерій клітинами хазяїна та агрегуючи та опсонізуючи патогени (65). Ці поверхнево-активні білки можуть зв’язуватися як з грамнегативними, так і з грампозитивними бактеріями. SP-A та/або SP-B взаємодіють з ЛПС, отриманими з K. pneumoniae (30, 66), E. coli (30, 67), P. aeruginosa (68–70) та Legionella pneumophila (71), які, отже, призводять до аглютинації, посилення поглинання патогенів та гальмування росту. Ці поверхнево-активні білки також зв'язуються з пептидогліканом, компонентом клітинної стінки грампозитивних бактерій, отриманих із золотистого стафілокока (72) та Streptococcus pneumoniae (26, 27), а також з Mycobacterium avium, Mycobacterium tuberculosis та Mycoplasma pneumoniae для посилення засвоєння фагоцитами та пригнічують їх ріст (73–78).
Гриби
І SP-A, і SP-D здатні зв'язуватися з різними грибами, переважно умовно-патогенними мікроорганізмами, для полегшення аглютинації та фагоцитозу клітинами-господарями. Дослідження на тваринах демонструють, що легеневі колектини (SP-A та SP-D) підвищують проникність клітинної мембрани H. capsulatum, пригнічуючи її ріст безпосередньо (31). Вони також зв'язуються з A. fumigatus (79), Blastomyces dermatitidis (80), Coccidioides posadasii (81), Cryptococcus neoformans (82, 83) та Pneumocystis jiroveci (carinii) (84, 85), що призводить до аглютинації та посиленого поглинання. . Цікаво, що цей ефект виявляється специфічним для мікробів, оскільки зв’язування легеневих колектинів з Candida albicans інгібує фагоцитоз альвеолярними макрофагами, одночасно пригнічуючи ріст грибів (86, 87).
Вірус
Легеневі колектини (SP-A та SP-D) зв'язуються з вірусами, щоб полегшити видалення патогенів. Віруси унікальні в порівнянні з багатьма мікроорганізмами тим, що для розмноження їм потрібен вхід у клітини господаря. Оскільки SP-A і SP-D присутні в шарі слизу та альвеолярній поверхні, вони добре розташовані для запобігання інфікуванню епітеліальних клітин шляхом вірусної нейтралізації, аглютинації та посиленого фагоцитозу. SP-A та/або SP-D зв’язуються з гемаглютиніном та нейрамінідазою вірусу грипу А, щоб пригнічувати їх активність (88–90). Цікаво, що гемаглютинін пандемічних вірусів грипу має низьку активність зв'язування з поверхнево-активним білком D порівняно з сезонним штамом грипу (91). Легеневі колектини також зв'язуються з глікопротеїнами вірусів, включаючи ВІЛ (92, 93), RSV (94) та важкий гострий респіраторний синдром коронавірусу (95). Недавні дослідження показують, що на додаток до легеневих колецинів, ліпідні компоненти ПАР також інгібують RSV-інфекцію (96).
Терапевтичне застосування та наслідки
Екзогенне ПАР також досліджували при різних захворюваннях легенів, таких як астма та пневмонія (116). Хоча пілотне дослідження аерозольованого природного сурфактанту показало покращення функції легенів під час загострення гострої астми (117), воно не показало клінічної користі у пацієнтів зі стабільною астмою (118). Один з випадків демонстрував поліпшення оксигенації при внутрішньобронхіальному закапуванні сурфактанту у дорослого пацієнта з грамнегативною крупозною пневмонією (119). Інші повідомлення про випадки демонструють подібне покращення рівня кисню у ВІЛ-інфікованих немовлят із пневмонією P. carinii (120, 121) або RSV-пневмонією (122). Один РКД двотижневого курсу лікування аерозольованим синтетичним сурфактантом показав поліпшення легеневої функції у дорослих пацієнтів зі стабільним хронічним бронхітом (123). Ці спостереження повинні бути підтверджені великими добре контрольованими дослідженнями на хворих на респіраторні захворювання.
Одним з можливих терапевтичних наслідків замісної терапії ПАР є імуносупресія. Дослідження на тваринах та обмежені дані на людях показують, що екзогенне ПАР зменшує вивільнення цитокінів (124), синтез ДНК медіаторів запалення (125, 126), проліферацію лімфоцитів (127), вироблення імуноглобуліну (128) та експресію молекул адгезії (129). Внутрішньотрахеальне введення суміші сурфактант – амікацин щурам із псевдомонадною пневмонією показало покращені протизапальні ефекти порівняно з окремим амікацином (130). Ці спостереження свідчать про можливість використання сурфактанту для модуляції імунної відповіді під час запальних захворювань легенів, проте необхідні подальші дослідження.
Поза терапією екзогенними сурфактантами також є дані, що певні фармакологічні засоби можуть підвищувати рівень ендогенних сурфактантів, хоча поточні дані обмежені. Кортикостероїди широко застосовуються у жінок, яким загрожує передчасне народження дитини, оскільки вони знижують захворюваність та смертність новонароджених від РДС. Антенатальні стероїди прискорюють розвиток пневмоцитів типу 2 і, таким чином, збільшують продукцію білків ПАР та ферментів, необхідних для синтезу фосфоліпідів. Кортикостероїди також індукують легеневі β-рецептори, які відіграють роль у виділенні сурфактанту та всмоктуванні альвеолярної рідини при стимуляції (131). Гормон щитовидної залози також має синергетичну дію на синтез фосфоліпідів з кортикостероїдами на моделях тварин (132, 133). Амброксол може також впливати на збільшення вивільнення поверхнево-активної речовини і знаходиться під розслідуванням для використання в RDS (134). Як повідомляється, гідроксихлорохін успішно лікував дітей з дефіцитом SP-C із застосуванням кортикостероїдів або без них (135–137). Механізм дії незрозумілий, але він може бути пов'язаний з пригніченням гідроксихлорохіном внутрішньоклітинної обробки попередників SP-C, що призводить до пізнього накопичення SP-C (138). Показано, що інші агенти, такі як фактор росту кератиноцитів, збільшують секрецію ПАР або його синтез (139).
Висновки
Таким чином, легеневий сурфактант виконує важливі функції, крім зменшення поверхневого натягу та зміни механічних властивостей, що призводять до зменшення роботи дихання. Оскільки легеневий епітелій знаходиться під постійним впливом навколишнього середовища, сурфактант забезпечує важливу першу лінію захисту від інфекції, посилюючи виведення патогенних мікроорганізмів, модулюючи реакцію запальних клітин та оптимізуючи біофізичну активність легенів. Гідрофільні білки, що складають невелику частину ПАР, відіграють важливу роль у протимікробній активності. Хоча сурфактант є загальноприйнятим методом лікування РДС у недоношених дітей, дотепер не було переконливої клінічної користі від використання екзогенного сурфактанту у дорослих пацієнтів з ГРДС. Подальші дослідження необхідно провести для вивчення можливості поверхнево-активних речовин як імуномодулюючої терапії або проектування малих молекул, які модулюють доступність компонентів сурфактанту при респіраторних захворюваннях.
- Роль вітамінів у патогенезі безалкогольної жирної хвороби печінки
- Нова роль аутофагії в алкогольній хворобі печінки
- Типи респіраторних вірусних інфекцій WTOP
- U2 s The Edge приносить місію охорони здоров'я Ватикану через продукти харчування, які борються із хворобами - зверніть увагу на
- Випробування на запальні захворювання кишечника UCSF → Персоналізоване дослідження дієти при виразковому коліті та