Нова роль аутофагії в алкогольній хворобі печінки
Анотація
Аутофагія - це високозбережений внутрішньоклітинний катаболічний шлях, який руйнує клітинні довгоживучі білки та органели. Як правило, аутофагія активується у відповідь на дефіцит поживних речовин та інші стреси як механізм виживання клітин. Накопичувальні дані вказують на те, що аутофагія відіграє вирішальну роль у патофізіології печінки, крім підтримки печінкової енергії та поживного балансу. Вживання алкоголю спричиняє метаболічні зміни в печінці, окислювальний стрес, накопичення крапель ліпідів та пошкодження мітохондрій, і все це може регулюватися аутофагією. Цей огляд узагальнює нещодавні висновки про роль та механізми аутофагії при алкогольній хворобі печінки та можливе втручання для лікування алкогольної хвороби печінки шляхом модуляції аутофагії.
Вступ
Аутофагія активується у відповідь на несприятливе середовище, таке як позбавлення поживних речовин або фактори росту, як механізм виживання 4–7. Це високозбережений внутрішньоклітинний шлях деградації, за допомогою якого об’ємна цитоплазма та зайві або пошкоджені органели огороджуються подвійними мембранними структурами, які називаються аутофагосомами 4–7. Вміст аутофагосом деградує після злиття з лізосомами, які потім називаються аутолізосомами. Однак аутофагія може траплятися і в базальних умовах, що називається базальною аутофагією. На додаток до своєї ролі у підтримці клітинного гомеостазу, аутофагія також відіграє роль у розвитку 8, захищаючись від мікробних інфекцій 9, та очищенні неправильно складених білків. Отже, порушення функції аутофагії може призвести до патогенезу численних захворювань людини, включаючи рак, нейродегенеративні захворювання, діабет, інфекційні захворювання та атрофію м’язів 10, 11 .
Вживання алкоголю та зловживання алкоголем є основною причиною захворювань печінки, що є головною проблемою здоров'я в Сполучених Штатах. Випивка алкоголю спричиняє різкі метаболічні зміни, пошкодження мітохондрій, порушення ліпідного гомеостазу, окислювальний стрес та загибель клітин у гепатоцитах. Все це може регулюватися аутофагією. У цьому огляді ми підсумуємо формується роль аутофагії при алкогольній хворобі печінки.
Машини для автофагії
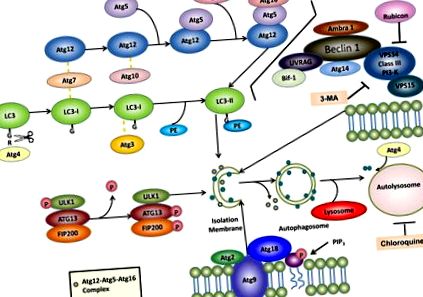
На сьогоднішній день у дріжджах ідентифіковано понад 30 різних генів, пов’язаних з аутофагією (Atg), і більшість із них мають гомологи ссавців, які беруть участь в аутофагії або процесі, пов’язаному з аутофагією12. Встановлено, що декілька багатомолекулярних комплексів сприяють формуванню аутофагосом, включаючи: (1) комплекс протеїн-кіназ ULK1, (2) комплекс PI3-кіназ VPS34-Beclin1 класу III, (3) комплекс Atg9-Atg2-Atg18 та (4) ) системи кон'югації Atg5-Atg12-Atg16 та Atg8/LC3 (рис. 1).
Аутофагія передбачає утворення подвійних мембранних аутофагосом, які зливаються з лізосомами, утворюючи аутолізосоми для деградації внутрішньоклітинних білків та органел. Для аутофагії необхідні щонайменше чотири важливі функціональні групи білків Atg: (1) комплекс протеїн-кіназ ULK1 та (2) комплекс PI3-кіназ VPS34-Beclin 1 класу III регулюють ініціювання аутофагії, (3) комплекс Atg9-Atg2-Atg18 регулює розширення PAS шляхом перенесення ліпідів, і (4) системи кон'югації Atg5-Atg12-Atg16 та LC3 регулюють подовження мембран аутофагосом. LC3, кон'югований з фосфатидилетаноламіном (PE) (званий LC3-II), залишається на мембранах ізоляції та мембранах автофагосом, тоді як комплекс Atg12-Atg5-Atg16 тимчасово асоціюється з мембранами ізоляції та дисоціює з мембранами аутофагосом. Як тільки аутофагосоми зливаються з лізосомами, утворюючи автолізосоми, внутрішня мембрана LC3-II деградується лізосомальними ферментами, тоді як зовнішня мембрана LC3-II декон'югується і рециркулюється Atg4. Також виділено фармакологічні інгібітори аутофагії, такі як 3-метиладенин (3-МА) та хлорохін. Детальніше див. У тексті.
Комплекс ULK у клітинах ссавців складається з ULK1 (який є гомологом дріжджів Atg1), FIP200 (молекула, подібна до дріжджів Atg17), Atg13 та Atg101 13–15. Цей комплекс головним чином локалізується в цитозолі та асоціюється з ізоляційною мембраною аутофагії при індукції аутофагії для регулювання ранньої стадії формування аутофагосом. Цей комплекс також працює нижче mTOR і служить клітинним датчиком стану поживних речовин для ініціювання аутофагії шляхом рекрутингу білків аутофагії, що перебувають за течією, до аутофагосом. Під час голодування або лікування рапаміцином mTOR пригнічується, що призводить до дефосфорилювання ULK1. ULK1 - це протеїнкіназа серин/треонін, а дефосфорильована ULK1 насправді є ферментативно активною, що веде до фосфорилювання Atg13 та FIP200 15. Вважається, що кіназна активність ULK1 важлива для вербування інших білків Atg, розташованих нижче за течією, таких як Atg16L, і подальшого утворення аутофагосом 16 .
Atg6 та його гомолог ссавців, Beclin 1, важливі для ініціювання та регуляції аутофагії 17. Beclin 1/Atg6 утворює комплекс з VPS34, VPS15 та Atg14. VPS34 - це PI-3-кіназа класу III, яка діє як важливий регулятор аутофагії, виробляючи фосфатидилінозитол-3-фосфат (PI-3-P). Діяльність VPS34 регулюється комплексом Beclin 1/Atg6. Bcl-2 та Bcl-xL взаємодіють з Beclin1, щоб утримати аутофагію, дисоціюючи взаємодію Beclin 1 та VPS34. Беклін 1 також зв'язується з кількома іншими білками, що індукують аутофагію, включаючи амбра-18 та УФРАГ 19. Bif-1/ендофілін B1 взаємодіє з Beclin 1 через UVRAG, діючи як регулятор на комплексі Atg6-VPS34 20. Рубікон (білок домену запущеного типу, що взаємодіє з Beclin 1 та містить цистеїн), взаємодіє з VPS34 і діє як негативний регулятор аутофагії 21, 22. 3-метиладенин (3МА), широко застосовуваний інгібітор аутофагії, інгібує PI-3-кіназу класу III і, в свою чергу, пригнічує утворення аутофагосом 23 .
Atg9 - єдиний трансмембранний білок серед основних білків механізмів аутофагії, який зберігається у всіх видів 24. Він пропонує шість запропонованих трансмембранних доменів з його карбоксильними кінцями, оголеними в цитозолі 25. У клітинах ссавців є два функціональні ортологи Atg9: Atg9L1 та Atg9L2. Atg9L1 експресується повсюдно, тоді як Atg9L2 експресується лише в плаценті та гіпофізі 26. Миші-нокаути Atg9 гинуть відразу після народження, подібно до інших мишей-нокаутів білкової техніки, що працюють на автофагії, таких як Atg3, Atg5, Atg7 та Atg16 27. У дріжджах Atg9 взаємодіє з Atg11 та Atg17, і ця взаємодія необхідна для регуляції шляху цитоплазми до вакуолі (Cvt) та аутофагії 28. Atg9 локалізується на місці збирання фагофорів (PAS) і взаємодіє з Atg18, зв’язуючим білком PI3-P, і білком периферичної мембрани, Atg2. Atg9 пропонується здійснювати циклічний рух між мережею транс-Гольджі, пізними ендосомами та PAS, щоб залучити додаткові мембранні джерела, необхідні для росту аутофагосомних мембран, залежно від клітинного стану поживних речовин 24, 25 .
У клітинах ссавців новоутворені аутофагосоми випадковим чином розподіляються в цитоплазмі 31. Під час свого дозрівання аутофагосоми рухаються вздовж мікротрубочок у напрямку до центру організації мікротрубочок, де лізосоми збагачуються. Потім аутофагосоми зливаються з лізосомами, утворюючи аутолізоми, можливо, через малу GTPase Rab7 та/або два білки лізосомальної мембрани, Lamp1/2A 32–34. Хімічні речовини, що порушують структуру мікротрубочок, такі як вінбластин, можуть пригнічувати аутофагію 35. На додаток до порушення механізмів термоядерного синтезу, хімічні речовини, що підвищують рН лізосом, такі як хлорохін та бафіломіцин А 1, або інгібітори лізосомальної протеази, такі як лейпептин, пепстатин А та E64D, є потужними інгібіторами автофагії .
Сигнальні шляхи, що регулюють аутофагію ссавців
Клас I PI3K-Akt-mTOR
Білки сімейства Bcl-2
ER стрес
Реактивні форми кисню та аутофагія
Споживання етанолу та активація аутофагії
Як один з найбільш активних органів, печінка відіграє центральну роль у регулюванні загального енергетичного балансу організму, контролюючи вуглеводний та ліпідний обмін. Печінка функціонує як основна буферна система для підтримки гомеостазу макро- та мікроелементів, що дозволяє іншим тканинам нормально функціонувати в умовах фізіологічного стресу 75. Дефіцит аутофагії, спрямований на печінку (нокаут Atg7), призводить до накопичення агрегатів білка, позитивних до убіквітину, пошкоджених мітохондрій, стеатозу та пошкодження печінки 76. Ці висновки підтверджують роль аутофагії для виживання у підтримці контролю якості білків, ліпідів та органел шляхом усунення пошкоджених білків та органел, а також надмірних крапель ліпідів у печінці під час стресу. Крім того, накопичувані докази в даний час вказують на те, що аутофагія також бере участь у загибелі клітин гепатоцитів, стеатогепатиті, зараженні вірусом гепатиту та гепатоцелюлярній карциномі 77–79 .
Гепатоцити мишей заражали аденовірусом-GFP-LC3 (10 вірусних частинок на клітину) протягом 16 годин, а потім або не обробляли (a) або обробляють етанолом (80 мМ) протягом 6 годин (b) з подальшою конфокальною мікроскопією для GFP-LC3 або електронною мікроскопією (c – d). N: ядра, M: мітохондрії. Головки стрілок: аутофагосоми; стрілки: аутолізосоми.
(a) Гепатоцити мишей інфікували Adenovirus-GFP-LC3 (10 вірусних частинок на клітину) протягом 16 годин, а потім завантажували Mitotracker Red (50 нМ) протягом 15 хв з подальшою обробкою етанолом (80 мМ) протягом 6 годин та конфокальною мікроскопією . Стрілки: GFP-LC3 позитивні кільцеподібні структури, що обволікають мітохондрії (мітофагія). (b) Трансгенних мишей GFP-LC3 обробляли етанолом (4,5 г/кг) через гостру маску протягом 16 годин. Кріосекції печінки готували і фарбували Bodipy 581/591-C11 для крапель ліпідів з подальшою конфокальною мікроскопією. Панель c - це збільшена фотографія із зони, що знаходиться в коробці, на панелі b. Стрілки: GFP-LC3 позитивні кільцеподібні структури, що обволікають краплі ліпідів (ліпофагія).
Механізми індукованої етанолом аутофагії
Вважається, що етанол може пригнічувати аутофагію, оскільки хронічне споживання етанолу знижує активність АМФК у печінці 97. Однак, як ми обговорювали вище, роль AMPK в аутофагії все ще залишається суперечливою, і інгібування AMPK також може викликати аутофагію 98. Крім того, AMPK індукує аутофагію, головним чином, інгібуючи mTOR. Оскільки mTOR активується Akt, статус mTOR в гепатоцитах, оброблених етанолом, залежить від ступеня порушеного Akt та AMPK етанолом. Висновок про те, що гострий етанол пригнічує mTOR, свідчить про те, що порушений Akt може відігравати більш домінуючу роль, ніж порушений AMPK, при індукованій етанолом аутофагії гепатоцитів 79. Отже, можливо, що активація AMPK, наприклад, обробка тварин агоністами AMPK, може додатково посилити індуковану етанолом аутофагію, максимально пригнічуючи mTOR. Повідомлялося, що кілька агоністів AMPK, таких як AICAR та метформін, суттєво захищають від пошкодження печінки, спричиненого етанолом, на тваринних моделях 99, 100. Однак залишається визначити, чи пов'язані ці захисні ефекти з індукцією аутофагії в цих моделях.
Слід також зазначити, що хоча різноманітні критерії для оцінки аутофагії вказують на те, що гострі стадії етанолу призводять до індукції аутофагії в гепатоцитах та печінці мишей, доказів, що підтверджують таку індукцію в моделі хронічного вживання алкоголю, відносно мало. Дані двох тез, представлених у 2010 р. The Liver Meeting, припускають, що аутофагія може бути підвищена в печінці миші, коли їх годували дієтою Лібера-ДеКарлі протягом 4 тижнів 84, 85. Однак незрозуміло, чи проводились в цих дослідженнях аналізи аутофагічного потоку. Тому доцільність аутофагії при хронічному вживанні алкоголю ще має бути визначена. Нарешті, було б цікаво побачити, чи не зміниться аутофагія у пацієнтів з АЛД. Центр печінки медичного центру Університету Канзасу зібрав понад 100 зразків печінки людини. Зараз ми плануємо дослідити аутофагію у деяких зразках хворих на алкоголізм.
Потенційні терапевтичні підходи до лікування АЛД шляхом модуляції аутофагії
Добре визнано, що АЛД є основною причиною захворюваності та смертності у світі. Однак існує кілька інших успішних методів лікування АЛД, крім утримання від пиття. Хоча важко розробити ефективне лікування хронічного впливу алкоголю, пов’язаного з патогенезом печінки, це було б більш застосовним для розробки методів лікування госпіталізованих пацієнтів з гострою алкогольною інтоксикацією, пов’язаною з пошкодженням печінки.
Висновки
Недавні дослідження показали, що алкоголь може активувати аутофагію як захисний механізм проти алкогольної травми печінки шляхом вибіркового видалення пошкоджених мітохондрій та печінкових крапель ліпідів. Індукована алкоголем аутофагія вимагає метаболізму алкоголю та вироблення АФК. Крім того, алкоголь може також викликати аутофагію, порушуючи шлях Akt-mTOR. Індуковане алкоголем інгібування протеасом та стрес ER, а також незалежні від AMPK та mTOR шляхи також можуть бути залучені до алкогольної аутофагії в печінці. Модулююча аутофагія може забезпечити нові терапевтичні підходи до лікування АЛД (рис.5).
Індукована етанолом аутофагія може опосередковуватися різними механізмами. (1) Індукована етанолом аутофагія вимагає метаболізму етанолу та вироблення АФК. АФК можуть активувати аутофагію, додатково пригнічуючи активність mTOR, Atg4B та протеасом. Інгібування протеасом може додатково викликати стрес ER та активацію JNK для активації аутофагії. (2) Етанол може також пригнічувати Akt і mTOR через регуляцію PTEN. (3) Індуковані етанолом AMPK та Akt можуть протидіяти один одному на mTOR, а порушений Akt відіграє домінуючу роль у пригніченні mTOR. (4) Інші незалежні від AMPK та mTOR шляхи залишаються визначеними при алкогольній аутофагії. (5) Індукована етанолом аутофагія вибірково видаляє пошкоджені мітохондрії (мітофагія) та краплі ліпідів (ліпофагія) для захисту від індукованого етанолом стеатозу та пошкодження печінки.
Автофогія в клітинах ссавців може активуватися різними подразниками. Хоча придушення мішені рапаміцину (мТОР) ссавців є основним сигнальним шляхом, що регулює аутофагію, аутофагія також може активуватися незалежно від мТОР різними стимулами. Двома основними шляхами, що регулюють mTOR в клітинах ссавців, є шляхи PI3K-Akt та AMPK. Шлях PI3K-Akt ініціюється зв'язуванням факторів росту інсуліну (IGF або інших факторів росту) зі своїм рецептором, активуючи тим самим PI3K. Активований PI3K перетворює PIP2 на PIP3, щоб активувати Akt. Потім Akt фосфорилює та інактивує комплекс TSC1/TSC2, що призводить до активації Rheb та mTOR. AMPK, як правило, активується за допомогою вищої кінази LKB-1 або підвищеного внутрішньоклітинного співвідношення AMP/ATP. AMPK може бути придушений хімічними інгібіторами, такими як сполука C. Активний AMPK потім безпосередньо фосфорилює TSC2 та інгібує mTOR для активації аутофагії. mTOR також фосфорилює дві цілі 4E-BP1 та p70S6K, що контролюють трансляцію білка.
- Роль вітамінів у патогенезі безалкогольної жирної хвороби печінки
- Лікування алкогольної хвороби печінки; Гастроентерологія; Гепатологія
- Розуміння жирової хвороби печінки, що є ключем до профілактики раку печінки
- Жінки з жирною хворобою печінки мають вищий серцево-судинний ризик - печінка
- Цей матеріал з овочів може допомогти боротися з жировою хворобою печінки