Роль харчових пептидів у метаболізмі ліпідів під час дисліпідемії та пов’язаних із нею станів здоров’я
Чібуйке Ч. Уденігве
1 Департамент екологічних наук, сільськогосподарський факультет, Університет Далхоузі, Труро, NS B2N 5E3, Канада
Кірсті Рувінен-Ватт
2 Кафедра рослинництва і тваринництва, сільськогосподарський факультет, Університет Далхоузі, Труро, NS B2N 5E3, Канада; Електронна пошта: [email protected]
Анотація
Клінічні дослідження на тваринах та людях продемонстрували здатність дієтичних харчових білків модулювати ендогенні рівні ліпідів під час порушення метаболізму ліпідів (дисліпідемія). Враховуючи сприйнятливість білків до шлункової протеолітичної активності, гіполіпідемічні функції білків, можливо, частково зумовлені їх пептидними фрагментами. Пептиди, отримані з їжею, можуть безпосередньо модулювати аномальний ліпідний обмін у клітинних культурах та на моделях дисліпідемії на тваринах. Вважається, що пептиди діють, порушуючи кишкове всмоктування харчового холестерину та ентерогепатичної циркуляції жовчних кислот, а також пригнічуючи ліпогенну ферментативну активність та експресію генів у гепатоцитах та адипоцитах. Останні дані свідчать, що гіполіпідемічна активність деяких пептидів зумовлена активацією печінкових ліпогенних факторів транскрипції. Однак докладні молекулярні механізми та структурні потреби пептидів для цих видів діяльності ще не з’ясовані. Оскільки гіполіпідемічні пептиди можуть виділятися під час ферментативної обробки їжі, майбутні дослідження можуть дослідити перспективи боротьби з метаболічним синдромом та супутніми ускладненнями з використанням багатих на пептиди функціональних харчових продуктів та нутрицевтичних продуктів.
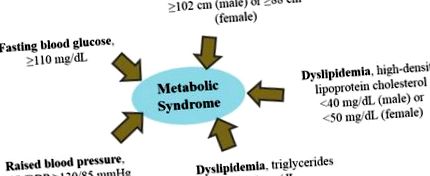
1. Дисліпідемія та метаболічний синдром
Дисліпідемія, аномальний ендогенний метаболізм ліпідів (включаючи гіперліпідемію) асоціюється з метаболічним синдромом. Національна освітня програма з холестерину III група лікування дорослих рекомендувала діагностувати метаболічний синдром, коли людина виявляє три або більше факторів, що визначають ризик [7].
2. Дієтичні пептиди та гіперліпідемія
Таблиця 1
Пептидні послідовності з гіполіпідемічною активністю **.
| KNPQLR | Β-конгліцинін сої | Зв’язування активного центру та пригнічення активності FAS in vitro шляхом взаємодії з домом/активністю тіоестерази FAS | [24] |
| EITPEKNPQLR | |||
| RKQEEDEDEEQQRE | |||
| LPYPR | Соєві білки (гліцинін) | Інгібування HMGCoAR in vitro (LPYPR); порушення міцелярної розчинності холестерину in vitro; надрегульовані ліпогенні гени CYP51, LDLR, LPL та CYP7A1, що призводить до зниження VLDL-C, TG у плазмі, але підвищений TC у плазмі крові з низькою екскрецією фекальних стеролів у гіперліпідемічних мишей, спричинених дієтою | [23] |
| WGAPSL | |||
| МИ | Синтетичний | Пряме зв'язування та трансактивація PPARα; підвищена експресія PPARα-чутливих генів метаболізму жирних кислот, FATP4, ACS, CPT1 та ACOX, а також зниження рівня внутрішньоклітинного холестерину та TG у культурі печінкових клітин | [25] |
| КРЕС | Синтетичний | Підвищений рівень холестерину ЛПВЩ у плазмі крові та знижений атеросклероз (на додаток до його антиоксидантної активності) у нульових апоЕ мишей; відсутність відомого механізму | [15] |
| KDW | Синтетичний | Підвищений рівень ЛПВЩ в плазмі крові та знижений рівень ЛПНЩ, ТС, ТГ та атерогенний індекс у плазмових щурів гіперліпідемії; відсутність відомого механізму | [22] |
| YPFVV (сойморфін-5) | Соєвий білок (β-конгліцинін) | Зниження TG плазми та печінки, а також ваги печінки; збільшення адипонектину в плазмі, печінкового рецептора адипонектину та експресії PPARα, що призводить до регуляції генів, що беруть участь у β-окисленні жирних кислот у мишей з діабетом KKAy | [26] |
| HIRL (β-лактотензин) | Білок молока (β-лактоглобулін) | Зниження рівня LDL-C і ТС у сироватці крові у гіполіпідемічних мишей, викликаних дієтою, опосередкованих рецепторами нейротензину (NT2) та дофаміну (D2), та стимулювало секрецію жовчних кислот | [27] |
** Вичерпний перелік інших гіполіпідемічних пептидів, отриманих з їжею, та їх механізми дії нещодавно були переглянуті Говардом та Уденігве [18]; HMGCoAR, 3-гідрокси-3-метилглутарил-кофермент А-редуктаза; ЛПНЩ-С, холестерин ліпопротеїдів дуже низької щільності; HDL-C, холестерин ліпопротеїдів високої щільності; LDL-C, холестерин ліпопротеїдів низької щільності; ТГ, тригліцериди; ТС, загальний холестерин; PPAR, рецептор, що активується проліфератором пероксисоми; FATP4, ген білка 4 транспортного жирного кислоти; ACS, ген ацил-КоА-синтетази; CPT1, ген карнітинпальмітоїлтрансферази 1; ACOX, ген ацил-КоА-оксидази.
3. Кишкові функції гіполіпідемічних пептидів
Роль білка яєчного білка, засвоюваного пепсином, у кишковому та лімфатичному засвоєнні харчового холестерину у щурів. Передруковано з [30] з дозволу Американського хімічного товариства, авторське право 2014 року.
4. Адипоцитарні функції гіполіпідемічних пептидів
5. Печінкові функції гіполіпідемічних пептидів
6. Висновки
Виходячи з поточної літератури, передбачається, що гіполіпідемічні ефекти харчових харчових білків можуть бути зумовлені пептидами, що виділяються після ферментативного гідролізу в шлунково-кишковому тракті. Ці ефекти можуть бути централізовано опосередковані безпосередньою взаємодією пептидів з факторами транскрипції та ферментативною активністю, пов’язаною з ендогенним метаболізмом ліпідів, особливо в гепатоцитах та адипоцитах. Більше того, фізичне порушення дієтичного всмоктування холестерину та ентерогепатична реабсорбція жовчних кислот пептидами може зіграти ключову роль в ендогенному гомеостазі холестерину. Гіполіпідемічні пептиди обіцяють використовувати для придушення синтезу та накопичення печінкових ліпідів, особливо в умовах здоров'я, таких як стеатоз печінки (неалкогольна жирова хвороба печінки). Більшість даних, представлених на сьогоднішній день, базуються на дослідженнях in vitro, клітинах та на тваринах. Отже, для підтвердження біоактивності необхідні клінічні дослідження на людях, щоб зробити переконливі твердження щодо застосування гіполіпідемічних пептидів, отриманих з їжею.
Подяка
Дослідницькі програми авторів підтримуються Радою з природничих та технічних досліджень Канади (NSERC) за допомогою грантів Discovery.
- Оцтова алергія! Обговорення харчової алергії Орган; Центр здоров'я
- Важлива роль картоплі, недооціненої овочевої харчової культури у здоров’ї та харчуванні людини
- Медичний центр UCSF Дієтичне стажування Огляд Харчування; Харчові послуги - UCSF Health
- Які ефекти швидкого харчування на дитяче ожиріння Бюлетень медичних новин Новини здоров'я та
- Нагнітаючи смачну революцію здоров’я! Функціональна їжа Японії; Напій від Tokyoesque Medium