Рівень азоту в сечі
Пов’язані терміни:
- Амінокислота
- Вуглеводи
- Білок
- Глюкоза
- Аміак
- Азот
- Андроген
- Вживання білка
Завантажити у форматі PDF
Про цю сторінку
Функція алкоголю та шлунково-кишкового тракту
3.4.2 Білки, жири та складні вуглеводи
Стеаторея та посилене виведення азоту з калу є загальновідомими особливостями хворих, що зловживають алкоголем, із екзокринною недостатністю підшлункової залози та/або розвиненою БА. Однак також спостерігається збільшення виведення жиру з калу у алкоголіків без цирозу або хронічного панкреатиту (Боде і Боде, 1990). Підвищена екскреція азоту у фекаліях спостерігалася також приблизно у 50% алкоголіків, які не мали ні запущеного захворювання печінки, ні хронічного панкреатиту (Roggin et al., 1969). Патомеханізм порушеного травлення та/або всмоктування ліпідів та білка у алкоголіків не з’ясований. Висновок про те, що етанол впливає на кишкові гідроліпіди пептидів (Dinda et al., 1984), може принаймні частково пояснити „мальабсорбцію” білка.
Важливий внесок у цю сферу внесло дослідження на алкоголіків без незрозумілих розладів, таких як цироз або недостатність підшлункової залози (Pfeiffer et al., 1992). Коли дванадцятипалої кишкою і порожниною кишечника поживного розчину, що містить суміш білків, ліпідів та вуглеводів (90% декстрину мальтози), визначали за допомогою кишкової перфузійної техніки, дуоденальна абсорбція всіх цих поживних речовин була меншою у алкоголіків порівняно з віком контролі, але швидкість абсорбції тонусної кишки не знижувалась, коли поєднували дані для дуоденального та тонкокишкового сегментів; жодних поживних речовин статистично значущих відмінностей між цими двома групами не виявлено (Pfeiffer et al., 1992). Автори пояснили, що різні показники поглинання дванадцятипалої кишки в порівнянні з порожньою кишкою алкоголіків були обумовлені більш вираженим алкогольним пошкодженням слизової в дванадцятипалій кишці.
Білок
Обов’язкові втрати азоту дорослого
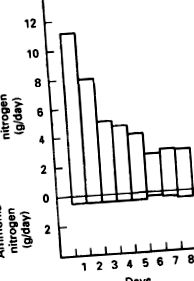
Наступне дослідження стосується даних про виведення азоту та включає людей. Він був розроблений для визначення обов'язкових втрат азоту. Випробовувані споживали дієту, яка забезпечувала 150 г глюкози на день. Дієта не містила білка. Протягом першої доби з сечею виводилось близько 11 г азоту, а з калом - близько 0,8 г. Протягом декількох днів на дієті, що містить лише глюкозу, вміст азоту в сечі стабілізувався на рівні приблизно 3,0 г/добу, а фекальний N - приблизно на 0,8 г/день. При стабілізації обов’язкових N втрат загальні N втрати становили близько 3,8 г N/день. Це значення еквівалентно приблизно 24 грамам втраченого в організмі білка на день. Втрати сечі N, як сечовини та аміаку, під час дієти, що містить лише глюкозу, показані на малюнку 8.18. Дані демонструють, що більшість втрат азоту в сечі приймали форму сечовини, а не іонів амонію.
РИСУНОК 8.18. Кількість відпрацьованого азоту в сечі протягом тижня.
Управління харчуванням пацієнтів з хронічною хворобою нирок
Нашат Імран,. Вільям Е. Мітч, Хронічна ниркова хвороба, 2015
Несечовинний азот
Підсумовуючи, загальна екскреція азоту обчислюється на основі ваги, екскреції НД та азоту сечовини. Загальна екскреція азоту порівнюється із призначеним споживанням білка. Якщо значення відрізняються більш ніж на 20%, тоді слід дослідити причини, що зумовлюють невідповідність або негативний баланс азоту. 24
Іншим потенційним використанням цього методу оцінки дієтичного білка було б спочатку оцінити споживання калорій пацієнтом. Це можливо, оскільки кваліфікований дієтолог може оцінити співвідношення дієтичного білка до споживання калорій з анамнезу дієти пацієнта. По-друге, споживання білка розраховується за цілодобовою продукцією азоту сечовини. По-третє, розраховане споживання білка ділиться на відношення білка до споживання калорій. Результат дає оцінку споживання калорій. Цей тип аналізу слід регулярно застосовувати у пацієнтів, які отримують дієти з обмеженими дієтами, оскільки повинно бути достатнє споживання калорій для використання білка в раціоні для підтримки запасів білка в організмі. Важливість регулярного використання цих розрахунків полягає в повідомленні про те, що пацієнти з ХХН часто "недооцінюють" споживання калорій, особливо якщо вони страждають ожирінням. 37 Інші методи оцінки споживання білка, включаючи історію дієти, менш точні, і з часом пацієнти вивчають відповідні відповіді на запитання про дієтичні звички. Наприклад, коли оцінювали показники харчових продуктів та антропометрію пацієнтів із ХХН, було виявлено, що споживання енергії було серйозно занижене при оцінці даних дієти.
Білок | Перетравлення та поглинання балансу білка та азоту
Вимірювання балансу азоту
Баланс азоту визначається як різниця між споживанням і виходом і може бути офіційно представлений наступним рівнянням: Баланс = I - U + F + M
де I - споживання азоту, U - екскреція азоту з сечею, F - фекальна екскреція азоту, а M - сума всіх інших шляхів втрати азоту з організму.
Споживання азоту в основному відбувається у формі білка, і його зручно виміряти методом Кельдаля, який вимірює практично весь азот, за винятком зв’язаного з киснем (наприклад, нітратів та нітритів). Таким чином, той самий метод також підходить для вимірювання різних компонентів виведення азоту. Точне визначення балансу азоту вимагає безпосереднього аналізу повторюваних частин дієти, хоча розумне наближення можна зробити, використовуючи дані зважених продуктів та таблиці складу їжі. Альтернативний підхід - годувати випробовуваних постійною кількістю дієти, яка була спеціально розроблена з використанням відомих кількостей інгредієнтів.
Сеча є основним шляхом виведення азоту, тому азот із сечею є головним фактором, що визначає баланс азоту, і для вимірювання балансу азоту необхідний надійний збір зразків сечі протягом 24 годин. Більша частина азоту в сечі знаходиться у формі сечовини, яка є кінцевим продуктом окислення амінокислот. Інші азотисті сполуки в сечі включають аміак, креатинін та сечову кислоту, а також невелику кількість пептидів, амінокислот та інших дрібних молекул. Кількість аміаку залежить від кислотно-лужного стану організму, а кількість сечової кислоти змінюється залежно від споживання нуклеїнової кислоти. Кількість креатиніну є досить незмінною у здорової людини і демонструє хорошу кореляцію з м’язовою масою. Коли споживання білка низьке, частка сечовини в сечі зменшиться, так що вміст сечовини в сечі не є надійним показником загального азоту в сечі.
Фекальний азот складається в основному з бактеріальних клітин товстої кишки, разом із клітинами слизової, які відшаровуються від стінок кишечника, та деякими залишками неперетравлених харчових білків. У звичайному змішаному харчуванні каловий азот становить досить постійні 8% споживання азоту, хоча на дієтах з високим вмістом клітковини, особливо на тих, що містять велику кількість бобових, ця частка може зростати. Для вимірювання балансу азоту зазвичай використовують нерассасывающийся маркер, щоб позначити початок і кінець збору калу, або використовувати безперервний маркер калу.
Інші шляхи втрати азоту з організму включають скидання волосся, нігтів та відмерлих клітин шкіри, піт, слину, сперму, кров, втрачену під час менструації або видалену для клінічного тестування, та аміак, що видихається вдиху. Шкірні втрати змінюються залежно від швидкості потовиділення та споживання білка. Багато з цих втрат невеликі і важко виміряти, так що можна взяти єдину цифру 0,5 г азоту на день, щоб наблизити суму цих різних шляхів.
Найважливіше використання азотного балансу - для оцінки достатності споживання їжі. Це основний критерій, який використовується для оцінки кількісних потреб у білках. Такі дослідження продемонстрували, що споживання енергії також є головним фактором, що визначає баланс азоту. Вимірювання азотного балансу також є основою багатьох біологічних методів вимірювання якості білка.
Амінокислоти
Альтернативні шляхи виведення відходів азоту
Харчова терапія хворих на хронічну хворобу нирок та її вплив на прогресуючу ниркову недостатність
Білковий еквівалент зовнішнього вигляду азоту
Цей метод оцінки споживання білка заснований на концепції, згідно з якою введений в організм азот дорівнює загальній екскреції азоту, якщо в азотному пулі в організмі немає змін. Поглинений всередину білок плюс продукти, що утворюються з ендогенного білка, метаболізуються до кількох азотистих продуктів (наприклад, сечовина, амінокислоти, пептиди, урати та креатинін). Якщо баланс азоту нейтральний (ні катаболізм, ні анаболізм), азотисті продукти, що виводяться з організму через сечу, стілець та шкіру, а також будь-які зміни в басейні азоту сечовини в організмі дорівнюють споживанню азоту. Оскільки сечовина є основним відходом азоту, споживання білка у стабільних хворих на ХХН можна оцінити за показником появи сечовини в сечі. 27, 28 Швидкість появи азоту сечовини (тобто виведення сечовини з накопиченням) паралельна споживанню білка, але екскреція азоту, що не містить сечовини (тобто азот з калом та сечовим креатиніном, сечовою кислотою, аміаком, пептидами тощо), не змінюється по суті з харчовим білком; воно в середньому становить 0,031 г Н/кг на день.
У рівноважному стані (коли азот сечовини в крові та його вага постійні) зовнішній вигляд азоту сечовини дорівнює екскреції азоту сечовини з сечею. Отже, споживання азоту дорівнює азоту сечовини в сечі плюс 0,031 г Н/кг. Щоб перетворити грами азоту в його білковий еквівалент (PNA), помножте його на 6,25, оскільки білки в середньому складаються з 16% азоту. Цей метод оцінки споживання білка може бути використаний для оцінки дотримання встановленої дієти, як це проілюстровано на прикладі у вставці 66-2 .
Існують важливі обмеження в інтерпретації оцінок споживання сечовини, що вживаються з їжею. По-перше, в катаболічних станах (наприклад, ацидоз, інфекція) ендогенний розпад білка може збільшити появу сечовини, тому PNA перевищує оцінки споживання білка. І навпаки, коли пацієнт стає анаболічним, PNA недооцінює фактичне споживання білка. По-друге, повсякденні зміни споживання білка швидко відображаються PNA, тому одне вимірювання може не сказати нам про середнє споживання білка за місяць. Нарешті, поява білкового азоту може не точно оцінювати споживання в крайніх межах споживання білка. Це пояснюється збільшенням втрат азоту через незмірені шляхи виведення при вищому споживанні білка та більшим ендогенним катаболізмом білка при меншому споживанні білка. 29 Незалежно від цього, цей метод є набагато точнішим і відтворюванішим, ніж дієтичний анамнез або методи відкликання.
Моніторинг та догляд
Елізабет Дж. Кері,. Хьюго Е. Варгас, у трансплантації печінки (третє видання), 2014
Стратегія зниження аміаку
Нерассасывающиеся дисахариди, такі як лактулоза, зазвичай застосовуються для зменшення виробництва аміаку в кишечнику. Лактулоза збільшує екскрецію азоту з калом за рахунок полегшення включення аміаку в бактерії та за допомогою катартичного ефекту. Лактулоза, що вводиться всередину, досягає сліпої кишки, де вона метаболізується кишковими бактеріями, викликаючи падіння рН. Це падіння рН призводить до метаболічного зсуву бактерій, що сприяє поглинанню аміаку. Дозу регулюють так, щоб здійснювати дві або три м'які дефекації на день. 127
Такі антибіотики, як неоміцин, також корисні для зниження рівня аміаку в крові, головним чином, впливаючи на вироблення аміаку кишковими бактеріями. Однак терапія неоміцином пов’язана зі значними токсичними побічними ефектами, і це призвело до небажання використовувати його як засіб першої лінії. 127 137
Введення нерассасывающегося антибіотика, рифаксиміну, як варіанту лікування ВІН змінило підхід до всіх пацієнтів з цирозом, які можуть мати ВІН. У 133,138,139 знаменному рандомізованому контрольованому дослідженні взяли участь 299 стабільних пацієнтів із задокументованим ВІН, яким було призначено рифаксимін проти плацебо. 140 Пацієнтам було дозволено залишатися на лактулозі (> 90% пацієнтів були на лактулозі). Клінічною кінцевою точкою був час першої госпіталізації для ВІН через 6 місяців лікування. З лікуваних пацієнтів у 22,1% розвинувся ВІН, 13,6% з них потребували госпіталізації. З пацієнтів групи плацебо у 45,9% розвинувся ВІН, госпіталізація - 22,6%. 140 Обидва результати були дуже значущими, і, незважаючи на занепокоєння щодо високого використання лактулози, FDA звільнила дорогу до затвердження рифаксиміну при лікуванні ВІН. Пацієнтам слід приймати 550 мг перорально двічі на день з лактулозою або без неї. Недавні дані свідчать про те, що якість життя хворих на цироз печінки підвищується після оптимального управління ВІН з додаванням рифаксиміну. 141
Альтернативною стратегією зниження рівня аміаку в крові є стимулювання фіксації аміаку. За нормальних фізіологічних умов аміак виводиться шляхом утворення сечовини в перипортальних гепатоцитах та шляхом синтезу глутаміну в перивенозних гепатоцитах, скелетних м’язах та мозку. При цирозі в печінці знижуються як ферменти циклу сечовини, так і активність глутаміну синтетази. Стратегії стимулювання залишкової активності циклу сечовини та/або синтезу глутаміну були випробувані протягом останніх 20 років. Одним з найбільш успішних засобів, що застосовуються дотепер, є l-орнітін- l-аспартат (ОА). Рандомізовані контрольовані клінічні випробування з ОА демонструють значне зниження аміаку та супутнє поліпшення психометричного тестування. 142
Бензоат також ефективний у зниженні рівня аміаку в крові як у пацієнтів із спадковими порушеннями циклу сечовини, так і у хворих на цироз печінки. У рандомізованому контрольованому клінічному дослідженні бензоату натрію проти лактулози було виявлено, що поліпшення нервово-психічних показників є порівнянним. 137
Критичне захворювання
LAURA E. NEWTON MA, RD, DOUGLAS C. HEIMBURGER MD, in Handbook of Clinic Nutrition (4th Edition), 2006
Протеоліз і втрата азоту
Гіперкатаболізм (прискорений протеоліз) часто зустрічається у важких хворих. В основному він походить від м’язів і може бути виміряний як збільшення виведення азоту сечовини з сечею. Це відображає системну реакцію на стрес, а не просто виділення білка з пошкоджених тканин. Як і витрата енергії (див. Рис. 9-2), виведення азоту пропорційне тяжкості образи. Глюкокортикоїди є головним посередником катаболізму білка, прискорюючи рух амінокислот від скелетних м'язів до печінки, де вони служать джерелами глюкози та білків гострої фази для захисту господаря. Аланін є головним попередником глюкози для продукування АТФ у гіперметаболічній відповіді. Глютамін також відіграє певну роль у глюкогенному процесі, вносячи в нирки азот для синтезу аміаку, який нейтралізує кислотне навантаження, спричинене швидкою деградацією білка. Виробництво вісцеральних білків, синтезованих печінкою, таких як альбумін та преальбумін, зменшується при критичних захворюваннях.
КВАШІОРКОР
Обмін білків
У квашіоркорі білок засвоюється належним чином, а утримання азоту набагато ефективніше, що можна побачити при падінні виходу азоту в сечі. Незалежно від того, чи впливає на загальний обмін білка рівень споживання білка, синтез білка зменшується в окремих тканинах, таких як м’язи та шкіра, оскільки вони діють як буфери для регулювання білкового обміну. (Див. ПРОТЕІН | Перетравлення та поглинання балансу білка та азоту.)
Структура амінокислот плазми демонструє характерні зміни. Концентрація незамінних амінокислот, особливо амінокислот з розгалуженим ланцюгом, знижується. Концентрація альбуміну в плазмі крові також знижується, оскільки швидкість синтезу дуже чутлива до зменшеного споживання білка і відразу падає на початку дефіциту білка в їжі. Концентрація γ-глобулінів, як правило, нормальна і навіть може бути підвищена в присутності інфекції. Інші білки плазми, такі як трансферин та білок, що зв’язує ретинол, знижені, і це пояснює частоту супутньої анемії та кератомаляції у квашіоркору. Також повідомляється про знижені концентрації деяких ферментів у плазмі, включаючи холінестеразу, лужну фосфатазу, амілазу та ліпазу.
Вправа для успішного старіння
Потреби в білках і фізичні вправи
Тренування високої інтенсивності опору явно анаболічні як у молодих, так і у старших людей. Дані нашої лабораторії демонструють зниження екскреції азоту на 10–15% на початку тренувань, яке триває протягом 12 тижнів. Тобто, прогресивне тренування з резистентністю покращує азотний баланс, отже, старші суб’єкти, які проводять тренінги з резистентності, мають нижчу середню потребу в білках, ніж у сидячих. 72 Цей ефект спостерігався при споживанні білка 0,8 г та 1,6 г, що вказує на те, що вплив тренувань на стійкість до затримки білка може не бути пов’язаним із споживанням білка з їжею. Ці результати дещо відрізняються від наших попередніх досліджень 73, які демонструють, що регулярні аеробні вправи викликають збільшення середньої потреби в білках середніх та молодих спортсменів на витривалість. Ця різниця, ймовірно, є наслідком підвищеного окислення амінокислот під час аеробних вправ, які можуть не бути присутніми під час тренувань з опору.
Strawford et al. 74 також продемонстрували подібні ефекти тренувань щодо опору на баланс азоту у пацієнтів з ВІЛ-втратою ваги. Дослідники вивчали ефекти анаболічного стероїду (оксандролон, 20 мг/добу та плацебо) та високоінтенсивні тренувальні вправи на опір у 24 чоловіків-еугонадалів із ВІЛ-асоційованою втратою ваги (середнє зниження маси тіла 9%). Обидві групи продемонстрували значне утримання азоту та збільшення сухої маси тіла, ваги та сили. Середні коефіцієнти приросту були значно більшими в групі оксандролону, ніж у групі плацебо за залишком азоту, нарахуванням FFM та міцністю. Результати були подібними незалежно від того, приймали пацієнти інгібітори протеази чи ні. Ці результати підтверджують позитивний вплив вправ на стійкість до затримки азоту та потреби в білках.
Ці дослідження, розглянуті в цілому, демонструють потужний вплив тренувань на опір на поживність білка. Анаболічні ефекти мають важливе значення для лікування багатьох марнотратських захворювань та станів, таких як рак, ВІЛ-інфекція, старіння, хронічна ниркова недостатність та недоїдання, що спостерігається у багатьох дуже старих чоловіків та жінок. Ефективно знижуючи харчові потреби в білках, вправи на опір можуть обмежити подальші втрати маси скелетних м’язів, одночасно збільшуючи м’язову силу та функціональну здатність.
- Попкорн - огляд тем ScienceDirect
- Кандидоз шкіри - огляд тем ScienceDirect
- Картопляний крохмаль - огляд тем ScienceDirect
- Відпочинок витрат енергії - огляд тем ScienceDirect
- Рисові висівки - огляд тем ScienceDirect