Протимікробна інактивація синього світла грамнегативних збудників у біоплівках: дослідження in vitro та in vivo
Юченг Ван
1 відділення лазерної медицини, китайська загальна лікарня НВО, Пекін
2 Медичний коледж Університету Нанкай, Тяньцзінь
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Сімін Ву
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Цзя Чень
3 Шанхайська дерматологічна лікарня, Китай
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Реабілітація Амін
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Мін Лу
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Бріш Бхаяна
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Цзе Чжао
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Клінтон К. Мюррей
7 Інфекційна служба, медичний центр армії Брук, форт Сем Х'юстон, штат Техас
Майкл Р. Гамблін
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
6 Гарвард-Массачусетський технологічний відділ, Наука та технології охорони здоров'я, Кембридж, штат Массачусетс
Девід С. Хупер
5 Відділ інфекційних хвороб, Масачусетська загальна лікарня, Гарвардська медична школа, Бостон
Тяньхонг Дай
4 Центр фотомедицини Велмана, Загальна лікарня штату Массачусетс, Гарвардська медична школа, Бостон
Анотація
Передумови. Біоплівки впливають на> 80% бактеріальних інфекцій у людини, і їх, як правило, важко викорінити через властиву їм лікарську стійкість.
Методи. Ми досліджували ефективність протимікробного синього світла (aBL) (довжина хвилі, 415 нм) для інактивації біоплівки Acinetobacter baumannii або Pseudomonas aeruginosa в мікропланшетах з 96 лунками або інфікованих мишачих ранах.
Результати. In vitro на 96-лункових мікропланшетах вплив 24-годинної та 72-годинної біоплівки A. baumannii на 432 Дж/см 2 aBL призвело до інактивації 3,59 log10 та 3,18 log10 колонієутворюючих одиниць (CFU), відповідно. Для біоплівки P. aeruginosa були досягнуті подібні рівні інактивації - 3,02 log10 та 3,12 log10 CFU, відповідно. У опікових ранах миші, інфікованих 5 × 10 6 КУО A. baumannii, потрібно було приблизно 360 Дж/см 2 та 540 Дж/см 2 aBL, щоб інактивувати 3 log10 КУО в біоплівках при доставці через 24 та 48 годин після бактеріального посіву. . Високоефективний аналіз рідинної хроматографії виявив наявність ендогенних порфіринів як у A. baumannii, так і у P. aeruginosa. Аналіз TUNEL не виявив апоптотичних клітин в опроміненій BL шкірі миші протягом 24 годин після впливу aBL (540 Дж/см 2).
Висновки. aBL має протимікробну активність у біоплівках A. baumannii та P. aeruginosa і є потенційним терапевтичним підходом до інфекцій, пов'язаних з біоплівкою.
Біоплівки впливають на> 80% бактеріальних інфекцій у людини [1]. У біоплівках живі бактерії об’єднані у високогідратований позаклітинний матрикс [2, 3]. Виснаження метаболічних речовин або накопичення відходів у біоплівках призводить до того, що бактерії переходять у повільний або незростаючий (стаціонарний) стан [3]. Як наслідок, біоплівки більш толерантні до звичайних антимікробних препаратів та захисних сил господаря порівняно з їх планктонними аналогами [4, 5], і асоціюються із стійкими інфекціями [6, 7]. Ситуація погіршується збільшенням появи мультирезистентних штамів бактерій, особливо мультирезистентних грамнегативних бактерій [8]. Потрібні нові терапевтичні підходи для боротьби з резистентністю до наркотиків при інфекціях, пов’язаних з біоплівкою [9].
Новий антимікробний підхід на основі світла - антимікробне блакитне світло (aBL) привертає все більшу увагу завдяки своєму властивому антимікробному ефекту без участі екзогенних фотосенсибілізаторів [10–14]. Механізм, що лежить в основі антимікробної активності АБЛ, досі не до кінця вивчений. Поширеною гіпотезою є те, що aBL збуджує природні ендогенні фотосенсибілізуючі хромофори (переважно беззалізні порфірини) і згодом призводить до утворення цитотоксичних активних форм кисню (АФК) [14]. У наших попередніх дослідженнях ми продемонстрували, що aBL селективно інактивує планктонні клітини бактерій (включаючи мультирезистентні штами), зберігаючи клітини хазяїна, і що він успішно усуває гострі інфекції при ранах мишей [15-17]. У цьому дослідженні ми додатково досліджували ефективність інактивації АБЛ біоплівки Pseudomonas aeruginosa та Acinetobacter baumannii в мікропланшетах з 96 лунками або опікових ранах миші з встановленими інфекціями.
МАТЕРІАЛИ І МЕТОДИ
Джерело синього світла
Для опромінення AB використовували прототип світлодіода (світлодіод; Vielight, Торонто, Канада) з піковим випромінюванням при 415 нм і повною шириною при половині максимуму 10 нм. Світлодіод був встановлений на радіаторі, щоб запобігти тепловому впливу на опромінену ціль. Опромінення на поверхні цілі регулювалося шляхом маніпулювання відстанню між апертурою джерела світла та ціллю і вимірювалось за допомогою вимірювача потужності/енергії PM100D (Thorlabs, Newton, New Jersey).
Штами бактерій
Бактеріальними штамами, що використовувались у цьому дослідженні, були P. aeruginosa ATCC 19660 (штам 180) та мультирезистентний клінічний ізолят A. baumannii. Обидва штами були зроблені біолюмінесцентними шляхом трансфекції люкс-оперону у штами бактерій, як було описано раніше [18, 19], що дозволяє здійснювати моніторинг біолюмінесценції бактерій у режимі реального часу за допомогою зображень біолюмінесценції. Бактерії регулярно вирощували в середовищі для інфузії серця (BHI), доповненому 50 мкг/мл канаміцину в орбітальному інкубаторі (37 ° C; 1300 г).
Співвідношення бактеріальної люмінесценції до колонієутворюючих одиниць (КУО) у біоплівках
Суспензії бактерій у BHI інкубували на 96-лункових мікропланшетах (200 мкл/лунка; приблизно 10 6 КУО/мл) протягом 24 годин, щоб забезпечити ріст біоплівки [20–22]. Наприкінці інкубаційного періоду біоплівки ретельно промивали двічі забуференним фосфатом фізіологічним розчином (PBS), щоб видалити неадгезивні бактерії, і в кожну лунку додавали 200 мкл PBS. Потім біоплівки в різних свердловинах піддавали впливу АБЛ при опроміненні 100 мВт/см 2 протягом різних періодів. Після експозиції aBL біоплівки піддавали як вимірюванню інтенсивності люмінесценції (у відносних одиницях світла [RLU]) за допомогою багатопластового зчитувача Віктор-2 1420 (EG&G Wallac, Гейтерсбург, штат Меріленд) та аналізу колонії. Для колонієутворюючого аналізу кожну лунку ретельно промивали, а потім вібрували обробкою ультразвуком протягом 1 хвилини. Потім суспензії збирали і висівали на агар BHI після серійних розведень, використовуючи метод, описаний раніше [23]. Загальну кількість КУО у біоплівках визначали та лінійно встановлювали з відповідною бактеріальною люмінесценцією.
aBL Інактивація бактерій у біоплівках in vitro
Суспензії бактерій у відварі BHI інкубували на 96-лункових мікропланшетах (200 мкл/лунка; приблизно 10 6 КУО/мл) протягом 24 або 72 годин, щоб забезпечити ріст біоплівки [20–22]. Під час інкубації культуральне середовище змінювали через день. В кінці інкубації біоплівки ретельно промивали двічі за допомогою PBS, і в кожну лунку додавали 200 мкл свіжого PBS. Потім біоплівки опромінювали aBL при опроміненні 100 мВт/см 2. У різні моменти часу після ініціювання опромінення AB, бактеріальну люмінесценцію біоплівки вимірювали за допомогою багатопластового зчитувача пластин, а життєздатність бактерій у біоплівках оцінювали на основі люмінесценції бактерій. Експеримент проводили у 4 повторах для кожної умови.
aBL Інактивація бактеріальних біоплівк при опіках миші
Дорослі самки мишей BALB/c у віці 7–8 тижнів і вагою 17–19 г були придбані у лабораторіях Charles River (Wilmington, MA). Всі процедури на тваринах були схвалені інституційними комісіями з догляду та використання тварин Массачусетської загальної лікарні (протокол 2014N000009) та узгоджувались із керівництвом Національного інституту охорони здоров’я.
До того, як на мишах виникли термічні опікові рани, мишей знеболювали шляхом внутрішньочеревної ін'єкції кетамін-ксилазинового коктейлю (100 мг/кг-20 мг/кг). Опікову рану часткової товщини третього ступеня отримали шляхом оголення депільованої ділянки на спині кожної миші протягом 3 секунд латунним блоком (1 см × 1 см), який нагрівали до теплового рівноваги киплячою водопровідною водою. Для підтримки балансу рідини під час відновлення вводили стерильний фізіологічний розчин (0,5 мл внутрішньочеревно). Через п’ять хвилин після індукції термічної травми суспензії бактерій (50 мкл), що містять 5 × 10 6 КУО в PBS, інокулювали на місця опіку і залишалися на місці, поки миші виходили з наркозу. A. baumannii був використаний як модельний збудник у цьому експерименті. Через 24 або 48 годин після бактеріального посіву, коли утворювались біоплівки в опікових ранах миші [24–27], aBL доставляли до заражених опікових ран із опроміненням 100 мВт/см 2. Мишам давали загальну експозицію світла до 360 Дж/см 2 та 540 Дж/см 2 в аліквотах для 24-годинних та 48-годинних опікових ран відповідно, з зображенням біолюмінесценції, що проводилося після кожної аліквоти світла . Для кожного стану (включаючи необроблений контроль) використовували групу 8–10 мишей.
Візуалізація біолюмінесценції In Vivo
Випромінювання біолюмінесценції бактерій в опікових ранах миші було виявлено за допомогою системи зображення біолюмінесценції Хамамацу (Hamamatsu Photonics KK, Bridgewater, New Jersey). Ця система включала посилену зарядну камеру (C2400-30H, Hamamatsu), розроблену для візуалізації при надзвичайно низьких рівнях світла (до рівня фотонів), контролер камери, камеру для зразків та процесор зображення (C5510-50, Hamamatsu ). При встановленні для підрахунку фотонів для максимальної чутливості використовувалася схема автоматичного підсилення контролера камери. Час інтеграції 2 хвилини використовували для отримання біолюмінесцентного зображення. Для кожного вимірювання фоновий сигнал віднімався від сигналу біолюмінесценції. Інтенсивність біолюмінесценції інфекцій визначали кількісно за допомогою програмного забезпечення Argus 5.0 (Hamamatsu).
Високоефективний рідинний хроматограф (ВЕРХ) Аналіз присутності ендогенних порфіринів у бактеріальних клітинах
TUNEL Аналіз апоптотичних клітин на опроміненій BL шкірі миші
опромінену bL шкіру миші досліджували на наявність апоптотичних клітин, використовуючи аналіз TUNEL, в якому фрагментована ДНК з апоптотичних клітин піддається кінцевому маркуванню флуорофором. Зразки біопсії шкіри збирали до і через 0 годин і 24 години після впливу AB. Зразки біопсії фіксували у 10% фосфатно-забуференному формаліні (Fisher Scientific) протягом 24 годин, обробляли і потім вносили у парафін. Серійні зрізи тканин товщиною 4 мкм аналізували за допомогою флуорометричної системи DeadEnd TUNEL (Promega, Madison, WI) відповідно до протоколу виробника. Коротко, після депарафінізації та регідратації, зрізи фіксували, проникали протеїназою К протягом 8–10 хвилин і неодноразово фіксували. Кришки 50 мкл кінцевої суміші дезоксинуклеотидилтрансферази наносили на зрізи на 1 годину при 37 ° С у зволоженій камері. Після видалення накладок покриття зрізи занурювали в SSC-буфер (2 ×) на 15 хвилин, промивали PBS і монтували із середовищем, що включає DAPI (Vectashield, Vector Laboratories). Зображення флуоресценції були зафіксовані за допомогою конфокальної мікроскопії FluoView FV1000-MPE (корпорація Olympus, Токіо, Японія) з ізотіоціанатом флуоресцеїну в якості фтору та DAPI в якості ядерного контрплями.
Для позитивного контролю зрізи тканин обробляли ДНКазою I для індукції фрагментації ДНК, використовуючи RQ1-ДНКазу без РНКази (каталог № M6101; Promega). Коротко, після обробки протеїназою К зрізи тканин обробляли 10 одиниць/мл ДНКази I протягом 10 хвилин при кімнатній температурі, а потім виконували решту етапів аналізу TUNEL.
Статистичний аналіз
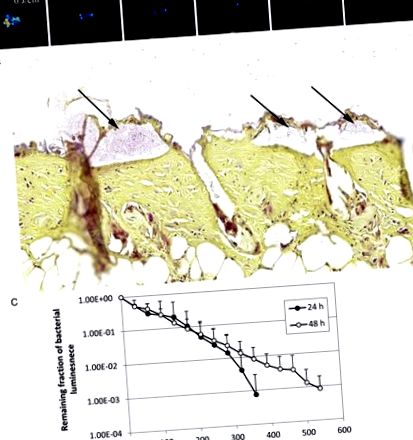
Протимікробна інактивація синього світла (aBL) біоплівки в інфікованих опікових ранах миші. A, Послідовне зображення бактеріальної люмінесценції з репрезентативної опікової рани миші, інфікованої 5 × 10 6 колонієутворюючими одиницями Acinetobacter baumannii і підданої впливу 360 Дж/см 2 aBL через 24 години після бактеріального посіву. B, пофарбований за Грамом зріз репрезентативного зразка рани від опіку шкіри миші, що показує наявність біоплівки A. baumannii (стрілки). Зразок шкіри збирали через 24 години після бактеріального посіву. С, Криві дози-відповіді середньої бактеріальної люмінесценції опікових ран миші, інфікованих 5 × 10 6 A. baumannii та оброблених AB протягом 24 годин (n = 10) та 48 годин (n = 10) після бактеріального посіву. Стовпчики позначають стандартні відхилення.
Рисунок 3 3 C показує криві дози-реакції середньої бактеріальної люмінесценції у опікових ранах миші, інфікованих 5 × 10 6 КУО A. baumannii та оброблених aBL відповідно через 24 та 48 годин після бактеріального посіву. Інфекції були більш стійкими до терапії АБЛ через 48 годин після щеплення, ніж через 24 години після щеплення. Для досягнення інактивації 3 log10 КУО A. baumannii в опікових ранах миші потрібно було приблизно 360 Дж/см 2 та 540 Дж/см 2 aBL відповідно через 24 години та 48 годин після щеплення (P = .06). Ця різниця полягає в тому, що інфекції через 48 годин після щеплення були глибше в шкірі миші, ніж інфекції через 24 години після щеплення. Бактеріальна люмінесценція опікових ран миші без впливу aBL залишалася майже незмінною протягом еквівалентного періоду (дані не показані; P Рисунок 4. 4. Піки інтенсивності викидів на хроматограмах (Рисунок (Рисунок 4 4 A та and 4 4 B) вказують на наявність ендогенних порфіринів як в A. baumannii, так і в P. aeruginosa. Для A. baumannii було виявлено 3 основних піки інтенсивності викидів за часів утримання приблизно 18,5 хв., 20,3 хв. і 21 хв. відповідно при загальному запуску час 30 хвилин (рис. (рис. 4 4 А). Для P. aeruginosa, крім піків інтенсивності викидів, що спостерігаються на хроматограмі A. baumannii, пік інтенсивності викидів при часі утримання 17,5 хвилин, що свідчить про наявність Спостерігали Pp IX (рис. (Рис. 4 4 B). Для обох штамів бактерій переважав пік інтенсивності викидів через 18,5 хвилин. Однак цей пік інтенсивності викидів не був виявлений у стандартній суміші порфірину s, що складається з уропорфірину, гептапорфірину, гексапорфірину, пентапорфірину, копропорфірину та мезопорфірину IX (дані не наведені).
Високоефективна рідинна хроматографія на хроматограмах екстрактів порфірину з Acinetobacter baumannii (A), екстрактів порфірину з синьогнійної палички (B) та стандартного протопорфірину IX (Pp IX; C).
Жодних апоптотичних клітин не виявлено в опроміненій BL шкірі миші
Зображення імунофлуоресценції репрезентативної шкіри миші до і через 0 годин і 24 години після одноразового впливу aBL (540 Дж/см 2), показані на малюнку Рис. 5, 5, не виявили присутності апоптотичних клітин в опроміненій BL шкірі миші. Флуоресценція, виявлена у позитивному контролі (ділянка шкіри миші, оброблений ДНКазою I), вказувала на наявність апоптотичних клітин.
Аналіз TUNEL апоптотичних клітин шкіри миші до і через 0 годин і 24 години після впливу антимікробного синього світла (540 Дж/см 2). Позитивний контроль обробляли ДНКазою I. Ядра фарбували синім кольором за допомогою DAPI.
ОБГОВОРЕННЯ
Загальновідомо, що біоплівки може бути важко знищити за допомогою традиційних антибіотиків і що повідомляється про 100–1000-кратне збільшення антимікробної толерантності/резистентності в клітинах біоплівки порівняно з планктонними клітинами [30]. Багато механізмів працюють разом, щоб створити високу загальну толерантність/стійкість до біоплівки [3], включаючи непроникнення антибіотиків до біоплівки [31], повільний темп росту [31], змінений обмін речовин [31], градієнти кисню [32], персистентні клітини [33], субпопуляції в біоплівках [34], мінімальні інгібуючі концентрації антибіотика [35], мутація [36], зондування кворуму [37] та генетичний перенос [38]. Результати цього дослідження є багатообіцяючими в тому, що aBL проникає в біоплівку як на ранніх стадіях (24-годинних), так і на зрілих (> 48-годинних) біоплівках.
З іншого боку, існує ймовірність того, що порфірини - не єдині ендогенні фотосенсибілізуючі хромофори, що містяться в бактеріях. Інші ендогенні фотосенсибілізуючі хромофори (наприклад, флавіни та цитохроми) також можуть існувати в бактеріях і сприяти ефекту інактивації aBL [14]. Потрібні подальші дослідження, щоб дослідити цю можливість.
Існує обмеження рівня АБЛ за ступенем проникнення світла, як і всі інші терапевтичні та діагностичні підходи на основі світла. У цьому дослідженні ми протестували лише ефективність інактивації ABB біоплівки на поверхні обпаленої шкіри миші - місця, де системна доставка ліків може бути обмежена, припускаючи, що терапія на основі світла може доповнювати системну антибактеріальну терапію в умовах опікової рани та інші шкірні інфекції. Для глибоко розташованих біоплівк світло, яке доставляється з інтерстиціальним покриттям, також може бути важливим фактором, і ми перебуваємо в процесі розробки патча з мікроігл-масиву, який може допомогти доставити aBL інтерстиціально до глибоко розташованих біофільмів [45].
Примітки
Подяка. Ми дякуємо Тайябі Хасан, доктору наук, у Центрі Велмана за її спільне керівництво Ю. В., Дж. С. та Р. А.
Застереження. Погляди, висловлені в цьому документі, належать авторам і не відображають офіційну політику або позицію Міністерства армії, Міністерства оборони або уряду США.
Фінансова підтримка. Цю роботу підтримав Центр з інтеграції медицини та інноваційних технологій згідно з Угодою про співробітництво з питань придбання медичних досліджень армії США (нагорода 14-1894 Т. Д.); Національний інститут охорони здоров’я (1R21AI109172 - Т. Д.); та Американське товариство лазерної медицини та хірургії (грант на дослідження студентів BS.S02.15 для Ю. В.).
Потенційні конфлікти інтересів. К. К. М. - працівник армії США. Усі інші автори не повідомляють про потенційні конфлікти. Усі автори подали форму ICMJE для розкриття потенційних конфліктів інтересів. Розкрито конфлікти, які редактори вважають відповідними до змісту рукопису.
- Синє світло має темну сторону - Гарвардське здоров'я
- Чорна смородина; Синя фруктова ферма
- Усунення втрати ваги, що; s Світло на гаманці - Новини - Gainesville Sun - Gainesville, FL
- 5 альтернатив розпилювачам для нержавіючої сталі
- Blue Buffalo Blue s Stew консервований вологий корм для собак - 1800PetMeds Category uuid 9474afa3548bc4ac54043a91b4