Порівняння перорального дидрогестерону з вагінальним прогестероном для супозиторіїв для підтримки лютеїнової фази при заплідненні in vitro (ЕКО): рандомізоване клінічне дослідження
Анотація
Передумови: Підтримка лютеїнової фази є обов'язковою для допоміжних репродуктивних технологій (АРТ) для оптимізації результату, тому лютеїнова фаза підтримується або прогестероном, додаванням естрадіолу до прогестерону, ХГЧ або агоністами вивільнення гормону гонадотропіну (GnRH). Доповнення лютеїнової фази прогестероном призначається жінкам, які проходять планове лікування ЕКО.
Завдання: Порівняти оральний дидрогестрон з вагінальним прогестероном для підтримки лютеїнової фази при ЕКО.
Матеріали і методи: Ми провели це проспективне рандомізоване дослідження у відділенні вищої медичної допомоги при безплідді в лікарні Талегхані, Тегеран, Іран. Загалом 80 жінок з чоловічим фактором безпліддя, які проходили контрольовану стимуляцію яєчників для лікування ЕКО (свіжий цикл), були випадковим чином розділені на дві групи (група А або пероральна група дидрогестерону та група В або вагінальна група прогестерону). Критеріями включення було використання аналога GnRH зниження регуляції та вік менше 40 років із регулярними менструальними циклами. Усі жінки були еутиреоїдними та нормопролактинемічними. Група A (n = 40) отримувала 10 мг дидрогестерону QID (40 мг щодня), а група B (n = 40) отримувала 400 мг супозиторію вагінального прогестерону (циклогеста) двічі на день (800 mg на день).
Результати: Клінічна частота вагітності в групі циклогестів була вищою, ніж у групи дидрогестерону, але різниця була незначною (р = 0,52), крім того, частота викиднів у двох групах була однаковою. Різниця між двома групами щодо антрального фолікула, кількості ембріонів, тривалості фази лютеїну, товщина ендометрію, кількість ооцитів та метафаза-II не були значущими (р> 0,05).
Висновок: Результати показали, що оральний дидрогестерон настільки ж ефективний, як і вагінальний прогестерон, для підтримки лютеїнової фази у жінок, які перенесли ЕКО.
Вступ
Добре встановлено, що функція лютеїну порушується в циклах запліднення in vitro (ЕКО), а дослідження на випадки ЕКО показали, що спостерігалося значне зниження рівня вагітності без підтримки лютеїнової фази (LPS) (1-3). За відсутності підтримки лютеїнової фази площа під кривою для прогестерону є неоптимальною і супроводжується передчасним лютеолізом, короткою лютеїновою фазою та ранніми кровотечами (4, 5). Прогестерон необхідний для імплантації та для раннього розвитку заплідненої яйцеклітини. У відповідь на прогестерон залози стають звивистими і секреторними, і відбувається збільшення судинності строми, що робить ендометрій як морфологічно, так і функціонально добре підготовленим до імплантації (6).
У допоміжних репродуктивних технологіях (АРТ) доповнення лютеїнової фази прогестероном є загальноприйнятою практикою, і кілька звітів підтвердили, що лютеїнова підтримка покращує результат ЕКО (7-9). Парентеральне введення прогестерону, вагінально або в/м, не піддається сполуці значним метаболічним наслідкам перорального прийому. Прогестерон, що вводиться всередину, піддається першопрохідному допечінковому та печінковому метаболізму. Ця метаболічна активність призводить до деградації прогестерону до його 5α та 5β редукованих метаболітів (10). Дидрогестерон - це оптичний ізомер прогестерону, в якому метильна група у вуглеці 10 розташована в положенні α замість β у природному прогестероні (11).
Ці зміни в рецептурі роблять дидрогестерон більш стабільним та ефективним у пероральному режимі, і доведено, що дидрогестерон має відмінне поводження з пацієнтами, низькі місцеві побічні ефекти та тривалість вагітності 31% після ЕКО (12). Пероральне введення є найпростішим способом введення і, як правило, найбільш прийнятним шляхом для пацієнта. Вагінальне введення призводить до більш високих концентрацій у матці, але часто є незручним за наявності вагінальної кровотечі або може бути змито, якщо кровотеча сильна.
Дидрогестерон має хороший профіль безпеки та переносимості. Структурно та фармакологічно подібний до природного прогестерону, має хорошу біодоступність у ротовій порожнині та мало побічних ефектів. Дидрогестерон не має андрогенного впливу на плід і не пригнічує утворення прогестерону в плаценті. Здавалося, ліки не мали побічних ефектів для матері. Лише Пелінеску-Ончул повідомив про сонливість. Гелле та Шеффер повідомляли про нудоту та блювоту, але лише у одного пацієнта, а Чанг - про нудоту та блювоту у двох пацієнтів. Однак нудота та блювота можуть бути пов'язані з самою вагітністю на ранніх термінах, а не ліками (13).
Здавалося, дидрогестерон асоціюється з більшою вагою при народженні, вищими показниками за шкалою Апгар за 1 хв та меншою частотою затримки росту. Однак ці відмінності не були суттєвими. Здавалося, вроджених вад розвитку було дуже мало. Багато статей спеціально не повідомляють про вроджені аномалії (13). Інші дослідники повідомляли про можливий зв’язок між вживанням дидрогестерону у матері під час вагітності та вродженими вродженими вадами розвитку. Типи дефектів були дуже різноманітними, без ознак відхилень. Дані не дають доказів вроджених вад розвитку, пов’язаних із вживанням дидрогестерону (14).
Однак є обмежені повідомлення про використання дидрогестерону в циклах АРТ для лютеїнових добавок, і ці дослідження підготували суперечливу інформацію про шлях введення прогестерону. Паткі та ін. Зазначили, що частота вагітності значно більша при застосуванні дидрогестерону, ніж при мікронізованому вагінальному прогестероні та плацебо (15). І навпаки, Левін та співавт. Порівнювали фармакокінетику перорального мікронізованого препарату прогестерону з такою вагінального гелю прогестерону та показали, що вагінальний гель асоціюється з вищою максимальною концентрацією прогестерону в сироватці крові. Вони дійшли висновку, що вагінальне введення прогестерону призводить до більшої біодоступності з меншою відносною мінливістю, ніж пероральний прогестерон (16).
Метою цього дослідження було порівняння дирогестрону у роті з природним вагінальним прогестероном для підтримки лютеїнової фази при ЕКО.
Матеріали і методи
Ми проводили це проспективне рандомізоване односліпове дослідження у відділенні третинного лікування безпліддя з травня по грудень 2012 року в лікарні Талегхані, Тегеран, Іран. Дослідження було схвалено етичним комітетом Університету медичних наук Шахіда Бехешті. Протокол дослідження було роз’яснено для всіх пацієнтів та надано письмові згоди. Загалом у це дослідження було включено 80 жінок з чоловічим фактором безпліддя, які проходили контрольовану стимуляцію яєчників для лікування ЕКО (свіжий цикл). Критеріями включення було використання аналога GnRH зниження регуляції та вік менше 40 років із регулярними менструальними циклами. Усі жінки були еутиреоїдними та нормопролактинемічними.
Жінки з матковим фактором, ідіопатичним безпліддям, пов’язаним з ендометріозом безпліддям та порушеннями овуляції, крім того, жінки з вихідним ФСГ> 12 МО та аденоміозом, полісиктичним яєчником, ендометріозом, міомою та хронічною гепаторенальною хворобою були виключені. Всі жінки отримували щоденну підшкірну (SC) ін'єкцію 500 мкг агоністу GnRH (Buserelin Suprefact; Aventispharma; Німеччина), потім рекомбінантний FSH, 150-300 МО (Gonal-F; Serono; Aubonne, Швейцарія) або FSH, високоочищений ( Фостимон; IBSA; Лугано).
Фолікулярний розвиток яєчників відстежували за допомогою трансвагінальної ультрасонографії, і 10000 МО хоріонічного гонадотропіну людини (хоріомон; IBSA; Лугано) вводили ІМ, коли принаймні два або більше провідних фолікулів досягали діаметру 18 мм. Ооцити отримували трансвагінально під ультразвуковим керівництвом через 34-36 годин після ін'єкції ХГЧ. Після збору яєць проводили процес ICSI. В середньому три ембріони були перенесені через 48-72 години після запліднення. Підтримка лютеїнової фази розпочалася в день вилучення ооцитів.
Пацієнтів випадковим чином розподіляли на дві групи (група А або пероральна група дидрогестерону та група В або вагінальна циклогест-група). для рандомізації; пронумеровані герметичні конверти були підготовлені та надані координатором дослідження згідно з таблицями з випадковими числами. Група A (n = 40) отримувала 10 мг дидрогестерону QID (Duphaston; Abbot; Istanbul), а група B (n = 40) отримувала 400 мг вагінального прогестерону двічі на день (Cyclogest; Actavis; Barnstaple; UK). Рівень β-ХГЧ у сироватці крові вимірювали через 12 днів після ЕТ.
Підтримка лютеїнової фази тривала до 12 тижнів вагітності. Результат у двох групах оцінювали з точки зору клінічної вагітності та частоти викиднів. Клінічна вагітність була визначена, коли ультразвукове сканування, проведене через 6 тижнів після ЕТ, виявило наявність життєздатного плода. Викидень - це втрата плода до 20-го тижня вагітності. Наявність щонайменше одного життєздатного плоду на терміні вагітності 12 тижнів було класифіковано як триваючу вагітність.
Статистичний аналіз
Дані аналізували за допомогою SPSS версії 20. Категоричні дані представлені як цифри (%), а безперервні дані - як середнє значення ± SD. Ми використовували квадрат Чая (X 2) або точний тест Фішера для порівняння категоріальних змінних та t-критерію Стьюдента, для порівняння безперервних змінних у двох групах. (p≤0,05 є значущим)
Результати
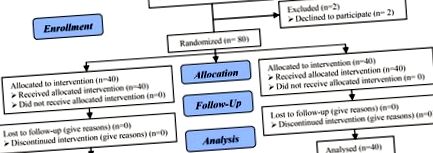
Було 82 пацієнти, які відповідали критеріям включення і були випадковим чином віднесені до двох груп. Деякі пацієнти відмовились від дослідження (блок-схема участі пацієнтів), тому для аналізу; у кожній групі було 40 пацієнтів, які продовжували брати участь. Відмінностей між групами щодо середнього віку, індексу маси тіла та рівня ФСГ не виявлено. Ці демографічні дані, включаючи середній вік, ІМТ та ФСГ жінок у двох групах, зведені в таблицю I. Різниця між двома групами щодо віку, ІМТ та ФСГ не була суттєвою (р> 0,05) [р віку: 0,13, ІМТ: 0,98, ФСГ: 0,83].
Таблиця I
Характеристика вихідних пацієнтів
| Середній вік, роки (SD) | 29,4 ± 5,26 | 31,84 ± 6,10 | 0,13 |
| Середній ІМТ, кг/м 2 (SD) | 24.20 ± 3.04 | 24,24 ± 3,89 | 0,98 |
| FSH день 3 (МО/л) | 6,85 ± 2,43 | 7,00 ± 2,42 | 0,83 |
ІМТ: Індекс маси тіла
Тим часом антральний фолікул, номер ембріона, тривалість лютеїнової фази, товщина ендометрію в день ЕТ, кількість ооцитів та метафаза-II були подібними між двома групами (таблиця II). Різниця між двома групами щодо (циклогест-дуфастон) не була суттєвою (р> 0,05) [значення P антрального фолікула: 0,349, номер ембріона: 0,48, тривалість лютеїнової фази: 0,44, товщина ендометрія: 0,21, число ооцитів: 0,59, метафаза -II: 0,83]. Виходячи з таблиці II, клінічна частота вагітності в групі циклогестів була вищою, ніж у групи дидрогестерону, але різниця не була значною (p = 0,52), крім того, частота викиднів у двох групах була однаковою [p = 0,95] (таблиця II). Однак кровотечі та інші ускладнення, такі як нудота та біль у епігастрії в групі дидрогестрону, були більшими, ніж у групі циклогеста, і різниця між двома групами була значною (p = 0,03 та p = 0,009 відповідно) (Таблиця II).
Таблиця II
Характеристика, клінічні результати та побічні ефекти ліків у двох групах
| Антральний фолікул | 0,349 | |||
| > 7 | 38 (95%) | 34 (85%) | ||
| 11 | 23 (63,2%) | 26 (69)% | ||
| 2) тест, незалежний t тест | ||||
Діаграма консорту
Обговорення
Гормональна підтримка лютеїнової фази в допоміжних репродуктивних технологіях (АРТ) історично була важливою проблемою для дослідників (17, 18). Нещодавно добавки прогестерону (Р) покращили результати під час АРТ і стали найкращим лікуванням (17–19). Що стосується шляху введення прогестерону, внутрішньом’язовий та трансвагінальний шляхи є двома звичайними методами введення прогестерону (20). Однак дуже мало досліджень порівнювали переваги перорального дидрогестрону з вагінальним прогестероном для підтримки лютеїну в циклах АРТ.
Дидрогестрон - це ретропрогестерон з хорошою пероральною біодоступністю, який має біологічно активний метаболіт прогестерону, який надає антиестрогенну дію на ендометрій, викликаючи секреторну трансформацію (20-23). Вайсбух та співавт. Порівнювали клінічну практику прийому лютеїнової фази (ЛПС) у стимульованих циклах ЕКО у 35 країнах, що складає в цілому 51 155 циклів ЕКО на рік. Вагінальний прогестерон лише застосовували для ЛПС у 64% циклів та ще в 16% циклів у поєднанні з будь-яким в/м. (15%) або пероральний прогестерон (1%). Як єдиний агент, i.m. прогестерон застосовували в 13% циклів, пероральний прогестерон ще в 2%, а хоріонічний гонадотропін людини (ХГЧ) все ще застосовували в 5% циклів (21).
У цьому рандомізованому клінічному дослідженні ми порівняли клінічну ефективність перорального дидрогестрону з вагінальним прогестероном (циклогестом) для ЛПС у стимульованих циклах ЕКО у 80 жінок. Що стосується демографічних даних, таких як вік, ІМТ та ФСГ на 3 день, дві групи були правильно підібрані, і різниця між ними не була суттєвою (p> 0,05). Наші результати показали, що клінічна частота вагітності в групі циклогестів була вищою, ніж у групи дидрогестрону (32,5% проти 25%), але різниця була незначною (р = 0,52), крім того, частота викиднів у двох групах була однаковою.
Відповідно до наших результатів, дослідження щодо ЛПС у жінок, які перенесли ЕКО за даними Chakravarty та співавт., Не показало суттєвих відмінностей у показниках вагітності, частоти викиднів або життєздатних пологів між жінками, які отримували пероральний дидрогестрон та вагінальний мікронізований прогестерон (22). Більше того, ще одне рандомізоване клінічне дослідження Ganesh et al підтвердило наші результати. Вони порівнювали оральний дидрогестрон з гелем прогестерону та мікронізованим прогестероном для підтримки лютеїнової фази та не вказували значущої різниці між трьома групами жінок щодо загальної вагітності та викидня (23). Крім того, інші дослідники повідомили про порівнянні результати нашого дослідження та визначили подібну ефективність з дидрогестроном та природним мікронізованим прогестероном у жінок, які перенесли ЕКО-ЕТ (24-26).
У цьому дослідженні різниця між двома групами щодо товщини ендометрію та рівня ФСГ не була значною, навпаки, Фатемі та ін. У своєму дослідженні порівнювали дидрогестрон та природний мікронізований прогестерон у пацієнтів із передчасною недостатністю яєчників та вказували суттєву різницю щодо розвитку залоз ендометрію, прогестерону в сироватці крові значення, значення LH та значення FSH (27). Ми призначили пероральний дидрогестрон настільки ж ефективний, як циклогест для ЛПС у жінок, які перенесли ЕКО, однак кровотечі та інші ускладнення, такі як нудота та біль у епігастрії в групі дидрогестрону, були більшими, ніж у циклогеста, і різниця між двома групами була значною.
Результати деяких досліджень, які були розглянуті в цій статті, виявили численні потенційні переваги дидрогестрону, які довели, що цей засіб може розглядатися як альтернатива вагінальному прогестерону для ЛПС. Згідно з цими висновками ми не виявили суттєвої різниці щодо антрального фолікула, числа ембріонів, тривалості фази лютеїду, товщини ендометрія, кількості ооцитів та фолікулів метафази-II між двома групами (р> 0,05). Більше того, Ганеш та співавтори припускають, що дидрогестрон є здатним агентом для ЛПС при ЕКО, крім того, можливо, уникнути таких побічних ефектів, як виділення та подразнення піхви (23). Основним обмеженням нашого дослідження був відносно невеликий обсяг вибірки. Для підтвердження результатів, про які повідомляється тут, рекомендуються подальші дослідження з більш тривалими подальшими спостереженнями та більшими серіями.
Висновок
Загалом ми підтвердили результати попередніх звітів і показали, що дирогестрон для прийому всередину настільки ж ефективний, як вагінальний прогестерон, для підтримки лютеїнової фази у жінки, яка перенесла ЕКО.
Подяки
Ми хотіли б подякувати доктору Моєну Ансару (доценту кафедри біохімії Університету медичних наук Гуйлана), д-ру Алірезі Юсефзад та медсестрам, адміністративному та секретарському персоналу клініки ЕКО в нашій лікарні, особливо пані Масуме Яздан Ашурі за їхній внесок у ведення нашого обліку пацієнтів, без якого цей проект був би неможливим.
Конфлікт інтересів
Автори не мають стосунків з компаніями, які можуть мати фінансовий інтерес до інформації, що міститься в рукописі.
- Сімейні історії - Історія Ноа - Група підтримки сім’ї MSUD
- Курка проти Туреччини - різниця та порівняння
- Кунілінгус, як дати (і отримати) оральний секс жінці
- Жирне знання Скільки людей може підтримати Земля
- Калорії проти вуглеводів - різниця та порівняння різняться