Харчове втручання для запобігання хворобі Альцгеймера: Потенційні переваги поєднаних каротиноїдів ксантофілу та жирних кислот Омега-3
Джон М. Нолан (а) ∗, Ріона Малкахі (б), Ребекка Пауер (а), Рейчел Моран (а) та Алан Н. Говард (с)
(а) Дослідницький центр харчування в Ірландії, Школа наук про здоров'я, Карріганор Хаус, Вотерфордський технологічний інститут, Західний кампус, Вотерфорд, Ірландія
(b) Відділ з догляду за віком, Університетська лікарня Уотерфорд, Вотерфорд, Ірландія
(c) Фонд Говарда, Кембридж, Великобританія
Прийнято 17 квітня 2018 року
Анотація.
Передумови: Зростаючий обсяг наукових доказів припускає, що збагачення деяких харчових сполук у мозку може зменшити ризик хвороби Альцгеймера (БА).
Завдання: Дослідити вплив додаткових каротиноїдів ксантофілу плюс жирних кислот омега-3 на прогресування захворювання у хворих на АД.
Методи: Було проведено три дослідні експерименти. У випробуваннях 1 та 2 (проведених на пацієнтах з АД протягом 18-місячного періоду) 12 пацієнтам (статус АТ на початковому рівні: 4 легкі та 8 середньої тяжкості) доповнено препаратом, що містить лише ксантофіл-каротиноїд (рецептура 1; лютеїн: мезо-зеаксантин: зеаксантин 10: 10: 2 мг/добу) та 13 пацієнтів (стан АД на початковому рівні: 2 легкі, 10 помірних та 1 важкий) були доповнені комбінацією каротиноїдів ксантофілу та риб’ячого жиру (рецептура 2; лютеїн: мезо-зеаксантин: зеаксантин 10: 10: 2 мг/день плюс 1 г/день риб’ячого жиру, що містить 430 мг докогексаєнової кислоти [DHA] та 90 мг ейкопентаенової кислоти [EPA], відповідно. У дослідженні 3 15 суб’єктів, вільних від АД (контрольна група), протягом 6 місяців отримували рецептуру 1. Відповідь каротиноїдів на ксантофіл крові вимірювали у всіх випробуваннях за допомогою ВЕРХ. Омега-3 жирні кислоти профілювали методом прямої інфузійної мас-спектрометрії.
Результати: Збільшення концентрації каротиноїдів ксантофілу було значно більшим для рецептури 2 порівняно із рецептурою 1 (р 13 мг/день).
Для всіх аналізів використовували статистичний пакет IBM SPSS версії 22 та застосовували рівень значущості 5%. SigmaPlot версії 8.0 був використаний для створення лінійної графіки для презентації. Результати були виражені як середнє значення ± стандартні відхилення в таблицях і середнє значення ± стандартні похибки для графіки. Відмінності між групами аналізували за допомогою t-тестів незалежних зразків, дисперсійного аналізу в один бік (ANOVA) або тестів хі-квадрат. Повторний дисперсійний аналіз (rANOVA) використовували для оцінки ефекту взаємодії часу та/або групи часу між групами лікувального втручання щодо концентрацій L, Z та MZ у сироватці крові. Ефекти часу перевіряють, чи не відрізняється відповідна змінна у різні моменти часу. Ефекти TimeGroup перевіряють, чи відрізняється часовий ефект між групами лікувальних втручань, тому перевіряють вплив втручання.
РЕЗУЛЬТАТИ
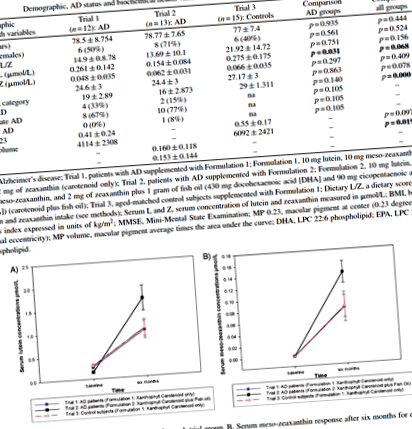
У таблиці 1 нижче наведені вихідні дані для пацієнтів з БА та суб'єктів контролю, які брали участь у трьох випробуваннях. Як видно з цієї таблиці, пацієнти з АД у дослідженні 1 та дослідженні 2 були порівнянними за віком, статтю, ІМТ, споживанням Л/З в їжі, концентрацією Z у сироватці крові та категорією АД. У пацієнтів у дослідженні 2 концентрація L у крові була значно нижчою, ніж у пацієнтах у дослідженні 1 (р = 0,031). Іншими спостереженнями на вихідному етапі були позитивні та статистично значущі взаємозв'язки між дієтичним споживанням L і Z та концентраціями L і Z у сироватці крові (r = 0,601, p = 0,000 та r = 0,330, p = 0,043, відповідно).
Біохімічна відповідь: каротиноїди ксантофілу та жирні кислоти омега-3
Збільшення концентрацій L та MZ було значно більшим у хворих на АД, які отримували комбінацію ксантофілінових каротиноїдів та омега-3 жирних кислот (рецептура 2), порівняно з хворими на АД, які отримували лише ксантофілірові каротиноїди (Композиція 1) та у порівнянні з контрольною групою, яка була доповнена рецептурою лише для ксантофілу каротиноїдів (Формулювання 1) (сироватка L: p = 0,002, рис. 1A; сироватка MZ: p = 0,006, рис. 1B). Крім того, для дослідження 2, концентрації DHA та EPA зростали в крові хворих на АД (слід зазначити, що вимірювання DHA та EPA проводились лише в цьому дослідженні, оскільки в інших дослідженнях не було DHA чи EPA у рецептурі добавки). Збільшення вмісту DHA, головного компонента риб’ячого жиру, що використовується у рецептурі 2, було статистично значущим (p = 0,041, див. Рис. 2).
Клінічна/функціональна відповідь у пацієнтів із хворобою Альцгеймера
На малюнках 3A та 3B представлений статус AD для випробування 1 на базовому рівні та 18 місяців відповідно. На малюнках 4A та 4B представлений статус AD для випробування 2 на базовому рівні та 18 місяців відповідно. Слід зазначити, що дані за 18 місяців представляють медичні спостереження та стан здоров'я пацієнта (див. Таблицю 2). Як видно з секторних діаграм (рис. 3А, В) та таблиці 2, прогресування АД було очевидним у цій групі (дані з випробування 1, втручання лише з ксантофіловим каротиноїдом) протягом 18-місячного періоду, з 42% стану здоров'я пацієнта впавши до того, що вони не могли продовжувати процес. Причини відмови включали: пацієнт переїхав до будинку престарілих через прогресування АД та не зміг прийняти добавку; пацієнту стало занадто погано, щоб продовжувати; занадто сильний когнітивний спад; більше не в змозі виконувати інструкції. Однак, як видно з рис. 4А та 4В (дані з випробування 2, втручання каротиноїдів ксантофілу та риб'ячого жиру) та таблиці 2, прогресування АД виявилося набагато меншим, а доглядачі повідомляли про функціональні переваги в пам'яті, зорі та настрої. Аналіз Пірсона Хі-Квад продемонстрував статистично значущу різницю між групами щодо змін, що спостерігаються у статусі АД, від вихідного рівня до 18 місяців (р = 0,003).
- 20 рецептів, наповнених рецептом Bon Omega-3 жирних кислот; синиця
- 2018 найкращі історії кардіології - це жирні кислоти Омега-3, кардіопротекторні, це залежить ...
- Випадок важкої гіпертригліцеридемії та жирних кислот Омега-3
- Дієта, багата довголанцюговими омега-3 жирними кислотами, модулює ситість у добровольців із надмірною вагою та ожирінням
- Біомолекули Безкоштовні повнотекстові довголанцюгові поліненасичені жирні кислоти Омега-3 у природних екосистемах