Перехід на здорову дієту запобігає згубним наслідкам західної дієти при коліторектальній моделі раку, пов’язаної з колітом
Шарлотта Грешель
Максиміліан Принц-Вольгенанн
Ільдіко Местері
2 Інститут патології Юберлінген, 88662 Юберлінген, Німеччина; [email protected]
Собха Карутедом Джордж
Лена Травнічек
Деніз Хайден
Абхішек Аггарвал
Самаванша Теннакоон
Максиміліан Баумгартнер
3 Відділ гастроентерології та гепатології, кафедра внутрішніх хвороб 3, Віденський медичний університет, 1090, Відень, Австрія; [email protected] (M.B.); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (М.Л.)
Крістоф Гаше
3 Відділ гастроентерології та гепатології, кафедра внутрішніх хвороб 3, Віденський медичний університет, 1090, Відень, Австрія; [email protected] (M.B.); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (М.Л.)
Міхаела Ленг
3 Відділ гастроентерології та гепатології, кафедра внутрішніх хвороб 3, Віденський медичний університет, 1090, Відень, Австрія; [email protected] (M.B.); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (М.Л.)
Родріг Маркулеску
4 Кафедра лабораторної медицини, Віденський медичний університет, 1090, Відень, Австрія; [email protected]
Тереза Мангхардт
Мартін Шепельманн
Еніке Каллай
Пов’язані дані
Анотація
Запальна хвороба кишечника збільшує шанси розвитку раку, асоційованого з колітом. Ми висунули гіпотезу, що дієта західного типу (WD) посилює азоксиметан (AOM)/декстрану сульфат натрієвої солі (DSS), викликаний колітом, асоційований туморогенез, і що перехід на стандартну дієту AIN93G полегшить симптоми захворювання навіть після початку раку. Самки мишей BALB/c отримували або WD (група WD), або стандартну дієту AIN93G (група AIN) протягом усього експериментального періоду. Через п'ять тижнів миші отримували 12,5 мг/кг AOM внутрішньочеревно, після чого три циклу DSS. В одній групі мишей WD був переведений на AIN93G за день до початку першого циклу DSS (група WD/AIN). Годування ВД протягом усього експериментального періоду посилювало симптоми коліту, скорочувало товсту кишку (p Ключові слова: запальна хвороба кишечника, асоційований з колітом рак, мікробіом, західна дієта, вітамін D, неалкогольна жирова хвороба печінки, CYP24A1, шлях Wnt, аномальні вогнища склепи, регенерація слизової
1. Вступ
Захворюваність на запальні захворювання кишечника (ВЗК) постійно зростає. Стандартна терапія виразкового коліту та хвороби Крона має обмежену ефективність [1]. Зростання захворюваності на ВЗК у промислово розвинутих регіонах світу та новий початок у країнах, які застосовують західний спосіб життя, свідчать про те, що зміна харчових звичок до типового західного раціону сприяє розвитку ВЗК [2,3]. Хворі на ВЗК мають підвищений ризик розвитку асоційованого із запаленням раку прямої кишки (САС) [4]. Недавній мета-аналіз повідомив, що туморогенез у хворих на ВЗК відбувається, скоріше, в проксимальній частині товстої кишки і пов'язаний з гіршим прогнозом порівняно зі спорадичним колоректальним раком (КРР) [5]. Є деякі дані, що проксимальні пухлини товстої кишки частіше розвиваються у жінок [6].
Епідеміологічні дані свідчать про позитивну кореляцію між дієтами з високим вмістом жиру та збільшенням захворюваності на ВЗК та КРР [7,8]. Жир тваринного походження є фактором ризику розвитку раку товстої кишки, тоді як адекватна кількість n-3-поліненасичених жирних кислот, які містяться в соєвій олії [9], зменшує ризик розвитку КРР [10] та зменшує запалення [11,12 ]. Загальна кількість харчового жиру, джерело та склад ліпідів впливають на пухлинні та запальні процеси [13]. Насичені жирні кислоти мають прозапальні властивості [14]. Масляний жир сприяє запаленню кишечника завдяки збільшенню продукування фактора некрозу кишкового тракту-α у мишей [15]. Вивільнення запальних цитокінів та індукція окисного стресу з вроджених та адаптивних імунних клітин активують β-катенін та ядерний фактор каппа-підсилювач легкого ланцюга активованих В-клітин (NF-κB), два фактори транскрипції, які регулюють загоєння рани епітеліального кишечника але також призводять до злоякісної трансформації [16,17,18].
Хімічна індукція запаленого туморогенезу азоксиметаном (AOM) та DSS є моделлю, яка нагадує САС людини за своїми гістопатологічними та запальними ознаками [33]. Індуковане DSS пошкодження тканин переважно впливає на проліферативний відділ крипти, джерело регенерації епітелію [34].
Ми дослідили, чи можна запобігти згубний вплив так званої “дієти західного типу” (ЗЗ), що містить багато жирів тваринного походження, але не має кальцію, вітаміну D, донорів метилу та клітковини, на утворення пухлини, пов’язаної з колітом WD до нормальної "здорової" дієти AIN93G, що містить соєву олію та достатній рівень мікроелементів та клітковини.
2. Матеріали та методи
2.1. Тварини, дієти та модель пухлинного генезу AOM/DSS
Чотиритижневі самки мишей BALB/c (річка Чарльз, Німеччина) були розміщені в приміщенні для тварин Інституту патофізіології та досліджень алергії Віденського медичного університету в контрольованому середовищі з 12-годинним циклом світло-темрява. При підтримці умов життя та проведенні експериментів дотримувались вказівок Правил Європейського Союзу щодо догляду та використання лабораторних тварин. Дослідження було схвалено Комітетом з етики Віденського медичного університету, а також Австрійським федеральним міністерством науки, освіти та досліджень (No: BMWF-66.009/0069-WF/V/3b/2015). Після доставки мишей випадковим чином розподіляли на три групи і протягом 14 днів акліматизувались у звичайній чау-їжі, перш ніж вони отримували або дієту AIN93G, або WD (ssniff EF R/M згідно TD88137 mod.), Модифіковану для жиру, кальцію, вітамін D, донори метилу та клітковина, подібні до New Western Diet від Newmark et al. [20] (Таблиця S1).
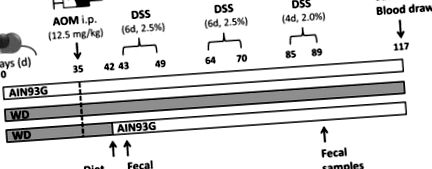
Одна група отримувала виключно дієту AIN93G (група AIN, вісім тварин), тоді як інша отримувала лише WD (група WD, дев'ять тварин) протягом експериментального періоду. Третю групу підтримували на ВД протягом 42 днів до того, як дієта перейшла на дієту AIN93G (група WD/AIN, вісім тварин) за день до початку першого циклу DSS (MP Biomedicals, Solon, OH, США). Після 35 днів годування дієтою WD або AIN93G миші отримували 12,5 мг/кг AOM (Sigma Aldrich, Сент-Луїс, Міссурі, США) через інтраперитонеальну (i.p.) ін'єкцію для індукції пухлини. Мишей обробляли трьома циклами DSS (перший і другий цикли DSS: шість днів, 2,5% на цикл, третій цикл: чотири дні, 2% DSS), додавали в автоклавовану водопровідну воду, щоб викликати запалення для просування пухлини. Мишей евтаназували через 28 днів після закінчення третього циклу DSS, на 117 день (Фігура 1). Кров відбирали шляхом пункції серця. Видалили нирку, печінку, селезінку та товсту кишку. Товсту кишку промивали крижаним сольовим буферним сольовим розчином (PBS), відрізали 0,5 см від кожного кінця та заморожували у рідкому азоті. Залишок ободової кишки згортали у швейцарський рулет [35], фіксували у 4% формальдегіду-PBS і згодом вкладали парафін. Печінку та нирки розрізали на дві половини для швидкого заморожування та вкладання парафіну, як описано вище.
Графічне зображення протоколу лікування. Три групи жіночих мишей BALB/c отримували або дієту AIN93G, або дієту західного типу (WD) протягом 35 днів, перш ніж отримували азоксиметан (AOM) внутрішньочеревно (ip) за день до початку першого циклу декстрану сульфату натрію солі (DSS), в одній групі WD перейшов на дієту AIN93G. Мишей забивали через 28 днів після третього циклу DSS.
2.2. Аналіз мікробіоти
Кал збирали в перший день першого та в останній день третього циклу СППР. Зразки швидко заморожували у рідкому азоті та зберігали при -20 ° C. ДНК виділяли за допомогою міні-набору для стільця QIAamp Fast DNA (Qiagen) згідно з інструкціями виробника, збиваючи кульки за допомогою пробірок Lysing Matrix E (MP Biomedicals) перед екстракцією. Секвенування амплікону гена 16S рРНК та підготовку бібліотеки проводили із застосуванням стандартного протоколу Illumina [36]. Зчитування обробляли за допомогою програмних пакетів DADA2 [37] та SINA [38]. Для аналізу подібності зразків використовували модифіковані сценарії Rhea [39]. Узагальнені відстані UniFrac візуалізувались за допомогою багатовимірного масштабування [40]. Ми оцінили значущість кластера, використовуючи дисперсійний перестановний багатовимірний аналіз. Тестування на суттєві відмінності у різноманітності та чисельності бактерій проводили за допомогою тесту підсумкової оцінки Крускала-Уолліса за методом Бенджаміна-Хохберга для корекції для багаторазового порівняння. Ми використали U-тест Манна-Уітні для порівняння філогенетичних відстаней.
2.3. Зразки тканин, виділення РНК, зворотна транскрипція та кількісна RT-PCR
Швидко заморожену тканину гомогенізували за допомогою 24-подвійного гомогенізатора Precellys (Precellys, Франція) у реагенті TRIzol (Life Technology, США), і РНК виділяли відповідно до інструкцій виробника. Цілісність РНК перевіряли на агарозних гелях, забарвлених гелем Грін (Peqlab, Австрія). Зворотну транскрипцію та qRT-ПЛР проводили, як описано раніше [41]. Для розрахунку за методом tCt експресія цільового гена була нормалізована до двох еталонних генів - мишачого бета-актину (ActB) та мишачого еукаріотичного коефіцієнта подовження трансляції 1 beta 2 (Eef1β2) і була встановлена щодо калібратора загальної РНК (Клонтех, Маунтин-Вью, Каліфорнія, США). Послідовності праймерів контрольних генів [42] та Occludin та Tlr4 [27] були описані раніше. Послідовності праймерів інших генів, що представляють інтерес, наведені в таблиці S2.
2.4. Гістологічне дослідження зрізів товстої кишки
Чотири мікронні зрізи тканини вирізали із швейцарських рулонів товстої кишки, вкладених у парафін, і фарбували розчином гематоксиліну Майера та еозином (Sigma Aldrich). Патолог оцінив хронічне запалення та туморогенез, засліплений для лікування, і оцінив ступінь коліту на основі кількості уражень, а також їх тяжкості, призначивши гістопатологічний бал (0–4), 0 = відсутність коліту, 4 = важкий коліт [ 43]. Діагностували аномальні вогнища крипт (АКФ), дисплазію та карциному in situ, і величину уражень визначали кількісно, підраховуючи уражені крипти. Оцінку дисплазії визначали згідно з методом Riddell et al. [44].
2.5. Імуногістохімія та імунофлуоресценція
2.6. Статистичний аналіз
Весь статистичний аналіз проводили за допомогою SPSS версії 22 (IBM, США), а графіки складали GraphPad Prism версії 7 (GraphPad Software Inc., Сан-Дієго, США). Ненормально розподілені дані були перетворені в журнал для досягнення нормального розподілу та проаналізовані за допомогою одностороннього ANOVA за допомогою пост-hoc тесту Тукі, де це доречно. Значні викиди були виявлені за допомогою тесту "вибігу" Груббса і були виключені з аналізу. Ненормально розподілені дані були проаналізовані Крускалом Уоллісом за допомогою пост-хок-тесту Данна.
- Дієта Софі Вессекс Єдина їжа, яка надає графині здоровий блиск
- Повні жінки на низькоенергетичній дієтичній дієтичній дієті лейцину, аргініну або гліцину
- ЧИСТА ЗДОРОВА дієта, що включає молочні продукти та м'ясо, може бути корисною для серця у всьому світі - Американський коледж ім
- Планові та дієтичні тренування Наомі Кемпбелл - здоровий Celeb
- Природні Найпопулярніші суворі дієти для швидкого схуднення здоровими - Управління HazMat