Передопераційна оцінка харчування з використанням контрольного показника харчового статусу для прогнозування фістули підшлункової залози після панкреатодуоденектомії
Анотація
Backgound: Це дослідження мало на меті визначити корисність оцінки контролю за харчовим статусом (CONUT) для прогнозування післяопераційного свища підшлункової залози (POPF). Пацієнти та методи: Були включені дані 108 послідовних випадків панкреатикодуоденектомії, виконаних у хірургічному відділенні Клінічного центру Івакуні з квітня 2008 року по травень 2018 року. Були зібрані дані доопераційного пацієнта та післяопераційних ускладнень. Результати: З 108 пацієнтів (чоловіки = 65; жінки = 43; середній вік = 70 років), 41 (37,9%) мали показання до панкреатикодуоденектомії через карциному підшлункової залози. Ступінь B або вище POPF діагностовано у 32 пацієнтів (29,6%). При багатофакторному аналізі індекс маси тіла ≥22 кг/м 2 [співвідношення шансів (АБО) = 5,24; p = 0,005], оцінка CONUT ≥4 (АБО = 3,28; р = 0,042), непанкреатична карцинома (АБО = 47,17; р = 0,001) і низька обчислена величина ослаблення томографічного контрасту (пізнє/раннє співвідношення) (АБО = 4,39; p = 0,029) були незалежними факторами ризику для POPF. Висновок: Пацієнти з високим балом CONUT мають високий ризик розвитку POPF. Передопераційне втручання у їжу, таке як імунодієція, може допомогти зменшити ризик POPF у цих пацієнтів.
В даний час панкреатикодуоденектомія (ПД) є основним засобом лікування злоякісних пухлин, що вражають головку підшлункової залози, нижню жовчну протоку та ампулу дванадцятипалої кишки (1,2). Ця процедура є технічно складною, високоінвазивною і пов'язана з високим рівнем захворюваності та смертності (3-5). Рівень смертності після операцій досі становить до 5% (6-8). Найважливішим фактором, що впливає на захворюваність та смертність після БД, є розвиток післяопераційного свища підшлункової залози (POPF). Згідно з останніми дослідженнями, захворюваність на POPF залишається високою, складаючи 11,4-64,3% усіх випадків ПД (9-15). POPF асоціюється із затримкою спорожнення шлунка, внутрішньочеревними абсцесами, інфекціями місця хірургічного втручання, сепсисом та кровотечами після PD (16-18). Кілька підходів можуть зменшити частоту POPF. Однак остаточний підхід, який запобігає POPF, все ще недоступний.
Оцінка контролю стану харчування (CONUT) - це автоматичний інструмент, що використовується для оцінки стану харчування. Він враховує дані лабораторних досліджень, включаючи рівень альбуміну в сироватці крові (що вказує на запас білка), загальний рівень холестерину (що свідчить про виснаження калорій) та загальний рівень лімфоцитів (що свідчить про втрату імунного захисту, спричинену недоїданням імунітету) (19). Оцінка CONUT була використана для об'єктивної оцінки стану харчування у пацієнтів із запальними захворюваннями, хронічною серцевою недостатністю та хронічними захворюваннями печінки (20-22). Нещодавно було продемонстровано, що оцінка CONUT є прогностичним або прогностичним маркером для пацієнтів із злоякісними пухлинами, включаючи колоректальний, рак стравоходу та гепатоцелюлярну карциному (23-26). Однак, наскільки нам відомо, корисність оцінки CONUT для оцінки ризику POPF після PD ще не визначена. Отже, це ретроспективне дослідження мало на меті оцінити, чи може передопераційний бал CONUT бути корисним предиктором POPF.
Пацієнти та методи
Пацієнт та збір даних. Ми розглянули дані 108 послідовних пацієнтів, які перенесли БД у відділенні хірургії клінічного центру Івакуні з квітня 2008 року по вересень 2018 року. Зібраними передопераційними даними пацієнтів були стать, вік, гіпертонія, діабет, вживання алкоголю, куріння, індекс маси тіла ( ІМТ), показник CONUT, показання до операції, діаметр магістральної протоки підшлункової залози (MPD) визначають з використанням передопераційної комп’ютерної томографії (КТ) або магнітно-резонансної холангіопанкреатографії, значення загасання КТ [пізнє/раннє (L/E) співвідношення] в тілі підшлункової залози, переливання крові, крововтрата, час операції та використання методики панкреатоєєуностомії. Неад'ювантну хіміотерапію пацієнтам з прикордонним резектабельним раком підшлункової залози проводили з березня 2015 року по вересень 2018 року.
Комітет з етики клінічного центру Івакуні затвердив протокол дослідження (номер затвердження: 0191). Це дослідження було проведено відповідно до протоколів Гельсінкської декларації 1975 року.
Передопераційний розрахунок балу КОНУТ і значення граничного значення. Оцінка CONUT була розрахована з використанням рівня сироваткового альбуміну, загальної кількості лімфоцитів та загального рівня холестерину для кожного пацієнта (19). Концентрації альбуміну ≥3,5, 3,0-3,49, 2,5-2,99 та 3 оцінювались як 0, 1, 2 та 3 бали відповідно. Загальна концентрація холестерину ≥180, 140-179, 100-139 та 22 дні і не виявляла підвищеної запальної реакції або не вимагала прийому антибіотиків, визначали як POPF ступеня B, спричинену тривалим розміщенням стоків. Всякий раз, коли потрібні були серйозні зміни в клінічному веденні або відхилення від нормального клінічного шляху або сталася недостатність органу, свищ класифікували як POPF ступеня С. Латентний POPF (36) був визначений як POPF, у якому спочатку не було багатих амілазою стоків, але в кінцевому підсумку прогресував до клінічно значущого POPF.
Визначення оперативної смертності. Оперативна смертність визначалася як будь-яка смерть, незалежно від причини, що настала протягом 30 днів після операції в лікарні або поза нею, а також через 30 днів під час тієї ж госпіталізації після операції.
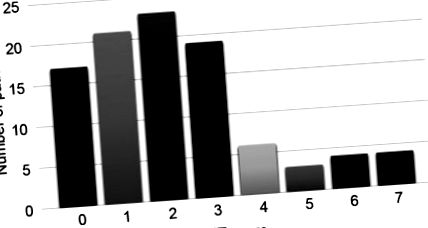
Статистичний аналіз. Статистичний аналіз проводили за допомогою неспареного t-критерію Стьюдента та тесту хі-квадрат з точним тестом Фішера. Всі змінні оцінювались за допомогою однофакторного аналізу, і лише ті, що демонстрували статистичну значущість (p Таблиця I. Середній бал CONUT становив 2 (IQR = 1-3; рис. 1). Групи з низьким та високим рівнем CONUT включали 87 (80,6% ) та 21 (19,4%) пацієнтів відповідно. Показанням до ПД була карцинома підшлункової залози у 41 (37,9%) пацієнтів. Злоякісні захворювання, включаючи карциному підшлункової залози, карциному жовчної протоки, ампулярну карциному, дванадцятипалу кишку, карциному жовчного міхура та метастатичну пухлину у 84 (77,8%) випадках. Для 10 пацієнтів з прикордонним резектабельним раком підшлункової залози проведена неоад'ювантна хіміотерапія. Середній час післяопераційного перебування в лікарні становив 22,5 (12-103) днів. Загалом (54,7%) пацієнтам був поставлений діагноз POPF, з 27 (25,0%), класифікованих як клас А, 28 (25,9%), класифікованих як клас В, і 4 (3,7%), класифікованих як клас С.
Таблиця I
AIP: аутоімунний панкреатит; ІМТ: індекс маси тіла; КОНУТ: контроль стану харчування; КТ: комп’ютерна томографія; IPMN: внутрішньопротокове папілярне муцинозне новоутворення; Співвідношення L/E: співвідношення пізньої/ранньої фази; MPD: головна підшлункова протока; MRCP: магнітно-резонансна холангіопанкреатографія; PNET: нейроендокринна пухлина підшлункової залози; СПН: тверде псевдопапілярне новоутворення. * Відповідно до класифікації Міжнародної дослідницької групи підшлункової фістули
Рівень оперативної смертності у досліджуваній популяції становив 1,9% (2/108). Один пацієнт помер від аспіраційної пневмонії та сепсису, а інший помер від черевної кровотечі, обидві пов'язані з POPF.
Демографічні та клінічні змінні двох груп, класифіковані на основі оцінки CONUT, наведені в таблиці II. Група з високим рівнем оцінки CONUT включала пацієнтів, які були значно старшими та мали нижчий рівень альбуміну в сироватці крові, нижчий рівень лімфоцитів, нижчий рівень холестерину в сироватці крові та більший рівень захворюваності на ступінь B або вище POPF, ніж у групі з низьким рівнем CONUT. Частка використання антикоагулянтів також була значно вищою у групі з високим рівнем CONUT, ніж у групі з низьким рівнем CONUT. Тривалість перебування в лікарні групи з високим рівнем оцінки CONUT була значно більшою, ніж у групи з низьким рівнем оцінки CONUT. Не було значної різниці в інших факторах між цими двома групами.
Таблиця II
ІМТ: індекс маси тіла; КТ: комп’ютерна томографія; Співвідношення L/E, співвідношення пізня/рання фаза; MPD: головна підшлункова протока; MRCP: магнітно-резонансна холангіопанкреатографія; SD: стандартне відхилення. * Відповідно до класифікації міжнародної дослідницької групи підшлункової фістули. Сміливі значення показують значення
Коли демографічні та клінічні змінні оцінювались за допомогою однофакторного аналізу для визначення їх взаємозв'язку з POPF, статистичної значимості щодо віку, статі, гіпертонії, цукрового діабету, анамнезу куріння та використання антикоагулянтів не спостерігалось (Таблиця III). POPF суттєво асоціювався з ІМТ ≥22 кг/м 2 (p = 0,015), оцінкою CONUT ≥4 (p = 0,044), непанкреатичною карциномою (p 2 [коефіцієнт шансів (OR) = 5,24; p = 0,005], CONUT оцінка ≥4 (АБО = 3,28; р = 0,042), непанкреатична карцинома (АБО = 7,17; р = 0,001) та низький коефіцієнт L/E в тілі підшлункової залози (АБО = 4,39; р = 0,029) були незалежними факторами ризику для POPF (таблиця III).
Порогові значення для кожного з факторів визначали відповідно до їх кривих ROC, що передбачають POPF. Граничне значення рівня альбуміну становило 3,2 г/дл, значення загальної кількості лімфоцитів - 1020/мм 3, а значення загального рівня холестерину - 204 мг/дл. При однофакторному аналізі POPF рівень альбуміну виявився прогностичним фактором (таблиця IV). Багатофакторний аналіз показав, що показник CONUT перевершує сироватковий альбумін, загальний рівень лімфоцитів та загальний холестерин для прогнозування POPF. Це дослідження припустило, що оцінка CONUT є більш корисною для прогнозування POPF, ніж окремі фактори, що складають оцінку CONUT (таблиця V).
Таблиця IV
ДІ: довірчий інтервал; HR: коефіцієнт небезпеки. Жирне значення показує значення
Таблиця V
ДІ: довірчий інтервал; HR: коефіцієнт небезпеки; POPF: післяопераційний свищ підшлункової залози. Сміливі значення показують значення.
Обговорення
Значно досліджено зв'язок між передопераційним станом харчування та результатами хірургічних втручань (37,38). На основі результатів таких досліджень було визнано, що поганий передопераційний харчовий статус корелює з частотою післяопераційних ускладнень. Мета-аналізи та систематичні огляди свідчать про те, що вживання їжі зменшує кількість післяопераційних ускладнень (39,40).
У цьому дослідженні результати багатоваріантного аналізу логістичної регресії показали, що показник CONUT ≥4, ІМТ ≥22 кг/м 2, непанкреатична карцинома та низький коефіцієнт L/E в організмі підшлункової залози є незалежними факторами ризику розвитку POPF. Таким чином, ми виявили кореляцію між оцінкою CONUT та POPF. Пацієнти з високим балом CONUT мали значно вищу частоту POPF, ніж ті, у кого низький бал CONUT. Наскільки нам відомо, це перша доповідь, яка досліджує взаємозв’язок між оцінкою CONUT та частотою POPF. Оцінка CONUT легко визначається за допомогою передопераційних досліджень крові та є корисним інструментом для прогнозування захворюваності на POPF.
Щодо параметрів оцінки CONUT, рівень альбуміну в сироватці крові є репрезентативним маркером харчування та часто використовується для оцінки стану поживності для прогнозування POPF (41). Гіпоальбумінемія часто пов’язана з поганим загоєнням тканин, зменшенням синтезу колагену при анастомозах та порушенням опосередкованої клітинами імунної відповіді, такою як активація макрофагів та утворення гранульоми (42). Тому інфекція на місці хірургічного втручання зазвичай спостерігається у пацієнтів з гіпоальбумінемією.
Загальна кількість лімфоцитів також є важливим маркером харчування та імунітету. Менгес та ін. виявлено, що лімфопенія, спричинена системною запальною реакцією, характеризується значним пригніченням вродженого клітинного імунітету (43). Мета-аналіз продемонстрував, що втручання з посилюючим імунітет харчуванням збільшило загальну кількість лімфоцитів і зменшило післяопераційні ускладнення (44).
Дослідження показали, що низький рівень холестерину в сироватці крові корелював із захворюваністю та смертністю після гастроентерологічних операцій (45,46), але причина цього залишається незрозумілою. Зниження рівня холестерину передбачає не лише дефіцит калорій, але й те, що клітини позбавляються необхідних поживних речовин, необхідних для підтримки метаболічної та гормональної рівноваги та цілісності мембрани (47). Крихкість тканин може пояснити, чому рівень холестерину пов'язаний з POPF.
POPF (ступінь B та C) є найпоширенішим та найскладнішим ускладненням PD та може спровокувати небезпечні для життя, затримані, масивні внутрішньочеревні кровотечі та септицемію. Таким чином, раннє прогнозування цього ускладнення може покращити післяопераційний моніторинг пацієнтів, які мають високий ризик розвитку POPF. Прогнози POPF були широко вивчені. Факторами, які, як повідомляється, були пов’язані з POPF - це чоловіки, літній вік, передопераційна жовтяниця, інтраопераційна крововтрата, низький рівень альбуміну, високий бал Американського товариства анестезіологів, тривалий час операції, м’яка підшлункова залоза, високий ІМТ, малий діаметр MPD та панкреатикоджеюнал анастомоз (14,18,48-50).
Можливо, зміна оцінки CONUT пацієнта зменшить частоту POPF. Для підтримання або поліпшення передопераційного харчування досліджується кілька підходів. Однак дослідження з великою когортою, спрямовані на встановлення факторів ризику післяопераційної захворюваності, не включали рівень цих холестерину в сироватці крові як змінну (3,51). Можлива корисність рівня холестерину як прогностичного маркера має бути підтверджена майбутніми дослідженнями.
М'яка підшлункова залоза та підвищений ІМТ вже широко прийняті як фактор ризику, пов'язаний з пацієнтом, який схильний до POPF (27-32). Ми оцінили стійкість підшлункової залози, використовуючи співвідношення L/E, яке, як пропонується, асоціюється з текстурою паренхіми підшлункової залози. Співвідношення L/E позитивно корелювало з твердістю підшлункової залози, що відображало гістологічний ступінь фіброзу підшлункової залози. Наші дані показали, що співвідношення L/E було значно нижчим у пацієнтів з POPF. Як результат, м’яка підшлункова залоза була пов’язана з POPF. Високий рівень захворюваності POPF у пацієнтів з високим ІМТ або м’якою підшлунковою залозою може призвести до збільшення труднощів оголення підшлункової залози під час хірургічного втручання через більший обсяг черевного та навколошлункового жиру, до більшого ризику пошкодження капсули підшлункової залози під час відділення через м’якої та ламкої підшлункової залози, а також підвищує ризик витоку підшлункової залози, спричинений пошкодженням тканин підшлункової залози та тонких проток підшлункової залози через накладення швів та вузлів під час панкреатоєюнального анастомозу (52).
Встановлено, що рак не підшлункової залози, такий як ампулярна карцинома, карцинома жовчної протоки або внутрішньопротокові папілярні муцинозні новоутворення, є фактором ризику POPF, оскільки ці захворювання чітко відображають характеристики залишків підшлункової залози, такі як м’яка текстура підшлункової залози, тонке тіло підшлункової залози та нефібротична паренхіма підшлункової залози, що значно збільшує ризик розвитку POPF (53).
Згода на публікацію
Пацієнти не повинні були надавати інформовану згоду на дослідження, оскільки в аналізі використовувались анонімні дані, отримані після того, як пацієнт погодився на лікування за письмовою згодою.
Конфлікт інтересів
Автори заявляють, що у них немає конкуруючих інтересів щодо цього дослідження.
Внески авторів
MU, HA, SN, SN, YU, HK, YK, FT, TA, KK та KT розробили дослідження. HA, MU та YK лікували та спостерігали пацієнтів. MU підготував статтю та здійснив пошук літератури. HA виправила та переглянула статтю. Усі автори прочитали та схвалили остаточну статтю.
- Оцінка поживності
- Харчовий статус чотирьох видів гігантських сухопутних равликів у Нігерії SpringerLink
- Харчовий статус у пацієнтів після резекції шлунка через рак шлунка - PubMed
- Харчовий статус у дітей з вродженими вадами серця, що не управляються, Єгипетський центр
- Харчовий статус чотирьох видів гігантських сухопутних равликів у Нігерії